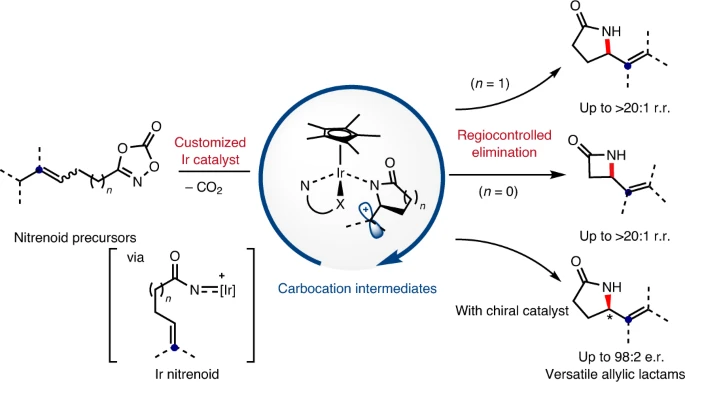
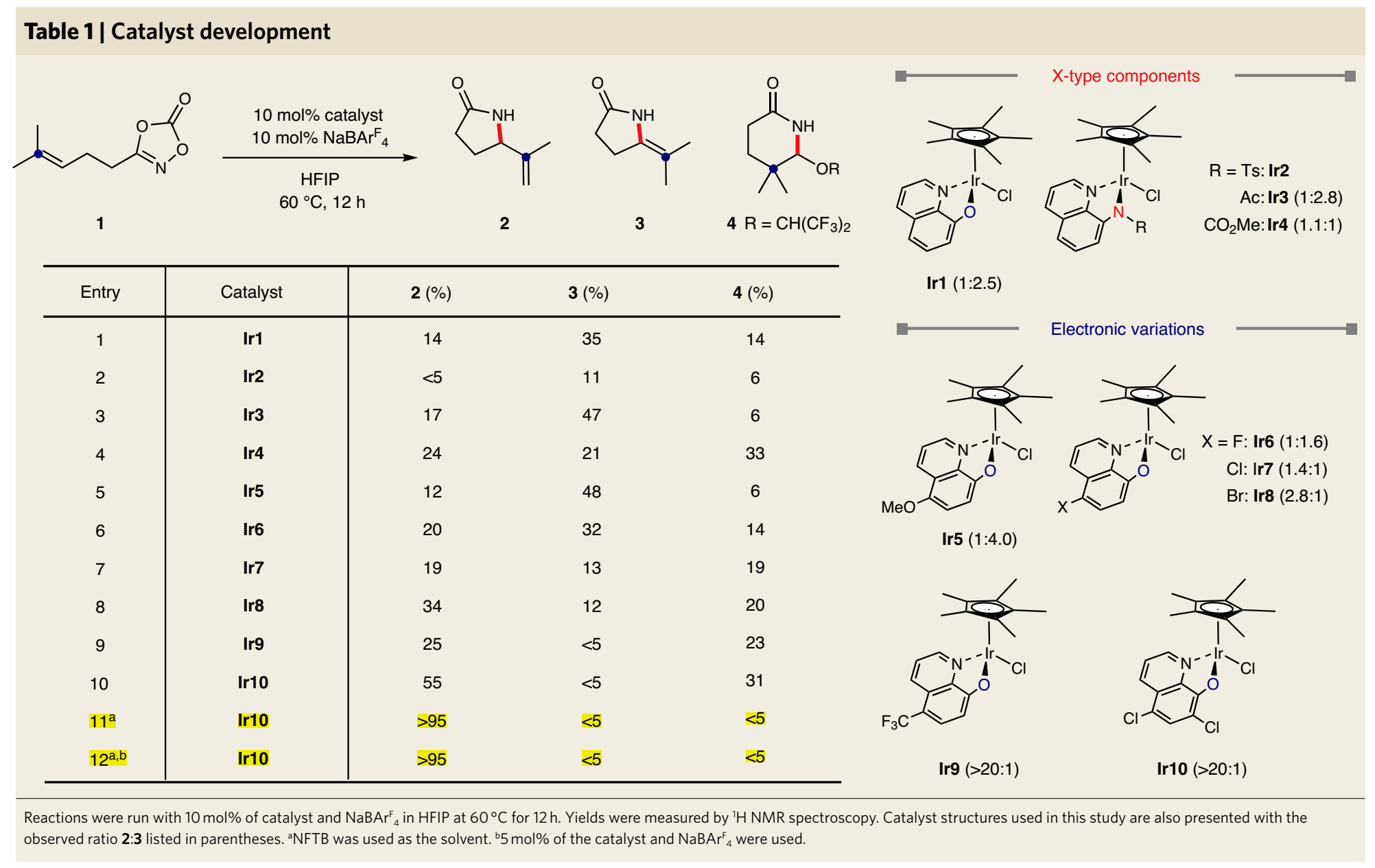
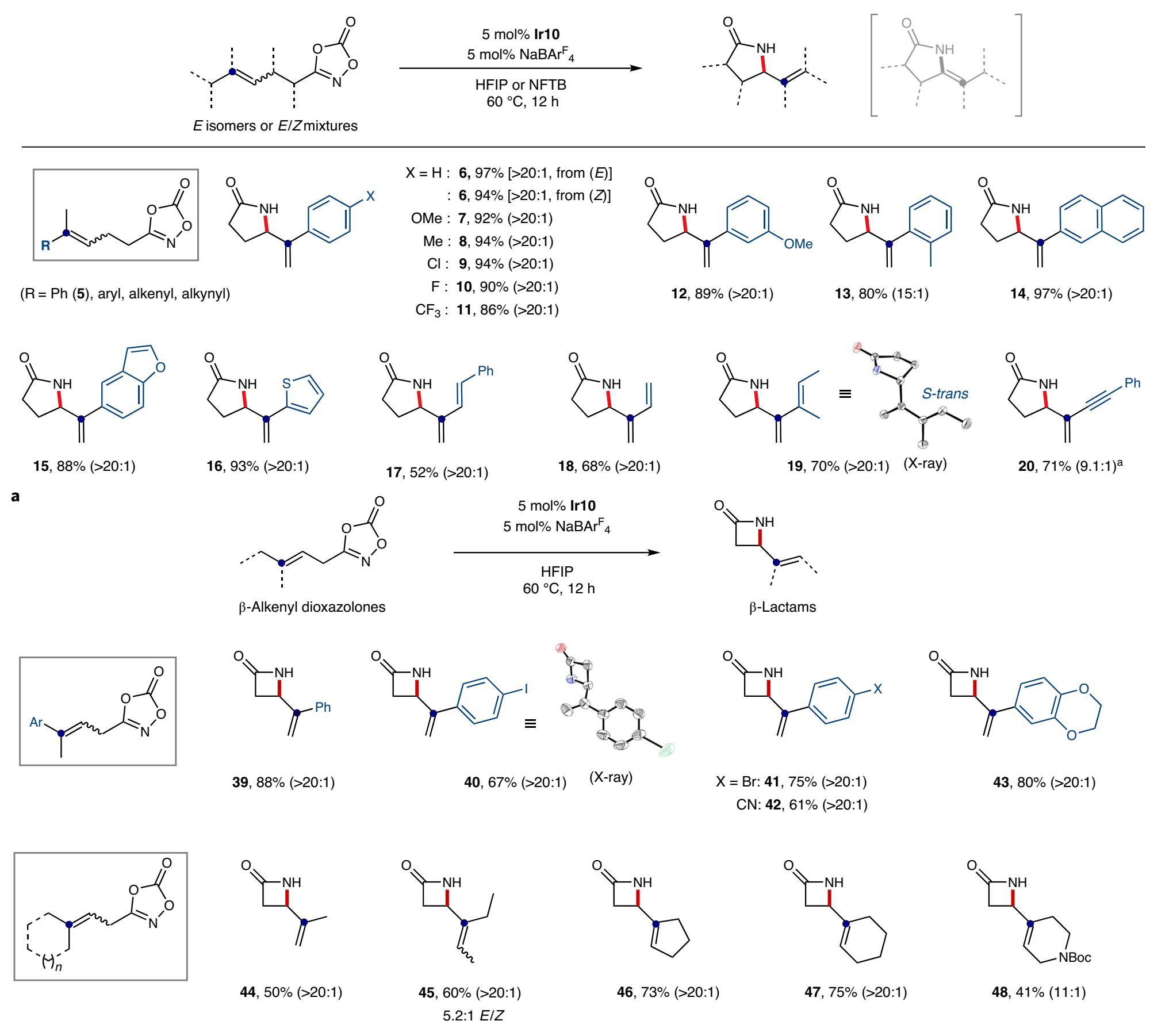
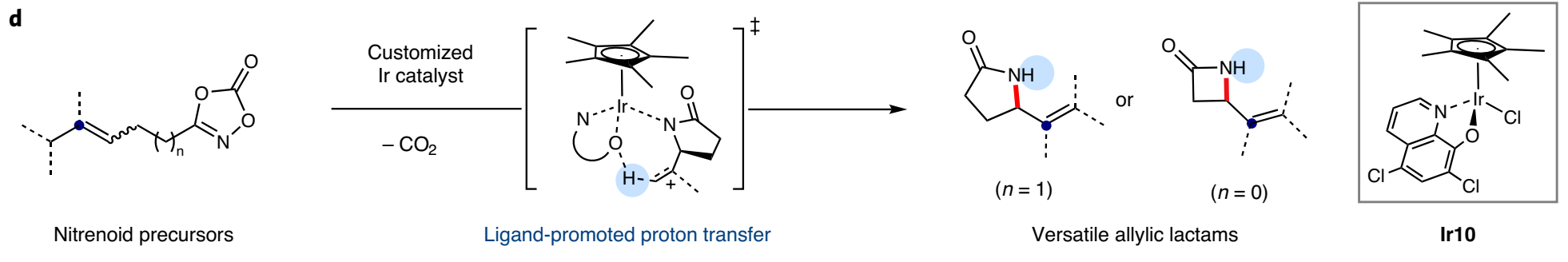
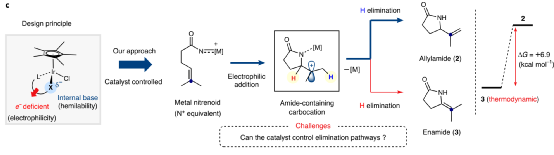
碳正離子中間體是有機化學反應中的重要過程,是對設計合成進行逆合成分析的基礎。目前有一些催化反應過程被設計為在溫和反應條件中產生瞬態碳陽離子中間體,但是選擇性的控制、合成反應的應用仍有較大擴展空間。有鑒于此,韓國基礎科學研究所(IBS) Sukbok Chang等報道了通過金屬-氮烯向烯烴的轉移得到碳正陽離子中間體,隨后進行區域選擇性消除,合成含有烯烴官能團取代基的四元環/五元環結構烯丙基內酰胺。通過優化催化劑結構,抑制了競爭性副反應,實現了較好的區域選擇性。反應機理研究結果顯示,該反應中羥基喹啉配體作為堿,控制質子轉移過程中的選擇性。基于之前發現的五甲基環戊二烯基/8-羥基喹啉修飾Ir催化劑,以二惡唑酮反應物作為氮烯前體分子,烯烴/炔烴官能團作為nitrenoid中間體受體。該催化體系中通過調控雙齒羥基喹啉配體的電子結構,抑制中間體Curtius分解過程,改善目標反應的選擇性。反應優化。以γ-(二甲基烯基)二惡唑酮(1)作為反應物,10 mol %Cp*Ir(κ2-chelate)作為催化劑,加入10 mol % NaBArF4,在60 ℃六氟異丙醇/九氟叔丁醇中進行反應。反應中可能生成三種內酰胺產物(2~4),通過調控8-羥基喹啉配體中芳基環上的電子濃度,當羥基喹啉環上修飾兩個氯,很好的改善了內酰胺產物結構的選擇性,以>20:1的選擇性生成烯烴修飾五元環狀內酰胺(2)。在該體系中,當以β-烯基二惡唑酮作為反應物,該反應中得到四元環狀內酰胺產物。通過對Ir催化劑中配體的電子結構調控,二惡唑酮反應物在Ir催化劑作用中脫CO2反應,形成Ir-氮烯中間體,隨后Ir-氮烯(nitrenoid中間體)作為N中心親電物種對烯烴進行親電加成,同時對碳正離子α-H還原消除的區域選擇性進行導向。該過程來自于一種生物無機、均相催化策略,配體促進質子轉移,通過調控雙齒配體,使得該反應中在分子內質子轉移過程中有較高的選擇性。Seung Youn Hong, Dongwook Kim, and Sukbok Chang*, Catalytic access to carbocation intermediates via nitrenoid transfer leading to allylic lactams, Nat Catal (2020).DOI: 10.1038/s41929-020-00558-xhttps://www.nature.com/articles/s41929-020-00558-x