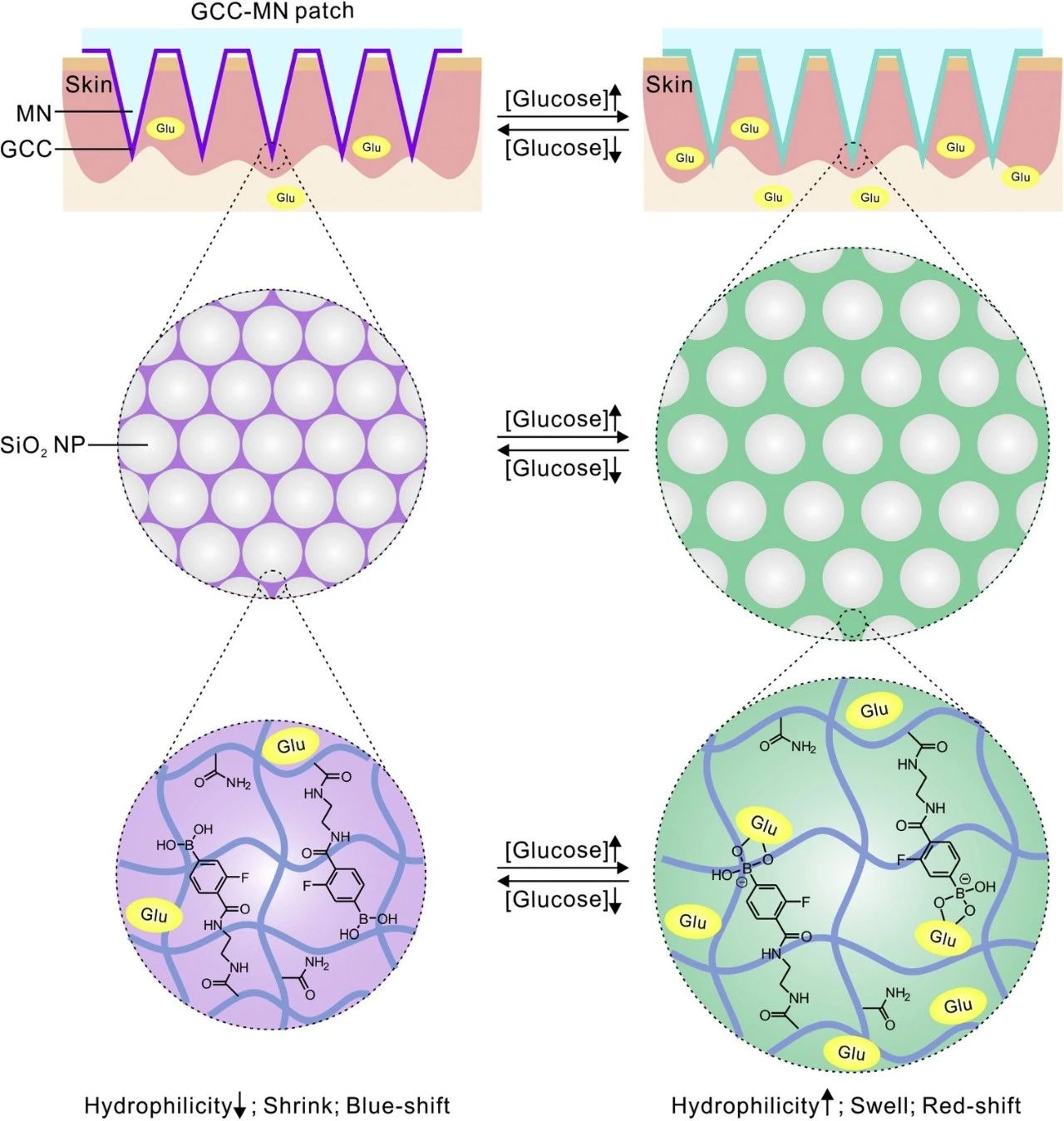
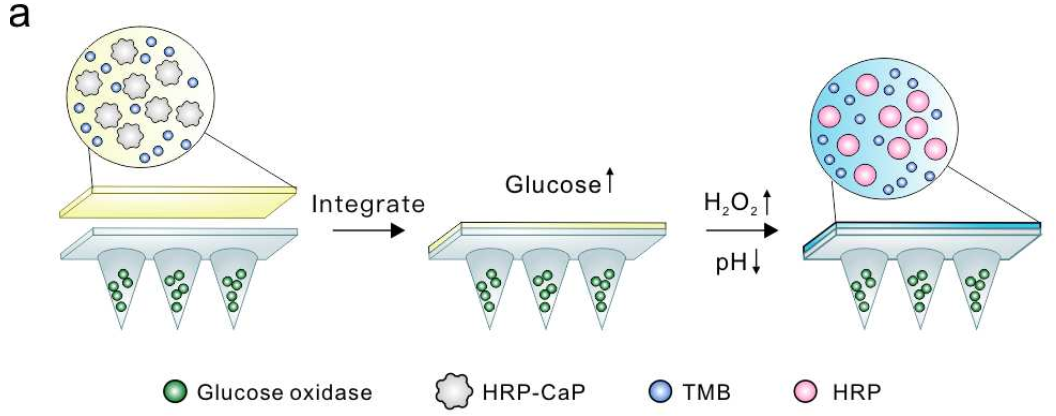
奇物論聯合納米人編輯部對2020年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是浙江大學藥學院院長顧臻教授課題組。顧臻,現任浙江大學求是講席教授、藥學院院長。顧臻團隊致力于將生物材料設計,生物大分子工程以及微/納米工程整合到新的藥物輸送策略中,且應用刺激響應系統以劑量、空間和時間控制的方式來輸送和或釋放治療劑。目前已在Nature Nanotechnology、Nature Biomedical Engineering、Nature Chemical Biology、Science Translational Medicine等期刊發表學術論文200余篇,授權公司專利100余項。以下按照兩個部分對顧臻團隊2020年期間發表的部分成果進行歸納,供大家學習和交流。1. Science Advances封面,液氮凍死癌細胞,作藥物載體!顧臻教授研究團隊聚焦于AML細胞本身地歸巢能力,開發了一種使用急性髓細胞性白血病細胞作為藥物載體,同時消除其固有致病性的方法。該團隊主要是利用液氮低溫處理而獲得治療性死細胞,這些細胞可以保持完整的結構,從而保持其骨髓歸巢能力,還可以包封藥物,但失去了增殖能力和致病性。這種基于“死細胞”的遞送載體,可實現快速制備,從而有望實現臨床轉化。成果發表在Science Advances期刊上,并被遴選為期刊封面。Tianyuan Ci, et al., Cryo-shocked cancer cells for targeted drug delivery and vaccination. Science Advances 2020.DOI: 10.1126/sciadv.abc3013https://advances.sciencemag.org/content/6/50/eabc30132. AM:工程化表達PD-L1的血小板逆轉新發1型糖尿病1型糖尿病(T1D)的發病機制是胰島特異性自身反應性T細胞破壞產生胰島素的β細胞。抑制胰島特異性自身反應性T細胞來拯救β細胞是治療新發T1D的一種有前途的方法。免疫檢查點信號軸程序性死亡-1/程序性死亡配體1(PD-1/PD-L1)可有效調節T細胞活性,防止自身免疫攻擊。在此,美國加州大學洛杉磯分校顧臻、深圳大學黃鵬、德雷塞爾大學成昊等人使用巨核細胞前體細胞通過基因工程過表達PD-L1以產生免疫抑制的血小板。1)PD-L1過表達的血小板(稱為PD-L1血小板)聚集在發炎的胰腺中,可能抑制新發高血糖非肥胖糖尿病(NOD)小鼠胰腺自身反應性T細胞的活性,從而保護產生胰島素的β細胞不受破壞。2)此外,PD-L1血小板治療還增加了調節性T細胞(Tregs)的百分比,并維持了胰腺的免疫耐受。結果表明,PD-L1血小板對β細胞的保護作用能有效維持新發高血糖NOD小鼠的正常血糖,逆轉糖尿病。Xudong Zhang, et al. Engineered PD-L1-Expressing Platelets Reverse New-Onset Type 1 Diabetes, Adv. Mater., 2020.DOI: 10.1002/adma.201907692https://doi.org/10.1002/adma.2019076923. Science Advances:通過DNA介導的生物反應編輯遞送CRISPR-Cas12a用于調節膽固醇CRISPR系統已成為功能強大的生物技術工具,在基礎研究和藥物學中發現了多種應用。然而,有效遞送系統的可用性嚴重阻礙了CRISPR系統的治療性轉化。除廣泛研究的CRISPR-Cas9外,CRISPR-Cas12a還是一種有效的基因組編輯工具。然而,為CRISPR-Cas12a開發有效的非病毒遞送系統仍然具有挑戰性。于此,加州大學洛杉磯分校顧臻教授、Wujin Sun等人展示了一種基于DNA納米分子(NC)的載體,可用于傳遞Cas12a/CRISPR RNA(crRNA)核糖核蛋白(RNP)來調節血清中的膽固醇水平。DNA-NC可通過DNA-NC與crRNA的互補作用,有效地負載Cas12a/crRNA-RNP。陽離子聚合物層的加入使DNA模板核濃縮,并允許進一步涂覆電荷反轉聚合物層,這使得該組裝在生理pH下帶負電,但在酸性環境下恢復為正電荷。當選擇Pcsk9作為靶基因時,由于其在調節血清膽固醇水平方面的重要作用,體內可觀察到有效的Pcsk9破壞(~48%),顯著降低Pcsk9的表達,獲得膽固醇控制的治療效果(約有45%的膽固醇降低)。綜上所述,這種載體提供了一種平臺策略,可以通過應用適當的靶向配體而適于靶向其他器官。crRNA還可以被重新編程以靶向其它感興趣的基因,用于治療不同的疾病,并且CRISPR-Cas12a的高度多樣性可以方便地同時靶向多個基因。Wujin Sun, et al. CRISPR-Cas12a delivery by DNA-mediated bioresponsive editingfor cholesterol regulation. Sci. Adv. 2020DOI:10.1126/sciadv.aba2983https://advances.sciencemag.org/content/6/21/eaba29834. Matter:通過使用血小板源性細胞外囊泡靶向遞送TPCA-1來緩解肺炎中的細胞因子風暴由于肺組織炎癥失控,肺炎可導致高發病率和高死亡率。平息細胞因子風暴可能是挽救重癥肺炎患者生命的關鍵之一。有鑒于此,美國加利福尼亞大學的Zhen Gu和蘇州大學的Chao Wang等研究人員,受血小板對炎癥部位的內在親和力的啟發,設計了血小板衍生的細胞外小泡(PEV),用于肺炎靶向給藥。1)在急性肺損傷(ALI)小鼠模型中,血小板活化后容易產生的PEV可以選擇性地靶向肺炎。2)PEV通過負載可抑制炎癥因子產生的[5-(對氟苯基)-2-脲基]噻吩-3-甲酰胺(TPCA-1),抑制肺部炎癥細胞浸潤,平息局部細胞因子風暴,明顯提高治療效果。3)此外,研究人員發現PEV可以作為一個廣泛的平臺,選擇性地靶向各種炎癥部位,包括慢性動脈粥樣硬化斑塊、類風濕性關節炎和與皮膚相關的傷口。Qingle Ma, et al. Calming Cytokine Storm in Pneumonia by Targeted Delivery of TPCA-1 Using Platelet-derived Extracellular Vesicles. Matter, 2020.DOI:10.1016/j.matt.2020.05.017https://www.sciencedirect.com/science/article/pii/S25902385203025025. ACS Nano:靶向給藥Notch抑制劑可減輕肥胖引起的葡萄糖耐受不良和肝纖維化隨著肥胖型2型糖尿病(T2DM)和非酒精性脂肪性肝炎(NASH)發病率的持續增加,對藥物治療的需求變得迫切。然而,為這些慢性疾病尋找和開發新的治療策略的努力與安全性的需要相平衡,阻礙了臨床翻譯。這兩種疾病的共同病理之一是肝臟中Notch信號通路的不適應性重新激活。γ-分泌酶抑制劑的缺口拮抗可有效抑制NASH的肝糖生成,減輕肝纖維化,但其肝外副作用,尤其是杯狀細胞化生,限制了其治療效果。有鑒于此,美國加利福尼亞大學的顧臻和美國哥倫比亞大學的LiQiang、Utpal B. Pajvani等研究人員,開發了一種納米顆粒介導的遞送系統來靶向肝臟γ分泌酶抑制劑(GSI NPs)。1)GSI NP的應用減少了飲食誘導的肥胖小鼠的肝臟葡萄糖的產生,并減輕了喂食NASH引起的飲食的小鼠的肝纖維化和炎癥,沒有明顯的胃腸道毒性。2)通過改變給藥方法,這些結果為改變以前不能耐受的藥物的用途提供了概念驗證,以解決肥胖引起的T2DM和NASH臨床環境中未得到滿足的需求。Lauren R. Richter, et al. Targeted Delivery ofNotch Inhibitor Attenuates Obesity-Induced Glucose Intolerance and LiverFibrosis. ACS Nano, 2020.DOI:10.1021/acsnano.0c01007https://pubs.acs.org/doi/abs/10.1021/acsnano.0c010076. Nature Biomedical Engineering: 胰島素貼片:一天貼一次,全球4億糖尿病患者的福音糖尿病——一種經常導致嚴重繼發并發癥的慢性疾病,影響全球超過4.25億人。胰島素治療在1型糖尿病患者的生活中是必需的,并且通常用于胰島β細胞功能減退的2型糖尿病患者。日常注射通常遇到很多痛苦,包括頻繁監測血糖水平和每天多次皮下注射或輸液。這種方法更是繁重且復雜,并且常常由于控制不當和由于錯誤計算的劑量而導致危及生命的低血糖。 有鑒于此,UCLA顧臻教授團隊于近日開發出新一代的經皮智能胰島素貼片——“智能胰島素貼片2.0”。該胰島素貼片只有硬幣大小(5 cm2),易于工業生產制造,可實現臨床相關劑量的和快速葡萄糖依賴性的胰島素釋放,調節葡萄糖釋放時間可超過20h。葡萄糖響應制劑與基于微針的經皮胰島素技術的結合,為改善葡萄糖水平的調節提供了廣闊的前景。另外,在這項研究中開發的GR-MN貼片還為其他藥物(如胰島素類似物,類胰高血糖素肽1受體激動劑和胰高血糖素)的刺激響應性經皮遞送系統的開發提供了技術。 據了解,該技術已被FDA的新興技術計劃接受,且研究人員正在為人類臨床試驗申請FDA批準,預計可以在幾年內開始實施。 Yu,J., Wang, J., Zhang, Y. et al. Glucose-responsive insulin patch for theregulation of blood glucose in mice and minipigs. Nat Biomed Eng (2020).https://doi.org/10.1038/s41551-019-0508-y7. PNAS:經皮的冷大氣等離子體介導的免疫檢查點封鎖療法提高免疫檢查點阻斷(ICB)治療的療效和減少副作用的策略與臨床應用息息相關。于此,顧臻等人描述了經皮的冷大氣等離子體(CAP)介導的ICB治療。CAP通過空心結構微針作為微通道的局部遞送促進了CAP釋放腫瘤相關抗原。隨后的T細胞介導的免疫反應可以通過微針傳遞的免疫檢查點抑制劑增強,從而增強局部和全身的抗癌免疫。CAP和ICB與微針的協同作用為腫瘤和其他疾病的治療提供了一個平臺Guojun Chen, et al., ransdermal cold atmospheric plasma-mediated immune checkpoint blockade therapy, Proceedings of the National Academy of Sciences U.S.A. (PNAS), 7(3687), 2020DOI:10.1073/pnas.19178911178. PNAS:混合貼片對胰島素和胰高血糖素的雙重自我調節遞送目前用于逆轉胰島素缺乏癥的糖尿病治療方法的療效往往受到急性低血糖癥頻繁發生的限制。為此,顧臻等人設計了一種混合型葡萄糖敏感釋放貼片,通過在高血糖和低血糖狀態下分別釋放胰島素和胰高血糖素,使其發揮合成人工胰腺的功能。開發了一種面膜介導的聚合方法來裝載胰島素和胰高血糖素模塊,它們共享共聚基質但包含不同比例的關鍵單體。發現這兩個模塊的協同反調節可增強雜化貼片在血糖波動期間維持正常血糖的能力。這種平臺策略有助于開發定制的治療貼片,以精確的方式進行閉環遞送。Dual self-regulated delivery of insulin and glucagon by a hybrid patch, Proceedings of the National Academy of Sciences U.S.A. (PNAS), 117(29512), 2020DOI:10.1073/pnas.20110991179. Nano Today:膠體晶體微針貼片用于監測血糖血糖監測是1型或2型晚期糖尿病患者的日常工作。為了提高患者的依從性,需要最小化侵入性,改善便攜性以及增強現有葡萄糖監測裝置的可持續性。于此,加州大學洛杉磯分校顧臻教授、東南大學顧忠澤等人描述了一種用于肉眼葡萄糖監測的微創膠體晶體微針(MN)貼片。1)葡萄糖反應性膠體晶體(GCC)-MN的設計采用聚合核來機械支撐GCC的外殼,以進行葡萄糖感測和報告。2)GCC-MN貼片可在5min內將葡萄糖濃度轉化為肉眼可見的顏色變化,這種葡萄糖反應是可逆的。在1型糖尿病小鼠模型中,使用GCC-MN貼片可同時進行組織液提取、葡萄糖感應和葡萄糖相關的彩色顯示程序。Yi Zeng, et al., Colloidal crystal microneedle patch for glucose monitoring. Nano Today 2020.https://doi.org/10.1016/j.nantod.2020.10098410. Biomaterials:透皮比色貼劑用于對糖尿病小鼠進行高血糖傳感分析加州大學洛杉磯分校顧臻教授制備了一種可以用于檢測小鼠高血糖的透皮比色貼劑。研究表明,3、3、5、5 -四甲基聯苯胺(TMB)的顯色變化可由葡萄糖氧化酶(GOx)和辣根過氧化物酶(HRP)在高的葡萄糖水平下通過級聯酶反應而引起。實驗利用磷酸鈣(CaP)殼對該貼劑上層的HRP進行生物礦化反應,使其具有pH響應的特性,并可提高檢測的敏感性以及防止發生非特異性反應。實驗結果表明,該比色傳感器可以對小鼠間質液進行微創提取,并將葡萄糖水平迅速轉化為可見的顏色變化,而定量的紅、綠、藍(RGB)信息可以通過微針的掃描圖像獲得。因此,這種低成本的便攜式比色傳感器可以在不抽血的情況下對每日血糖水平進行檢測。Zejun Wang, Zhen Gu. et al. Transdermal Colorimetric Patch for Hyperglycemia Sensing in Diabetic Mice. Biomaterials. 2020https://www.sciencedirect.com/science/article/pii/S0142961220300284此外,顧臻團隊2020年還發表了其他相關的高水平研究論文,由于篇幅關系就不在此一一展示,感興趣的讀者可前往該課題組網站進行學習。課題組網站:https://imedicationlab.net/顧臻,江蘇南通人,浙江大學求是講席教授、藥學院院長。本科、碩士畢業于南京大學化學系及高分子科學與工程系;2010年于加州大學洛杉磯分校(UCLA)獲得工學博士學位;同年博士后獲聘于麻省理工學院化工系/Koch癌癥綜合研究院、哈佛大學醫學院,師從Robert Langer教授。2012-2018年任教于北卡羅萊納大學教堂山分校/北卡州立大學聯合生物醫學工程系,領導藥劑工程學科建設,并創建了 “創新轉化學位”,以促進生物醫藥技術產業化人才的培養,2018年獲評Jackson Family杰出講席教授。2018-2020年任UCLA生物工程系正教授,并任生物技術/生物醫學與工程培訓中心主任。2020年9月全職受聘于浙江大學。其指導的“iMedication-智能醫藥實驗室”研究方向包括蛋白質遞藥系統、生理響應材料、免疫治療制劑、細胞治療策略等。目前已發表學術論文200余篇,授權公司專利100余項。顧臻教授曾獲“斯隆研究獎”、英國皇家化學會Felix Franks獎章、國際藥物控釋學會(CRS)“青年學者獎”、Small青年科學家創新獎、美國糖尿病學會(ADA) “Pathway”研究獎、美國生物醫學工程學會(BMES)“細胞/分子生物工程創新者獎”等。《麻省理工科技評論》曾將其評為“TR35世界杰出創新家”。2019年當選美國醫學與生物工程院會士。其課題組首次報道了血糖響應“智能胰島素貼片”的原型,提出了閉路透皮遞藥系統的新概念,率先利用血小板的靶向性及脂肪細胞的代謝通路遞送抗癌藥物,并系統拓展了微針的生物醫用創制,相關技術正在臨床轉化。顧臻教授目前擔任《Science Advances》及《Nano Research》副主編,并任CRS中國代表。