奇物論聯合納米人編輯部對2020年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是ACS Nano的副主編、加拿大多倫多大學生物材料與生物醫學工程學院(IBBME)Warren C. W. Chan教授課題組
Warren Chan教授課題組目前致力于研究和理解納米材料與生物系統和生物分子傳感的相互作用。旨在通過工程化新型納米材料(例如無機和聚合物納米結構)以及開發微技術(例如微機電系統和毛細管流動系統)來解決生物學問題。目前已在Science、Nature Materials、Nature Nanotechnology、Nature Reviews Materials、JACS上發表上百篇論文。
一、納米醫學
1. Nature Materials:挑戰傳統,納米顆粒進入實體瘤新機制

加拿大多倫多大學Warren C. W. Chan等人探討了納米顆粒腫瘤滲透的現象,并質疑了納米顆粒進入實體瘤的機制。 該課題組發現內皮間隙并不是納米顆粒進入實體腫瘤的原因。取而代之的是,發現多達97%的納米顆粒是通過內皮細胞的主動過程進入腫瘤的。
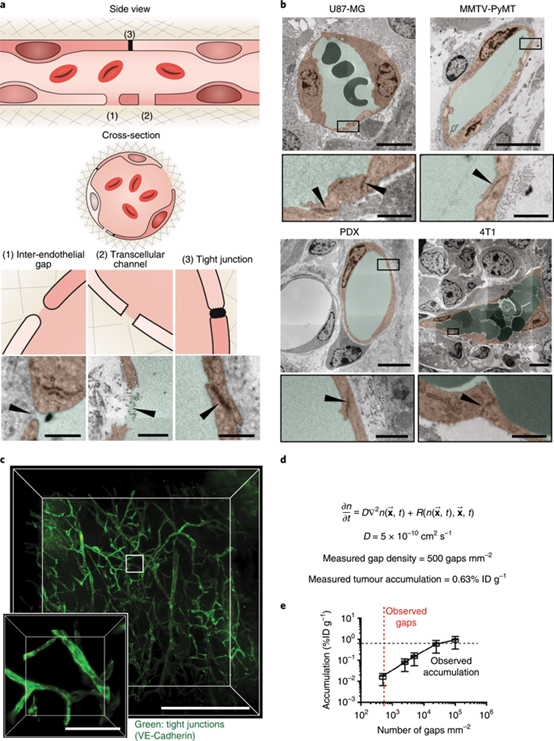
Sindhwani, S., Syed, A.M., Ngai, J. et al. The entry of nanoparticles into solid tumours. Nat. Mater. (2020)
doi:10.1038/s41563-019-0566-2
https://doi.org/10.1038/s41563-019-0566-2
2. Nature Materials,直接調節劑量即可提高腫瘤遞送效率!

加拿大多倫多大學Warren C. W. Chan等人發現給藥劑量的閾值是解決遞送效率低的關鍵,想要實現可預測和顯著的釋放,則必須打破這個劑量閾值。實驗結果證實了單次注射超過1萬億個納米顆粒的閾值可以改善腫瘤的遞送。而且還表明,對于各種納米顆粒的大小、組成和腫瘤模型,超過1萬億個納米顆粒的劑量都會顯著增加了腫瘤的遞送。
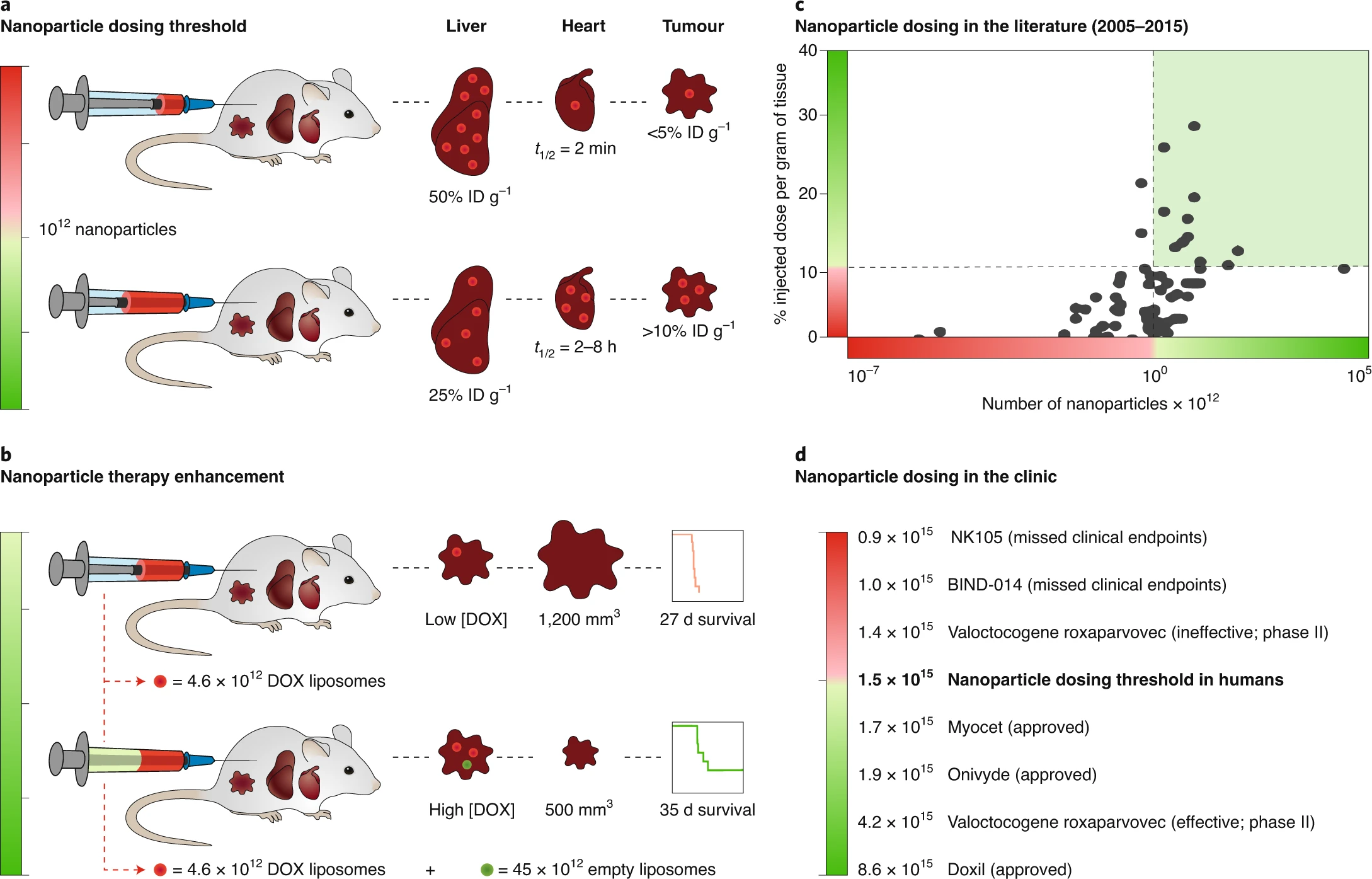
Ouyang,B., et al. The dose threshold for nanoparticle tumourdelivery. Nat. Mater. (2020).
https://doi.org/10.1038/s41563-020-0755-z
3. Nature Nanotech.:設計遞送系統的未來框架

當前的設計范式主要是從物理(即化學和材料特性)入手,而不是從生物學的角度出發。因為納米顆粒與器官組織相互作用時,這就會導致納米顆粒滯留在非靶向的器官組織,而到達疾病部位的劑量則相對減少,以致制劑的功效降低。
鑒于此,加拿大多倫多大學Warren C. W. Chan等人于Nature Nanotechnology期刊上發表重要綜述,討論了生物學的作用和它的障礙,以指導納米顆粒設計遞送藥物到目標位置。他們建議開發一個框架,以構建使用納米粒子-生物相互作用數據和計算分析來指導未來納米材料設計和傳輸策略的最佳傳輸系統。
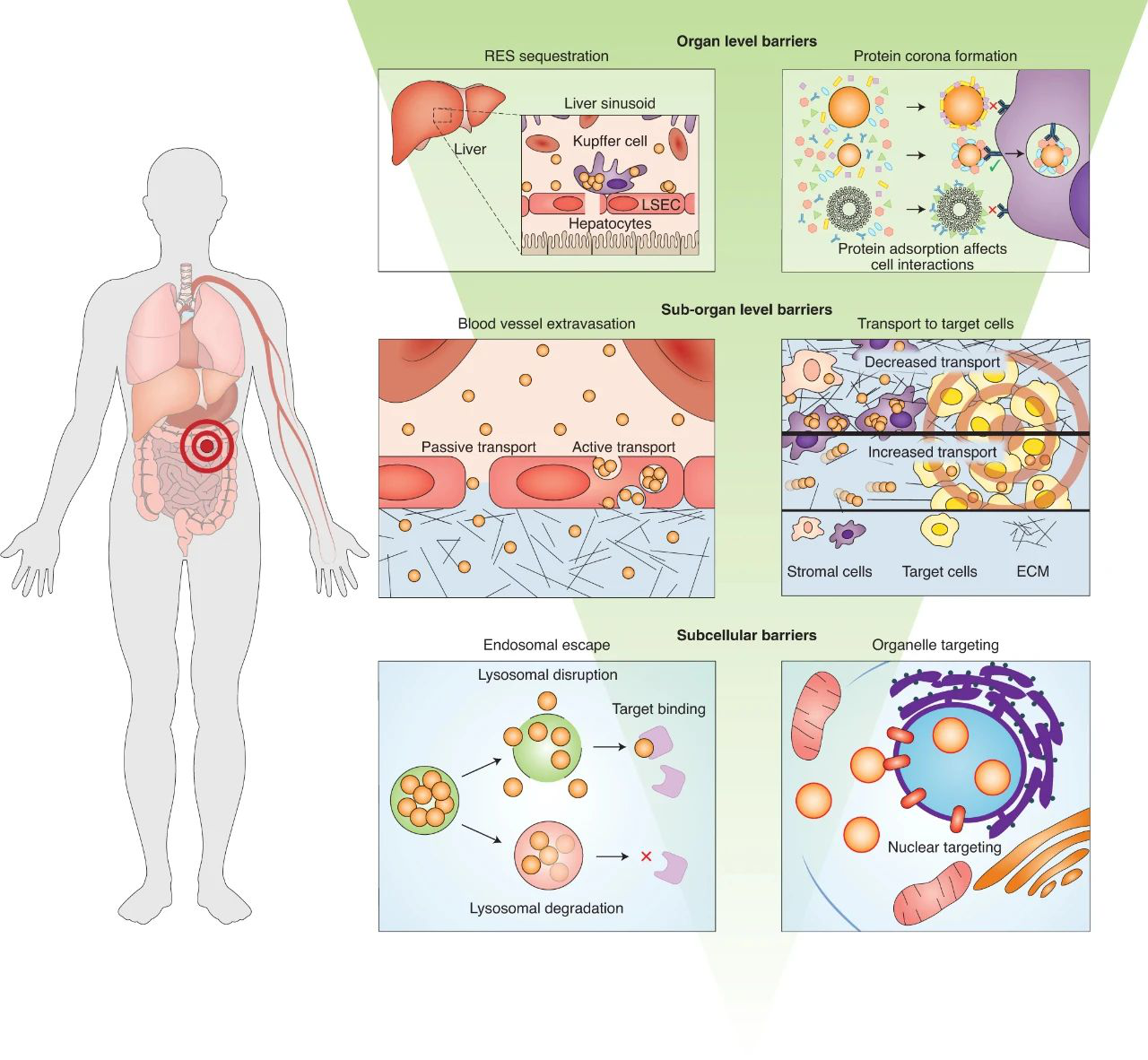
Poon,W., Kingston, B.R., Ouyang, B. et al. A framework for designing delivery systems. Nat. Nanotechnol. (2020).
https://doi.org/10.1038/s41565-020-0759-5
4. AM: 流速會不會影響納米攝取?

納米顆粒通常通過全身注射來給藥,這使得它們暴露于血流的動態環境中。注射的納米顆粒在血液中以各種流速傳播,這些流速會引起不同的血管剪切速率。內皮細胞在這些血管中排列,在循環過程中攝取納米顆粒,但是這種相互作用在體內的流量依賴性卻很難表征。
有鑒于此,加拿大多倫多大學陳志和(Warren C. W. Chan)教授課題組開發了一種微流控系統來控制納米顆粒與內皮細胞相互作用時的流速,探索流速對“納米粒子-細胞”相互作用的影響。
流速與細胞攝取成反比
研究人員將納米金顆粒在內皮細胞中的攝取以不同的流速進行定量,發現流速的增加會導致納米顆粒的攝取減少。內皮細胞對增加的流量剪切速率響應,使得吸收納米顆粒的能力降低。該平臺能夠顯示流速對細胞與納米顆粒之間相互作用的影響:流速與細胞攝取之間存在反比關系。
靶向化是否有影響?
研究人員還發現,使用靶向劑結合內皮細胞可以減輕血流速度的某些影響。用內皮細胞結合配體修飾納米顆粒表面可以將吸收部分地恢復到非流動水平,這表明功能化納米顆粒結合內皮細胞可以使納米顆粒抵抗流動效應。
綜上,該項工作是第一代旨在探索流速對“納米粒子-細胞”相互作用影響的微流控系統,設計簡單。但體內的血管情況更為復雜,未來的微流體系統將需要包括更復雜的微流控結構來模仿這種曲折的脈管系統,需要開發這樣的裝置來對納米顆粒與生物系統之間的相互作用進行基礎研究。這些研究對于設計用于醫療應用的納米材料至關重要。
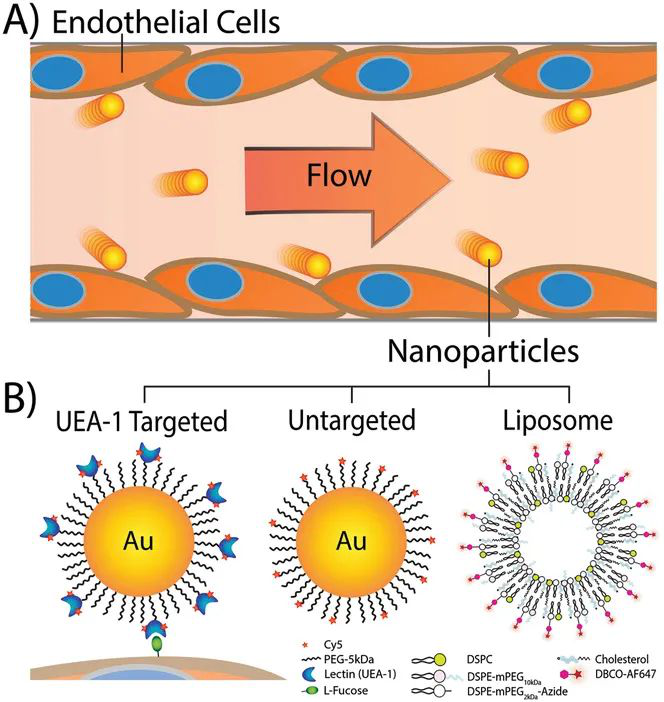
Yih Yang Chen et al. Flow Rate Affects Nanoparticle Uptake into Endothelial Cells. Adv. Mater. 2020.
https://doi.org/10.1002/adma.201906274
5. JACS: 分析納米蛋白冠的結合功能和結構組織

靜脈注射后,血液蛋白質吸附到納米顆粒的表面上,形成蛋白冠(protein corona)。盡管在過去30年中對蛋白冠進行了大量研究,但只有少數研究了血清吸附蛋白的結構和結合功能。此外,蛋白質是否可以與其靶受體結合仍不清楚。這會影響蛋白冠如何介導細胞與組織的相互作用。于此,加拿大多倫多大學Warren C. W. Chan等人使用免疫測定方法研究了蛋白冠的功能和結構組織。
本文要點:
1)研究發現,只有27%的吸附蛋白可以與目標蛋白結合。這是因為蛋白冠結構不是單層的,而是彼此結合的蛋白質的組裝體。
2)研究進一步證明了可以通過改變裝配體中蛋白質的組織來控制蛋白質的結合功能。表明操縱蛋白冠蛋白成分和組裝可以影響它們與培養中的巨噬細胞的相互作用。
這項研究為納米材料上的蛋白冠提供了詳細的功能和結構見解,并提供了一種新的策略來操縱它以控制與生物系統的相互作用。
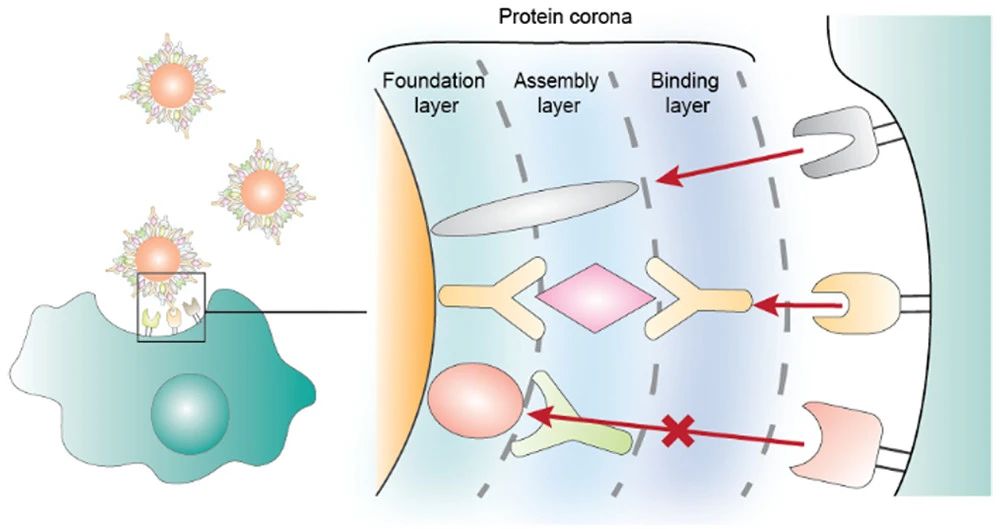
Yuwei Zhang, et al. An Analysis of the Binding Function and Structural Organization of the Protein Corona. Journal of the American Chemical Society 2020.
DOI: 10.1021/jacs.0c01853
https://pubs.acs.org/doi/10.1021/jacs.0c01853
6. ACS Nano:抑制被膜下竇巨噬細胞可增強納米疫苗向淋巴結濾泡的轉運

納米疫苗需要被運送到淋巴結濾泡,以誘導體液免疫并產生中和抗體。在此,加拿大多倫多大學Warren C.W. Chan等人發現被膜下竇巨噬細胞在阻止納米疫苗進入淋巴結濾泡方面起到了屏障作用。這通過在納米疫苗運輸過程中移除或功能性改變這些細胞后測量體液免疫反應來說明。
本文要點:
1)在抑制被膜下竇巨噬細胞后,獲得了高達60倍的抗原特異性抗體產生。抗體產生增強的程度取決于納米疫苗的劑量和大小、配方和給藥時間。
2)進一步發現,破壞巨噬細胞攝取功能的藥理制劑可以被認為是疫苗開發中的佐劑。與單獨使用納米疫苗相比,使用這些制劑配制的納米疫苗免疫小鼠可以誘導30多倍的抗原特異性抗體產生。
這些發現表明,改變運輸障礙,使更多的納米疫苗能夠輸送到淋巴結濾泡,以產生中和抗體,是促進疫苗接種的有效策略。
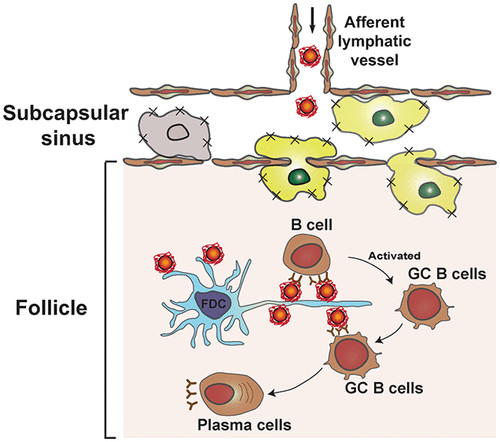
Yi-Nan Zhang, et al. Suppressing Subcapsular Sinus Macrophages Enhances Transport of Nanovaccines to Lymph Node Follicles for Robust Humoral Immunity, ACS Nano, 2020.
DOI: 10.1021/acsnano.0c02240
https://doi.org/10.1021/acsnano.0c02240
二、追蹤納米遞送
7. PNAS:使用3D顯微鏡和機器學習評估微轉移作為納米粒子的靶標

成功地向轉移性腫瘤輸送治療藥物對于控制腫瘤生長和提高癌癥患者生存率至關重要。由于目前用于分析藥物載體與轉移性腫瘤相互作用的技術的局限性,設計靶向轉移性的藥物載體具有挑戰性。加拿大多倫多大學Warren C. W. Chan等人通過開發一個新的成像和圖像分析工作流程來克服這個問題,該工作流程使能夠跟蹤納米顆粒在微轉移腫瘤中的傳遞、滲透和分布。
更重要的是,可以利用機器學習算法,根據納米顆粒的生理特性,預測納米顆粒向微轉移腫瘤的遞送。這使能夠預測可以更有效地靶向的微轉移病理生理。
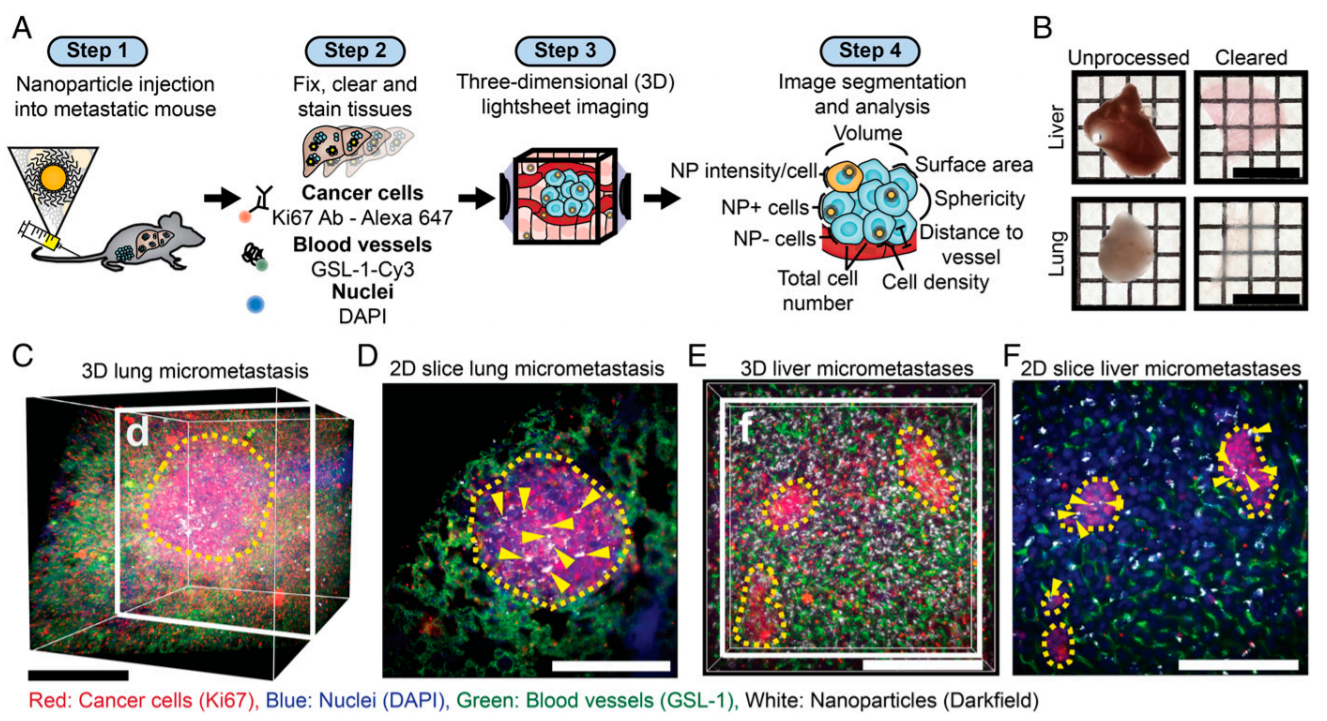
Benjamin R. Kingston, et al., Assessing micrometastases as a target for nanoparticles using 3D microscopy and machine learning. PNAS 2019 116 (30) 14937-14946
https://doi.org/10.1073/pnas.1907646116
8. Nano Letters:在光學透明組織中對脂質體成像

三維(3D)光學顯微鏡可用于理解和改善納米藥物的輸送。然而,這種方法不能用于分析組織中的脂質體,因為使組織透明成像的處理步驟通常會把脂質給除掉。于此,加拿大多倫多大學Warren C. W. Chan等人開發了一個稱為REMNANT的標簽,該標簽可對生物組織中的有機材料進行3D成像。
研究人員證明了此標簽可用于完整組織中脂質體的3D定位成像。還表明,該標簽能夠監控包裹的治療劑的釋放。還發現脂質體的貨物在體內組織中釋放比常規體外試驗快100倍以上。這使得能夠設計出一種脂質體制劑,它具有更強的殺傷腫瘤相關巨噬細胞的能力。該發展為研究在完整的生物環境中施用的有機材料的化學性質和藥效學提供了新的機會。這種方法可洞察可降解材料的體內行為,其中新發現的信息可指導下一代成像和治療劑的工程設計。
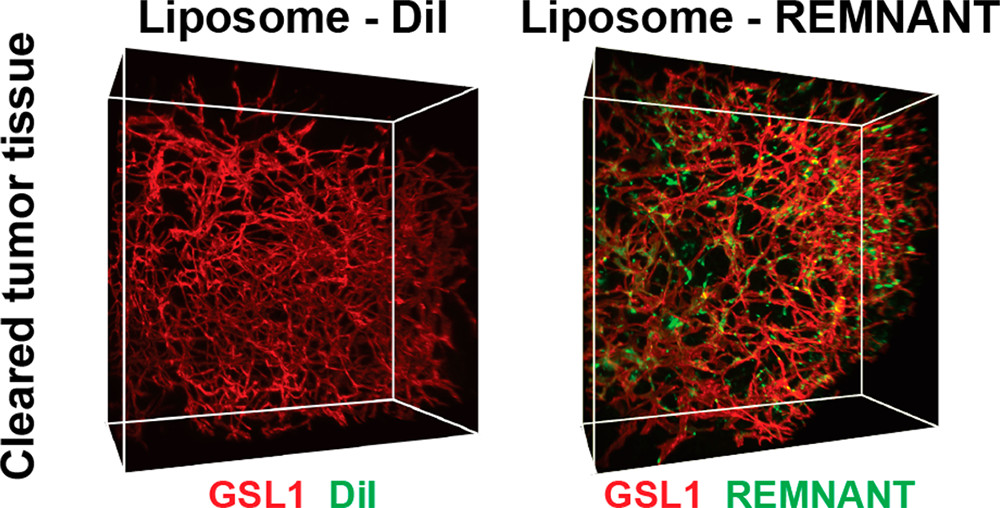
Abdullah Muhammad Syed, et al., Liposome Imaging in Optically Cleared Tissues. Nano Letters 2020 20 (2), 1362-1369
DOI: 10.1021/acs.nanolett.9b04853
三、技術優化
9. JACS: DNA控制小分子在蛋白質中的封裝

納米顆粒可以容納多種類型的治療劑和成像劑,用于疾病的治療和診斷。然而,控制分子在納米顆粒中的存儲是具有挑戰性的,因為用于封裝是利用非特異性分子間的相互作用。于此,加拿大多倫多大學Warren C. W. Chan等人使用特定的DNA相互作用將分子存儲在納米顆粒中。
本文要點:
1)研究人員制備了包含DNA錨的納米顆粒,以捕獲與DNA結合的小分子。通過改變DNA錨的序列和化學計量,研究人員可以控制納米粒子中具有不同化學性質的分子的數量和比例。
2)還通過改變包封藥物(美坦星和阿霉素)的比例來改變納米顆粒對癌細胞的細胞毒性。專門控制多種類型分子的存儲能夠優化組合藥物和納米顆粒成像的性能。
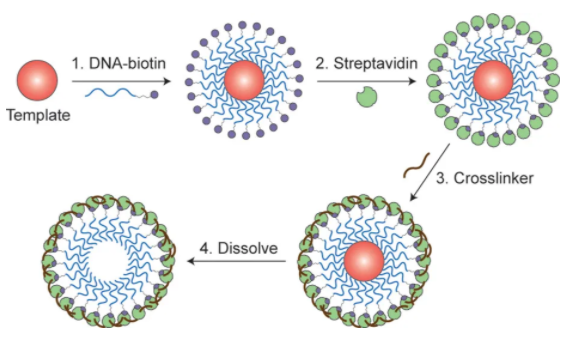
Wayne Ngo, et al., DNA-Controlled Encapsulation of Small Molecules in Protein Nanoparticles. Journal of the American Chemical Society 2020.
DOI: 10.1021/jacs.0c09914
https://pubs.acs.org/doi/10.1021/jacs.0c09914
10. PNAS: 可調節和精確的微型鋰加熱器,適用于床旁護理應用

從診斷疾病到生產疫苗,各種不同的床旁護理應用都需要生化技術。這些應用中的許多應用由于依賴電力進行溫度控制而無法在偏遠地區使用。于此,加拿大多倫多大學Warren C. W. Chan等人開發了一種微型鋰加熱器,其尺寸比現有技術小8,000倍,從而可以在床旁護理時使用生化技術。該設備可以在1分鐘的上升時間內提供從37°C到65°C的可調的加熱和在5°C以內的精確溫度。
通過在檢測病毒存在的模型工作流中使用這些加熱器,研究人員證明了它們對需要精確溫度控制的廣泛生化技術的適用性。這項技術可廣泛用于診斷和治療應用,例如在救災營地或登山探險中。
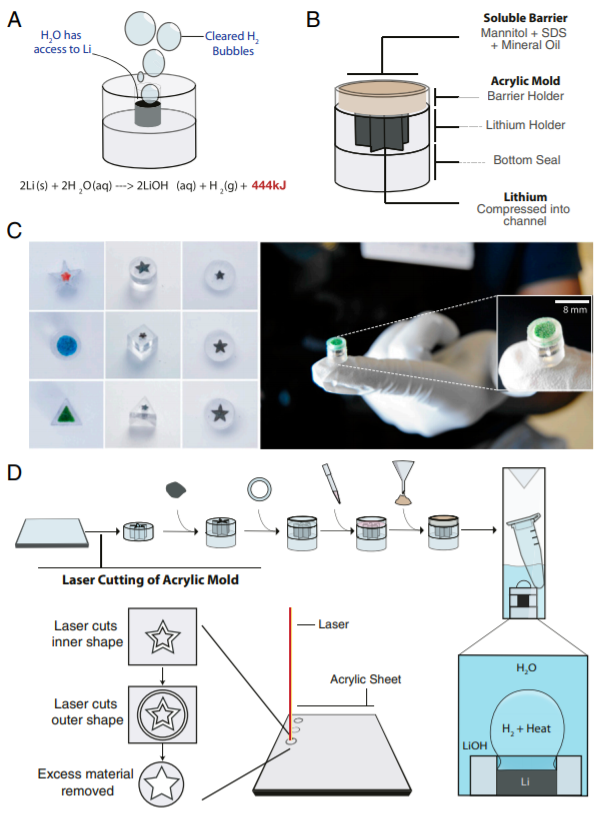
Buddhisha Udugama, et al., Tunable and precise miniature lithium heater for point-of-care applications. PNAS 2020 117 (9) 4632-4641
https://doi.org/10.1073/pnas.1916562117
11. ACS Nano:診斷COVID-19:疾病和檢測工具

最初,主要使用計算機斷層成像、全基因組測序和電子顯微鏡的結合用于篩選和鑒定SARS-CoV-2。加拿大多倫多大學Warren C. W. Chan等人在該綜述種旨在向讀者介紹SARS-CoV-2的診斷和監測技術及其性能特點。并描述了即將出現的床旁護理診斷,并鼓勵學術界將他們的技術超越概念。開發即插即用診斷技術來管理SARS-CoV-2疫情,將有助于預防未來的流行病。
Buddhisha Udugama, et al., Diagnosing COVID-19: The Disease and Tools for Detection. ACS Nano 2020 14 (4), 3822-3835
DOI: 10.1021/acsnano.0c02624

個人簡介:

Warren C. W. Chan,于2002年加入多倫多大學生物材料與生物醫學工程學院(IBBME),并于2008年晉升為副教授,并于2012年晉升為正教授。他的課題組正在開發用于診斷和治療癌癥和傳染病的納米技術。
他曾獲得Kabiller國際納米醫學獎(2015),NSERC E.W. Steacie獎學金(2012),以及2006-2016年加拿大Bionanoengineering研究主席。他之前曾擔任IBBME的協作計劃總監(2008-2011),目前是ACS Nano的副主編。











