奇物論聯合納米人編輯部對2020年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是蘇州大學功能納米與軟物質研究院劉莊教授課題組。
劉莊教授課題組近年來在生物材料與納米醫學領域從事研究,圍繞腫瘤診療中的若干挑戰性問題,發展了一系列新型納米探針用于體外生物檢測與活體分子影像,并探索了多種基于納米技術和生物材料的腫瘤光學治療、放射治療、免疫治療等新策略。共發表學術論文340余篇,論文總引用超過55,000次,SCI H-index =125。以下按照四個部分對劉莊團隊2020年期間發表的部分成果進行歸納,供大家學習和交流。1. Nature Nanotech:個體化納米疫苗獲得新進展!

目前,作為癌癥治療主要技術之一的手術切除,面對的主要的問題是癌轉移和復發。有報道稱,術后進行免疫治療,如免疫檢查點阻斷(ICB)治療,可以降低癌癥復發和轉移的風險。然而,其治療效果仍有待提高。為了制造有效的癌癥納米疫苗,至關重要的是開發既能充當免疫佐劑,還能夠將抗原直接穿梭到APC細胞質中的抗原載體。
鑒于此,蘇州大學劉莊教授、彭睿教授和華東師范大學程義云教授等人利用氟化樹枝狀大分子和聚乙烯亞胺(PEI)作為遞送抗原的載體,來制備具有有效抗原交叉呈遞的腫瘤納米疫苗,并期望實現有效的針對患者的手術后免疫療法。
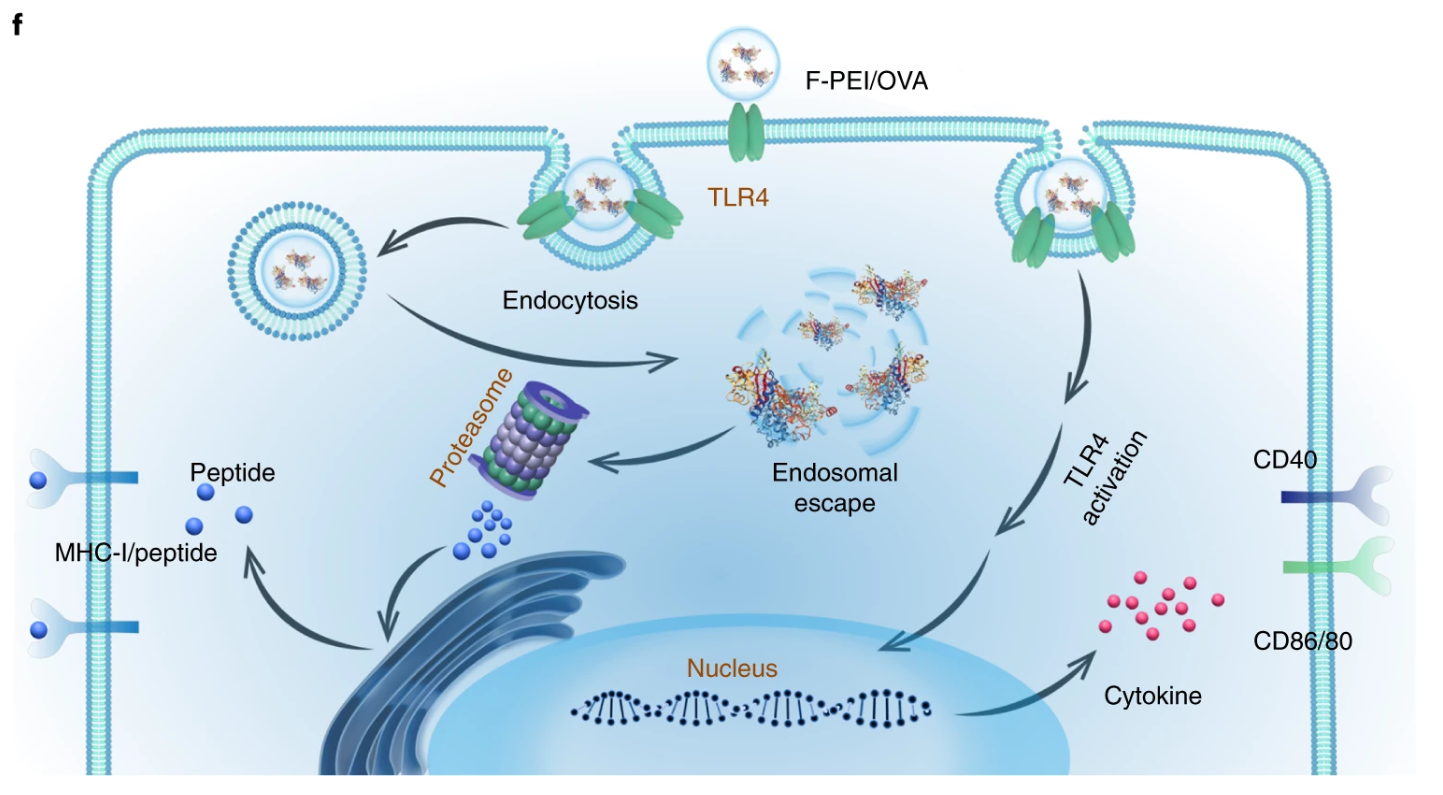
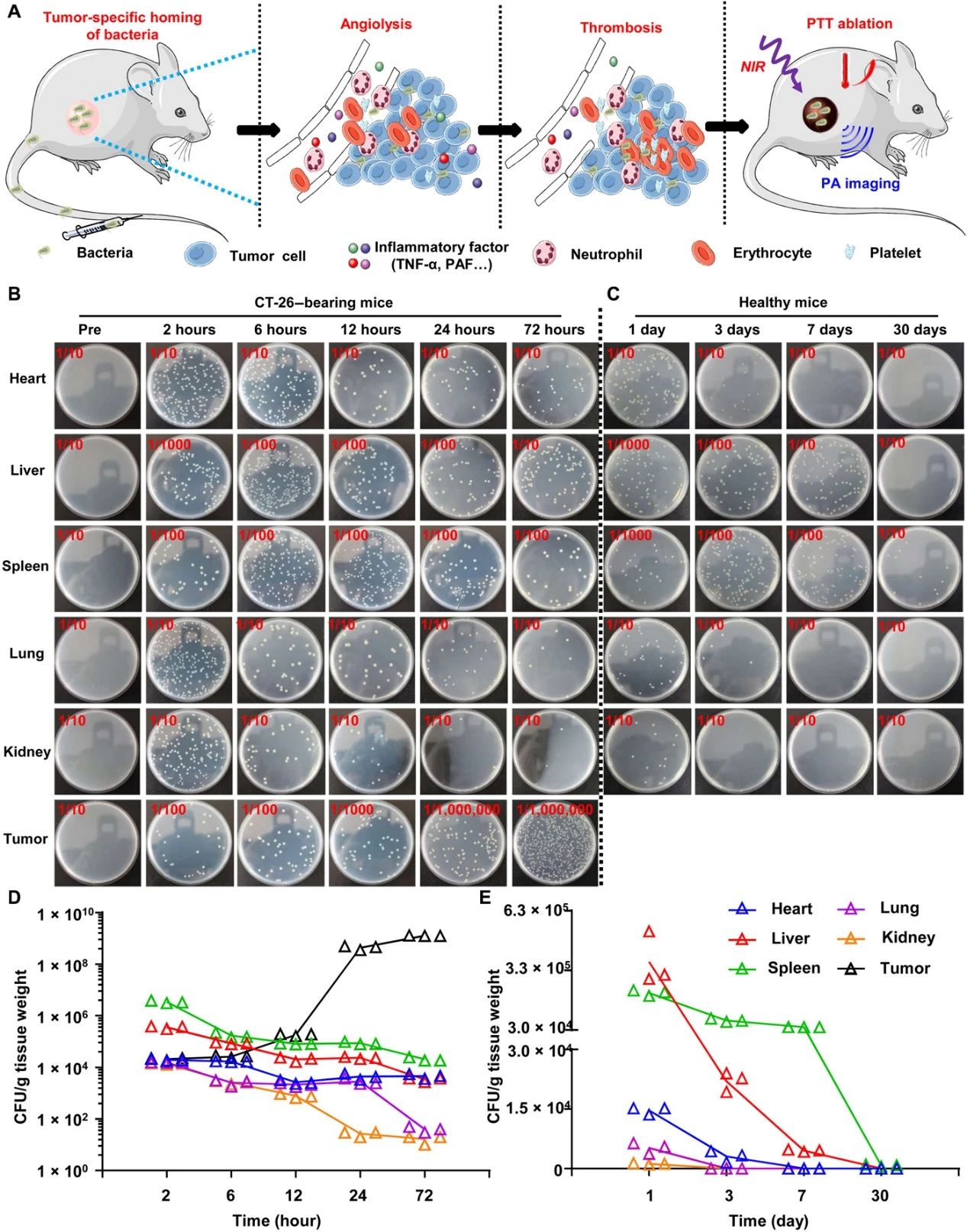
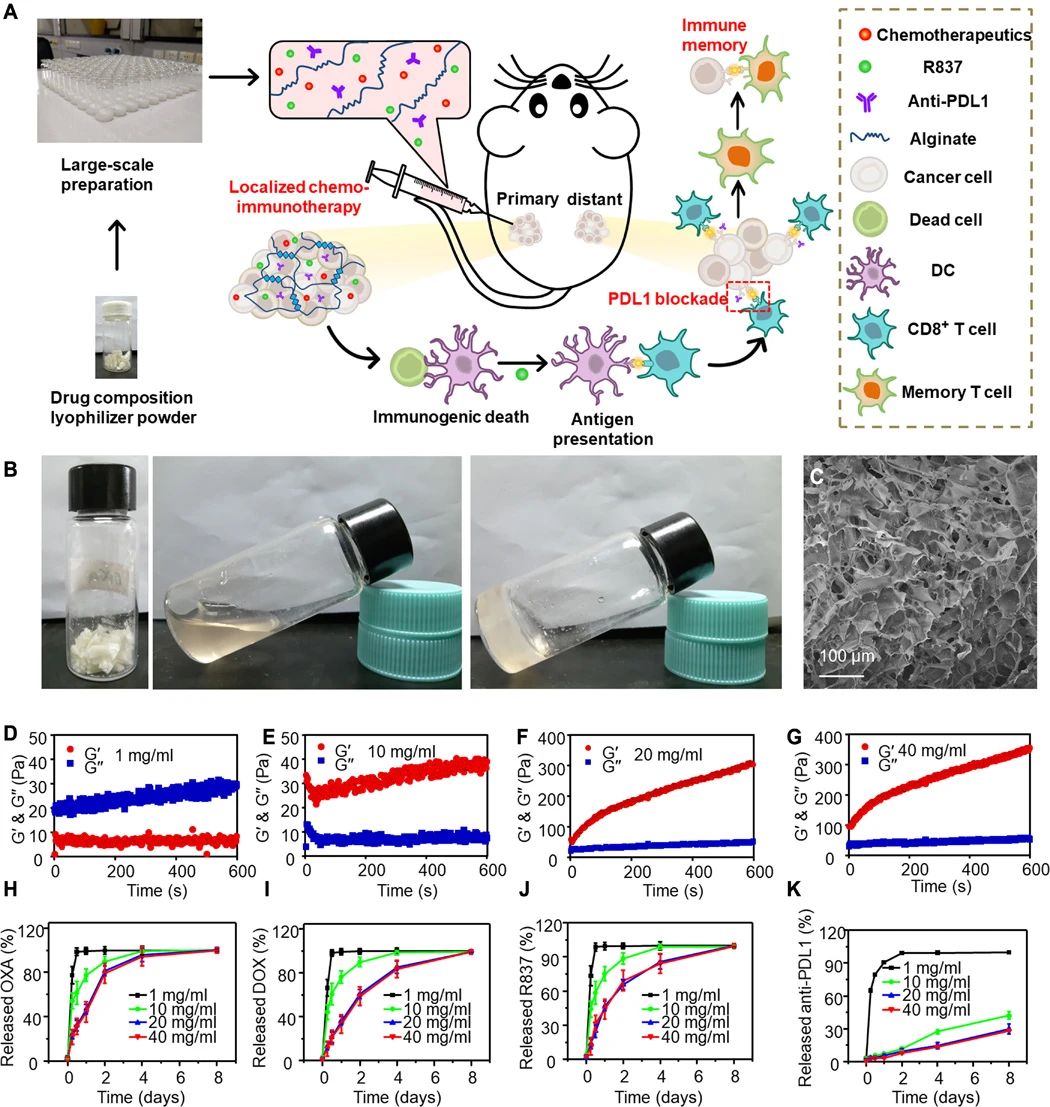
Xu, J., et al. A general strategy towards personalized nanovaccines based on fluoropolymers for post-surgical cancer immunotherapy. Nat. Nanotechnol. (2020).https://doi.org/10.1038/s41565-020-00781-42.Science Advances: 細菌觸發的腫瘤特異性血栓形成可實現有效的癌癥光熱免疫治療為了克服癌癥的威脅,臨床上已經應用或測試了基于不同機制的多種治療策略。但是,常規的癌癥療法,例如化學療法和放射療法,在嚴重的副作用,治療抗性和特異性有限方面存在局限性。包括光熱療法(PTT)和光動力療法在內的光觸發光療法具有較低的侵入性和更高的特異性,但通常用于治療局部腫瘤而不是遠處轉移的腫瘤。另外,已知單獨的ICB治療(不是腫瘤特異性治療)的總體臨床反應率相對較低。因此,近年來,ICB療法與化學療法,放射療法,光療等其他療法的結合受到了廣泛的關注。近日,蘇州大學劉莊、楊凱等人發現,減毒沙門氏菌經靜脈注射后可在各種類型的實體瘤中增殖,但在正常器官中表現出快速清除,而不會產生明顯的毒性。1)細菌引起的炎癥通過破壞腫瘤血管而引發腫瘤血栓形成。通過光聲成像觀察到,六種類型的腫瘤都會變成深色,具有強烈的近紅外吸收。在激光照射下,細菌感染的腫瘤可以被有效地消融。2)基于細菌的光熱療法(PTT)由于具有免疫刺激功能,隨后會引發抗腫瘤免疫反應,通過免疫檢查點阻斷進一步增強抗腫瘤免疫反應,從而有效抑制腫瘤的生長。基于細菌的PTT后,還觀察到了強大的免疫記憶效應,可以抵抗再發的腫瘤。該研究表明細菌本身可以作為腫瘤特異性PTT試劑,使光免疫療法能夠抑制腫瘤的轉移和復發。Xuan Yi, et al., Bacteria-triggered tumor-specific thrombosis to enable potent photothermal immunotherapy of cancer. Science Advances 2020.DOI: 10.1126/sciadv.aba35463. Science Advances:局部雞尾酒化學免疫療法以觸發強大的全身性抗腫瘤免疫反應當前,迫切需要開發具有降低的全身毒性和有效功效以對抗具有擴散轉移的晚期癌癥的化學免疫療法。于此,蘇州大學劉莊等人報道了幾種“雞尾酒”治療配方,即通過混合免疫原性細胞死亡(ICD)誘導的化學療法和免疫佐劑以及藻酸鹽(ALG)進行局部化學免疫治療。1) 免疫檢查點阻斷(ICB)抗體可以包含在該雞尾酒中以進行局部注射,也可以通過常規靜脈注射使用。2) 將這種混合物注入實體瘤后,ALG的原位凝膠化將導致局部滯留和藥物的持續釋放,從而降低全身毒性。3) 化學療法誘導的ICD在免疫佐劑的幫助下會觸發腫瘤特異性免疫反應,ICB會進一步放大該免疫反應,從而在破壞局部腫瘤、消除轉移并抑制癌癥復發方面引發有效的全身性抗腫瘤免疫反應。研究人員結合臨床上用于腫瘤局部化雞尾酒化學免疫療法的藥物的策略具有巨大的臨床轉化潛力。
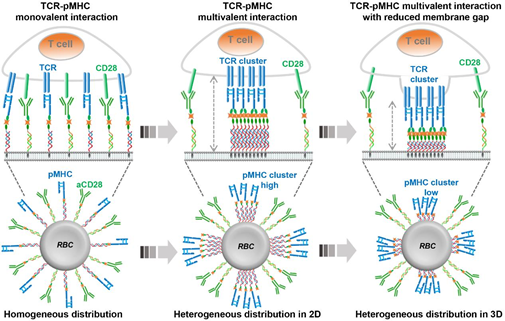
Chao Y, et al. Localized cocktail chemoimmunotherapy after in situ gelation to trigger robust systemic antitumor immune responses. Science Advances. 2020;6(10):eaaz4204.DOI: 10.1126/sciadv.aaz4204https://advances.sciencemag.org/content/6/10/eaaz42044. Angew:對紅細胞上定位的配體進行DNA編輯以優化T細胞過繼性免疫治療表面錨定有T細胞活化配體的人工抗原呈遞細胞(APCs)在過繼性免疫治療領域中具有巨大的應用潛力。然而,如何通過傳統的生物偶聯化學來精確控制這些平臺上的配體定位仍然是一個很大的研究挑戰。蘇州大學劉莊教授利用DNA輔助的自底向上的自組裝過錯,實現了對T細胞激活配體在紅細胞(RBC)上的橫向和縱向分布的精確控制。1)研究發現,當RBC上的抗原肽-MHC分子復合物(pMHC)和細胞膜之間具有較短的垂直距離時更有利于實現有效的T細胞活化,這是由于它們可以更好地模擬了天然的APCs所導致的。2)這種優化的基于RBC的人工APCs可以通過過繼性免疫治療在體內刺激T細胞增殖,進而有效抑制腫瘤生長。因此,這一研究表明DNA技術可以精確地設計細胞膜界面和調整細胞與細胞之間的相互作用,有望在包括免疫治療在內的更多領域實現廣泛應用。
Lele Sun. et al. DNA-Edited Ligand Positioningon Red Blood Cells to Enable Optimized T Cell Activation for Adoptive Immunotherapy. Angewandte Chemie International Edition. 2020DOI: 10.1002/anie.2020033675.Nano Letters:注射用抗炎納米纖維水凝膠實現局部給藥后的全身免疫治療盡管免疫檢查點阻斷(ICB)療法在利用免疫系統對抗不同腫瘤方面已取得巨大進展,但諸如客觀應答率低和不良反應等局限性仍有待解決。在此,蘇州大學陳倩、劉莊等人開發了一種由類固醇藥物自組裝的抗炎納米纖維水凝膠,用于局部遞送抗程序性細胞死亡蛋白配體1(αPDL1)。1)這種基于類固醇藥物的無載體系統一方面可以將促腫瘤免疫抑制的腫瘤微環境(TME)重新編程為抗腫瘤的TME;另一方面,它還可以作為αPDL1緩釋的蓄水池,從而協同增強免疫系統。2)局部注射這種負載了αPDL1的水凝膠,在不經任何治療的情況下,對局部腫瘤和異位腫瘤均有顯著的抑制作用。綜上所述,這項工作提出了一種獨特的基于水凝膠給藥系統,使用臨床批準的藥物,在提高ICB治療的客觀應答率和降低其全身毒性方面表現出潛力。
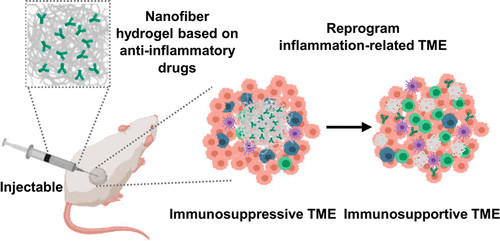
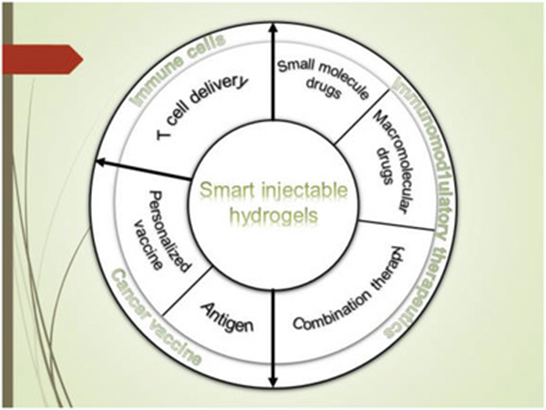
Muchao Chen, et al. Injectable Anti-inflammatory Nanofiber Hydrogel to Achieve Systemic Immunotherapy Post Local Administration. Nano Lett., 2020.DOI: 10.1021/acs.nanolett.0c02684https://doi.org/10.1021/acs.nanolett.0c02684最近,可注射智能水凝膠已證明其在局部免疫調節方面的潛力,以增強系統的抗癌免疫反應。劉莊教授總結了用于癌癥免疫治療的各種智能注射水凝膠的最新進展,并討論了可注射水凝膠在下一代癌癥治療中的未來貢獻。Yu Chao. et al. Smart Injectable Hydrogels for CancerImmunotherapy. Adv. Funct. Mater. 2020, 30, 201902785DOI: 10.1002/adfm.201902785https://doi.org/10.1002/adfm.2019027857.Nano Research:免疫可調節二維配位納米片的聲動力學療法可增強抗腫瘤免疫療法超聲是目前臨床上廣泛使用的診療手段之一。腫瘤聲動力治療是通過使用超聲刺激聲敏劑催化腫瘤部位的氧氣產生ROS,并同時產生空化氣泡,共同作用引起腫瘤細胞凋亡,從而殺死腫瘤。據報道,與化療,放療,光學治療類似,聲動力治療可以在引起腫瘤細胞凋亡的同時釋放腫瘤相關抗原,刺激機體的免疫系統。另一方面,聲動力治療也可以刺激腫瘤免疫微環境,如逆轉抗原呈遞細胞如樹突狀細胞、巨噬細胞的被動特性,增強腫瘤活化T細胞的浸潤通過自上而下的方法,蘇州大學劉莊教授課題組將鋅離子與聲敏劑TCPP配位,合成了二維層狀的金屬有機納米片,該納米片可以高效吸附具有免疫佐劑作用的單鏈寡DNA,Toll樣受體9的刺激劑CpG。基于該納米片的聲動力治療可以誘導腫瘤細胞免疫原性死亡,產生腫瘤相關抗原,激活腫瘤部位T細胞活化與浸潤,并產生相關活化的T細胞與記憶細胞,進一步殺死轉移的腫瘤細胞。
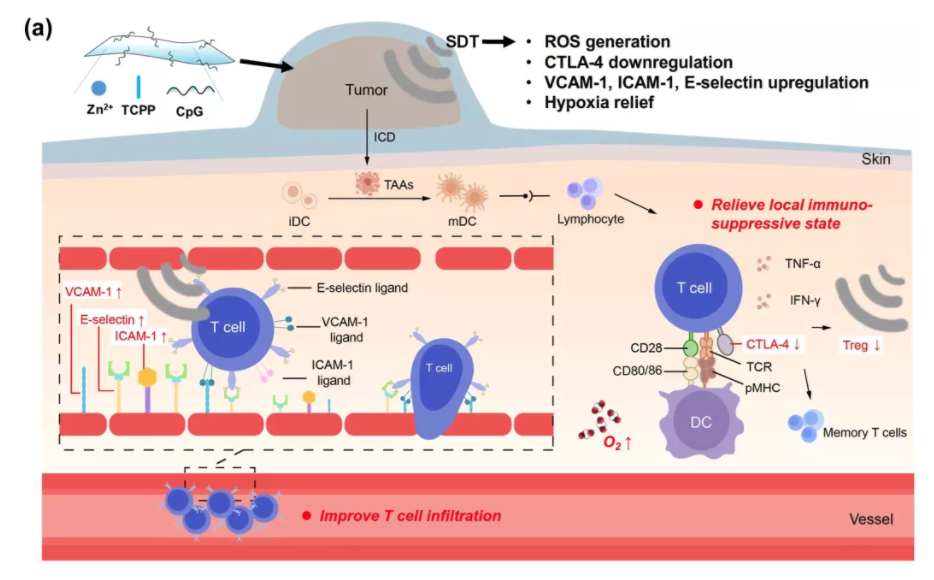
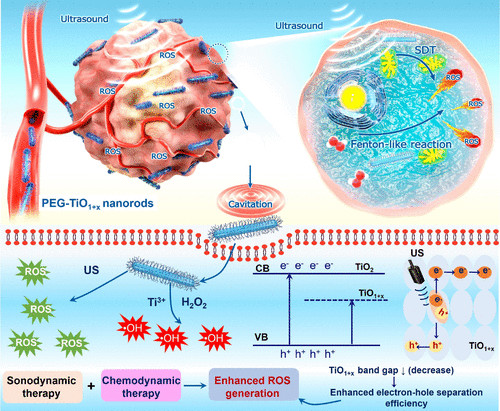
Wenjun Zhu et al. Sonodynamic therapy with immune modulatable two-dimensional coordination nanosheets for enhanced anti-tumor immunotherapy. Nano Research 2020.https://link.springer.com/article/10.1007/s12274-020-3070-88. JACS:超微一氧化鈦納米棒提高聲動力治療效果超聲(US)觸發的聲動力學療法(SDT)能夠對較大的體內腫瘤進行無創治療,引起了廣泛的關注。為了改善對SDT的治療反應,需要更有效和穩定的聲敏劑。
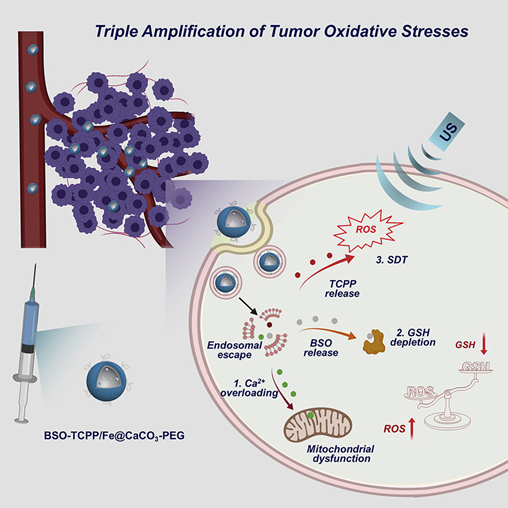
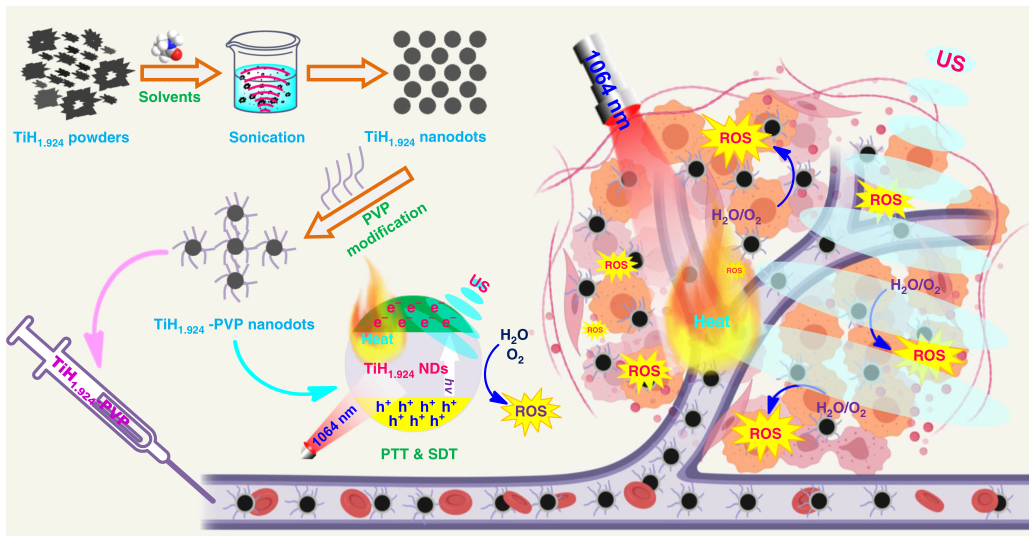
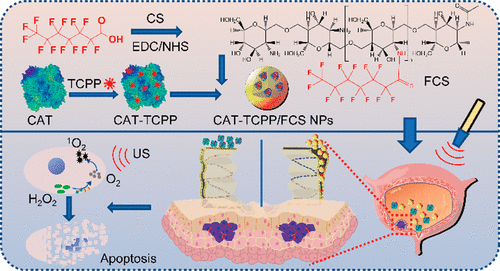
近日,蘇州大學程亮教授和劉莊教授課題組制備了具有極大改善聲敏性和類Fenton催化活性的超微一氧化鈦納米棒(TiO 1 + xNR),并應用于提高聲動力療法的治療效果。1) 研究人員成功制備了具有超微棒狀結構的TiO 1 + x 納米粒,并用聚乙二醇(PEG)進行修飾。與傳統的TiO 2納米粒聲敏劑相比,這種PEG-TiO 1 + x 納米棒具有缺氧結構,從而更加有效地產生超聲誘導的活性氧(ROS),因此它可以作為電荷陷阱,限制了超聲觸發的電子-空穴對的重組。2)這種PEG-TiO 1 + x 納米棒還表現出類似辣根過氧化物酶的納米酶活性,并且可以從腫瘤的內源H 2 O 2中產生羥基自由基(?OH),從而實現化學動力治療(CDT)。3)這種PEG-TiO 1 + x 納米棒在靜脈注射后能有效地被動保留在腫瘤中,因此在超聲治療中可以用作聲敏劑和化學動力治療劑,可以高效消除腫瘤。小鼠模型實驗結果顯示,在治療小鼠體內沒有發現明顯的長期毒性。綜上,這項研究工作成功制備了一種新型的基于鈦的納米結構,具有良好的腫瘤聲動力治療效果。Xianwen Wang et al. Ultrafine Titanium Monoxide (TiO1+x) Nanorods for Enhanced Sonodynamic Therapy. J. Am. Chem. Soc. 2020.https://doi.org/10.1021/jacs.9b10228多功能刺激響應性納米醫學的發展吸引了有效的癌癥治療。于此,蘇州大學劉莊和馮良珠等人利用生物相容性CaCO3納米顆粒作為模板來指導pH分解的空心配位納米結構的形成,其中聲敏劑內消旋-四-(4-羧基苯基)卟啉(TCPP)作為有機橋連分子和三價鐵離子充當金屬中心。1)L-丁硫氨酸亞砜亞胺(BSO)是谷胱甘肽(GSH)生物合成的抑制劑,可以在制備TCPP-Fe@CaCO3期間同時加載,獲得具有pH響應性解離的BSO-TCPP-Fe@CaCO3,以賦予Ca2+和BSO在酸性腫瘤微環境下快速釋放2)這種BSO-TCPP-Fe@CaCO3通過細胞內Ca2+過載誘導的線粒體損傷,BSO介導的GSH消耗和TCPP介導的聲動力療法(SDT)賦予協同氧化應激擴增作用,導致顯著的細胞死亡。用BSO-TCPP-Fe@CaCO3處理以及隨后的超聲暴露后的小鼠的腫瘤得以有效抑制。因此,該工作突出了一種簡便的策略來制備可pH分離的納米藥物,可通過三重放大腫瘤氧化應激以有效地進行SDT治療腫瘤。Dong Z, Feng L, Hao Y, Li Q, Chen M,Yang Z, et al. Synthesis ofCaCO3-Based Nanomedicine for Enhanced SonodynamicTherapy via Amplification ofTumor Oxidative Stress. Chem. 2020.https://doi.org/10.1016/j.chempr.2020.02.02010.Nature Commun.:液相剝離法制備TiH1.924納米點用于增強聲動力治療金屬氫化物在生物醫學中的應用很少。在此,蘇州大學劉莊、程亮等人通過液相剝離的方法從粉末狀的氫化鈦(TiH1.924)中制備出氫化鈦納米點,并將這些金屬氫化物納米點應用于有效的癌癥治療。1)液相剝離法是合成這些金屬氫化物納米材料的有效方法,其效率取決于溶劑與金屬氫化物表面能的匹配程度。2)得到的TiH1.924納米點在超聲作用下能產生活性氧(ROS),表現出高效的聲敏化效應。同時,TiH1.924納米點具有很強的近紅外(NIR)吸收,可以作為一種強大的光熱劑。利用溫和的光熱效應增強腫瘤內的血流和改善腫瘤的氧合,在光熱-聲動力學聯合治療中取得了顯著的協同治療效果。3)重要的是,這些TiH1.924納米點中的大部分都可以從體內清除。這項工作展示了功能性金屬氫化物納米材料在生物醫學中的應用前景。Fei Gong, et al. Preparation of TiH1.924 nanodots by liquid-phase exfoliation for enhanced sonodynamic cancer therapy, Nat. Commun.,2020.DOI: 10.1038/s41467-020-17485-xhttps://doi.org/10.1038/s41467-020-17485-x11. ACS Nano:氟化殼聚糖促進超聲敏化劑結合過氧化氫酶跨粘膜遞送以實現聲動力治療膀胱癌聲動力療法(SDT)是一種非侵入性的超聲觸發治療策略,用于深度穿透性腫瘤的定位治療。目前,用于膀胱灌注后SDT治療膀胱癌(BCa)的納米聲敏劑的設計尚未見報道。在此,蘇州大學劉莊、深圳大學吳松等人開發了一種跨粘膜自產氧SDT納米平臺,以實現高效的SDT抗BCa。1)在該系統中,合成了氟化殼聚糖作為一種高效、無毒的跨粘膜遞送載體,然后與中-四(4-羧基苯基)卟吩結合的過氧化氫酶(CAT-TCPP)組裝。2)經膀胱灌注后形成的CAT-TCPP/FCS納米粒子具有良好的跨粘膜和瘤內穿透能力,可通過過氧化氫酶催化腫瘤內源性H2O2產生O2,有效地緩解腫瘤組織中的缺氧,從而進一步提高SDT在超聲作用下消融原位膀胱腫瘤的療效。該工作提出了一種含有FCS的納米超聲增敏劑配方,以增強跨粘膜傳遞和瘤內擴散,并以CAT改善腫瘤的氧合,有望以滴注為基礎的SDT治療膀胱腫瘤,而不考慮全身毒性。Guangzhi Li, et al. Fluorinated Chitosan ToEnhance Transmucosal Delivery of Sonosensitizer-Conjugated Catalase for SonodynamicBladder Cancer Treatment Post-intravesical Instillation, ACS Nano, 2020.https://doi.org/10.1021/acsnano.9b0668912.ACS Nano:超小型Fe-TiO2 NDs增強癌癥聲動力和化學動力治療聲動力療法(SDT)是在超聲(US)作用下,利用聲敏劑產生的活性氧(ROS)來殺死腫瘤細胞,是一種組織穿透深度高的、非侵入性治療手段。在此,蘇州大學程亮、劉莊等人采用熱分解法制備了超小的鐵摻雜二氧化鈦納米點(Fe-TiO2 NDs),作為一種聲敏劑來增強SDT。1)這一體系中的鐵摻雜似乎不僅在增強超聲觸發納米點產生ROS方面起著至關重要的作用,而且還能為納米點提供Fenton催化功能,以從腫瘤內源性H2O2中產生ROS,用于化學動力治療(CDT)。2)聚乙二醇(PEG)修飾后的Fe-TiO2-PEG NDs具有良好的生理穩定性和生物相容性。3)體內磁共振(MR)和熒光成像顯示,Fe-TiO2 NDs在靜脈注射后具有有效地腫瘤滯留能力,由于CDT和SDT的結合,Fe-TiO2 NDs在體內表現出比商業TiO2納米粒子更好的治療性能。此外,這些超小的Fe-TiO2 NDs大多能在一個月內有效排泄,對實驗小鼠沒有明顯的長期毒性。綜上所述,此工作提供了一種多功能聲敏劑,通過簡單地將金屬離子摻雜到二氧化鈦納米結構中,可以高效地治療癌癥。
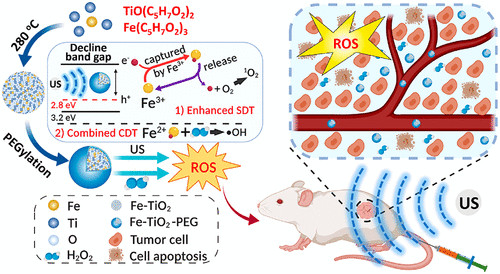
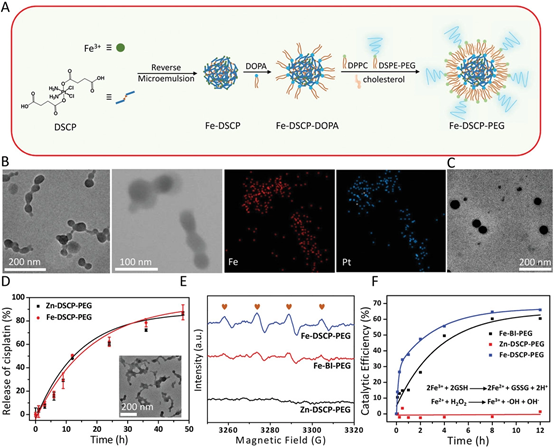
Shang Bai, et al. Ultrasmall Iron-Doped Titanium Oxide Nanodots for Enhanced Sonodynamic and Chemodynamic Cancer Therapy. ACS Nano, 2020.DOI: 10.1021/acsnano.0c05235https://doi.org/10.1021/acsnano.0c0523513. ACS Nano:光激活H2納米發生器在膀胱癌化療中的應用氫氣可以減輕許多疾病中的氧化應激,被認為是安全的,沒有副作用。受到多種微生物中的金屬酶的啟發,深圳大學吳松、蘇州大學劉莊等人提出了一種光激活的H2納米發生器,它包括氟化殼聚糖(FCS)、化療藥物(吉西他濱,GEM)和H2產生催化劑([FeFe]TPP),可以形成自組裝的[FeFe]TPP/GEM/FCS納米顆粒(NPs)。1)經膀胱灌注后,[FeFe]TPP/GEM/FCS NPs表現出良好的穿透粘膜和腫瘤細胞的能力,并能在660 nm激光照射下原位高效產生H2氣體,顯著提高了體內外腫瘤氫化療的療效。2)此外,還發現氫化療中的H2氣體可以抑制線粒體功能,阻礙ATP合成,導致P-gp外排泵功能降低,最終使癌細胞中P-gp蛋白的藥物轉運能力減弱。這種通過光激活原位產氫技術提高膀胱癌化療的療效,可能為腫瘤治療提供一種有效的氫化療策略。Rui Sun, et al. Photoactivated H2 Nanogenerator for Enhanced Chemotherapy of Bladder Cancer, ACS Nano, 2020.DOI: 10.1021/acsnano.0c01300https://doi.org/10.1021/acsnano.0c0130014. AFM:可生物降解的納米級配位聚合物用于靶向性腫瘤聯合治療和氧化應激放大如今,已設計出多種基于金屬離子的類Fenton催化活性而產生高反應性羥基自由基(·OH)的無機納米顆粒,用于化學動力學治療。然而,癌細胞中高水平的適應性抗氧化劑[谷胱甘肽(GSH)]可以有效地消耗·OH,從而降低這些無機納米顆粒的治療效率和生物安全性,這是化學動力學治療中普遍關注的問題。于此,新加坡國立大學劉斌教授聯合蘇州大學劉莊教授等人通過逆微乳液法整合順鉑前藥(DSCP)和鐵(III)離子,開發了一種新的可生物降解的納米級配位聚合物(NCP)。1)NCP中的DSCP可與GSH反應釋放游離順鉑,而鐵(III)離子可被GSH還原為鐵(II)以使Fenton反應,隨后導致細胞內氧化應激擴增。2)經過聚乙二醇(PEG)和環[Arg-Gly-Asp-D-Phe-Lys(mpa)]肽(cRGD)的表面修飾后,Fe-DSCP-PEG-cRGD對過表達αvβ3整合素的腫瘤表現出出色的靶向作用細胞。3)此外,與相對單一療法相比,Fe-DSCP-PEG-cRGD可以實現顯著的化學和化學動力學治療,并顯著提高治療效率。重要的是,Fe-DSCP-PEG-cRGD可以在注射后7天通過糞便和尿液有效清除。在這項工作中提出的NCP簡單且經濟,顯示出巨大的生物降解性和生物安全性,可用于潛在的臨床轉化。Liu, J., et al., BiodegradableNanoscale Coordination Polymers for Targeted Tumor Combination Therapy with Oxidative Stress Amplification. Adv. Funct. Mater. 2020, 30, 1908865.DOI: 10.1002/adfm.201908865https://doi.org/10.1002/adfm.20190886515. Biomaterials:負載阿霉素的多孔鉑納米顆粒用于化學-電動力學協同治療p糖蛋白(P-gp)會將化療藥物泵出腫瘤細胞,其過表達也被認為是腫瘤細胞對常規化療產生耐藥的重要原因。浙江大學李翔副教授和蘇州大學劉莊教授開發了一種多孔鉑納米顆粒(pPt NPs),并將其用于化學-電動力學協同治療。1)實驗利用聚乙二醇(PEG)對pPt NPs進行包覆,并利用其多孔結構負載了抗癌藥物阿霉素(DOX)。pPt-PEG NPs可在電場作用下通過觸發水分解以產生活性氧(ROS),并且這一過程不依賴于腫瘤中的O2和H2O2的水平。2)此外,EDT過程中產生的ROS可誘導p -糖蛋白(P-gp)受到抑制,從而促進藥物在細胞內的積累,進而提高化療藥物的療效。體內外實驗結果表明,DOX@pPt-PEG NPs可通過化學-EDT聯合治療表現出良好的腫瘤治療效果。因此,這一研究也為實現腫瘤的高雄聯合治療提供了一個新的策略。
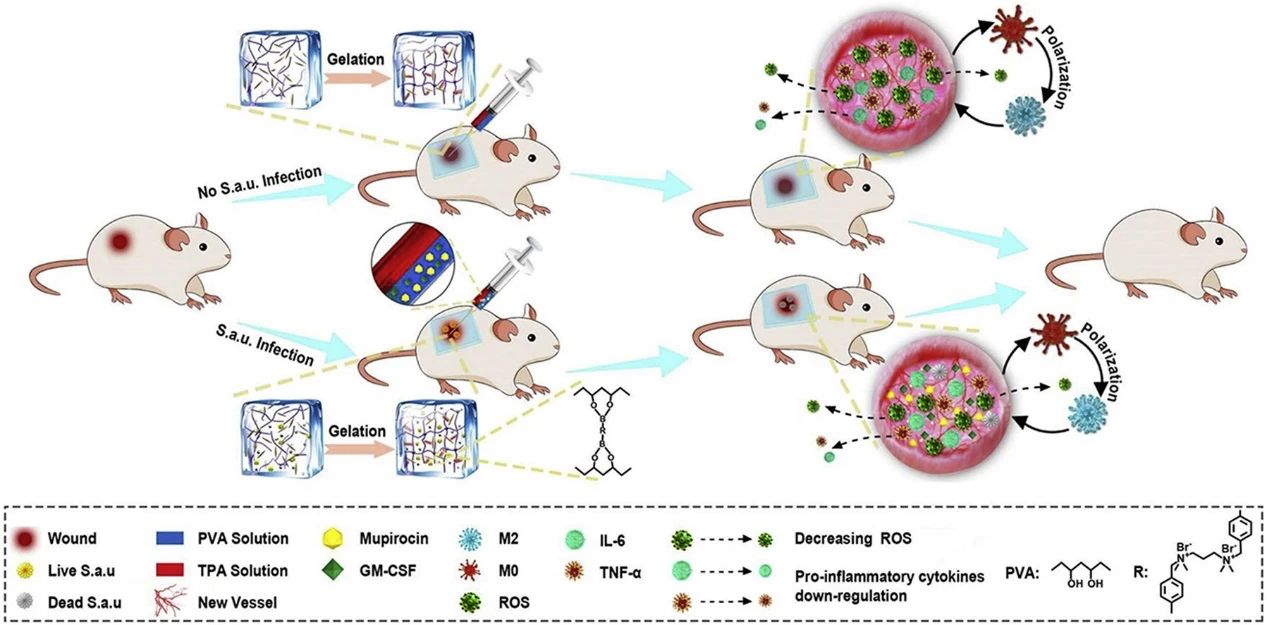
Tong Chen. et al. Porous Pt Nanoparticles loaded with Doxorubicin to Enable Synergistic Chemo-/Electrodynamic Therapy. Biomaterials. 2020https://www.sciencedirect.com/science/article/pii/S014296122030448816. Adv. Mater.:用于癌癥治療的2D納米材料蘇州大學劉莊和程亮等人綜述了二維納米結構的獨特特性(石墨烯片以及具有可調電子和光學特性以及可改變的表面化學性質的一系列結晶異質結構)。Cheng,L., et al., 2D Nanomaterials for Cancer Theranostic Applications. Adv. Mater.2020, 32, 1902333.https://doi.org/10.1002/adma.20190233317.Small:光敏劑修飾的二氧化錳納米顆粒用于治療膿腫可增強光動力治療和免疫保護作用耐藥菌的出現和易復發一直是細菌(如金黃色葡萄球菌)感染性皮膚膿腫臨床治療中的難題。在此,蘇州大學劉莊、彭睿等人設計了一種能夠調節膿腫微環境的抗菌納米制劑,以增強皮膚膿腫的光動力,并隨后激活免疫系統,有效地防止膿腫復發。1)在該體系中,利用光敏劑Ce6對二氧化錳納米顆粒(MnO2 NPs,對H2O2具有高催化活性。)進行改性,并用聚乙二醇(PEG)對其進行包覆。2)所獲得的Ce6@MnO2-PEG NPs通過觸發病灶內源性H2O2的分解,能夠有效緩解金黃色葡萄球菌感染過程中的缺氧膿腫微環境。因此,光觸發的光動力殺菌效果可以顯著增強,從而對金黃色葡萄球菌引起的皮膚膿腫進行有效的體內治療。3)有趣的是,經過這種治療后,由于光動力療法(PDT)后細菌抗原的釋放以及錳離子激活宿主免疫系統的佐劑樣功能,誘導了顯著的病原體特異性免疫記憶效應,以對抗未來由同一種類的細菌感染。這項工作提出了一種新型的光動力納米制劑,特別是在高效的光觸發膿腫治療和預防膿腫復發方面前景看好。Chenya Wang, et al. Photosensitizer‐Modified MnO2 Nanoparticles to Enhance Photodynamic Treatment of Abscesses and Boost Immune Protection for Treated Mice, Small, 2020.DOI: 10.1002/smll.20200058918. Biomaterials:一種可清除ROS的水凝膠促進細菌感染糖尿病傷口的愈合細菌感染對皮膚創面,尤其是難以愈合的糖尿病創面構成了極大的威脅。眾所周知,傷口或細菌感染產生的活性氧(ROS)會進一步阻礙傷口愈合。在此,蘇州大學劉莊、蘇州大學兒科醫學研究所汪健等人利用活性氧響應性連接物交聯聚乙烯醇(PVA),研制了一種清除活性氧的水凝膠。1)所得水凝膠可作為一種有效的ROS清除劑,通過降低創面周圍ROS水平,上調M2表型巨噬細胞,促進創面閉合。2)重要的是,在傷口中形成的這種水凝膠可以釋放治療藥物,包括殺菌的莫匹羅星和加速傷口閉合的粒細胞-巨噬細胞集落刺激因子(GM-CSF),以響應傷口微環境中存在的內源性ROS。值得注意的是,該載藥活性氧清除水凝膠可以有效地治療各種類型的傷口,包括難以愈合的糖尿病合并細菌感染的傷口。因此,本研究提出了一種基于活性氧清除水凝膠的各種并發癥下創面愈合的有效策略。He Zhao, et al. ROS-scavenging hydrogel to promote healing of bacteria infected diabetic wounds. Biomaterials, 2020.https://doi.org/10.1016/j.biomaterials.2020.120286此外,劉莊團隊2020年還發表了其他相關的高水平研究論文,由于篇幅關系就不在此一一展示,感興趣的讀者可前往該課題組網站進行學習。課題組網站:http://nano.suda.edu.cn/lz/劉莊,蘇州大學納米科學技術學院教授,博士生導師。國家杰青。2004年北京大學化學與分子工程學院獲理學學士學位;2008年美國斯坦福大學(Stanford University)獲得化學博士學位;2008年至2009年在斯坦福大學化學系以及醫學院從事博士后研究。2009年6月加入蘇州大學功能納米與軟物質研究院,被聘為教授,博士生導師。近年來在生物材料與腫瘤納米技術領域從事研究,圍繞腫瘤診療中的若干挑戰性問題,發展了一系列新型納米探針用于體外生物檢測與活體分子影像,并探索了多種基于納米技術和生物材料的腫瘤光學治療、放射治療、與免疫治療新策略。共發表學術論文340余篇,論文總引用超過55,000次,SCI H-index = 125。2014年起連續入圍Elsevier出版社發布的“中國高被引用學者榜單”(材料科學類);2015年起連續入選美國美國科睿唯安(原湯森路透集團)公布的“全球高被引科學家名單”(Highly Cited Researchers)(化學、材料)。擔任Biomaterials副主編。