
第一作者:Ariel J. Ben-Sasson
通訊作者:David Baker、Emmanuel Derivery
通訊單位:華盛頓大學,劍橋MRC分子生物實驗室
研究亮點:
1. 發展了一種計算控制二元蛋白質二維材料組裝的新方法。
2. 實現了在無序基底上構建有序二維陣列。
二維材料,大有可為。連生物學家,都開始對二維材料產生了興趣。
有序二維蛋白材料由柔性鏈接形成單個晶格,這些鏈接往往只由一種蛋白質成分構成。很自然地,科學家覺得由兩個蛋白質成分組成的材料更具優勢。
與兩種或多種成分組成的材料相比,在兩種或多種成分混合后自發共組裝為有序結構的可遺傳編程材料更容易控制。科學家更容易調控組裝動力學,對零件進行嚴格表征和操作,實現更復雜的功能,從而使系統可以用于各種應用。
二元組分的二維有序陣列已被證實,但是由于組分的靈活性,設計材料的結構無法事先完全確定,并且構筑單元具有二面角對稱性,陣列具有相同的上表面和下表面。通過廣泛的非共價相互作用穩定的剛性結構域之間的從頭設計將提供對原子結構的更多控制,并為進一步的結構和功能調節提供可靠的起點。
有鑒于此,華盛頓大學David Baker和劍橋MRC分子生物實驗室Emmanuel Derivery等人報道了一種計算方法,通過設計成對的二面體蛋白質構筑單元之間的剛性界面,可以生成共組裝的二元層從而實現二元蛋白二維超晶格。
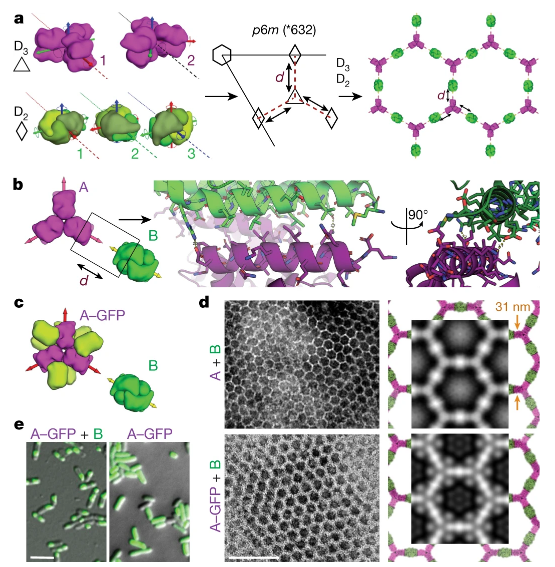
圖1. 設計策略
研究人員設計的陣列元件在毫摩爾濃度下會發生溶解,有趣的是,當它們以納摩爾濃度組合時,就會快速組裝成幾乎晶態的微米級陣列,而無需二維材料支撐,這幾乎與體外和細胞內計算設計的模型保持一致。
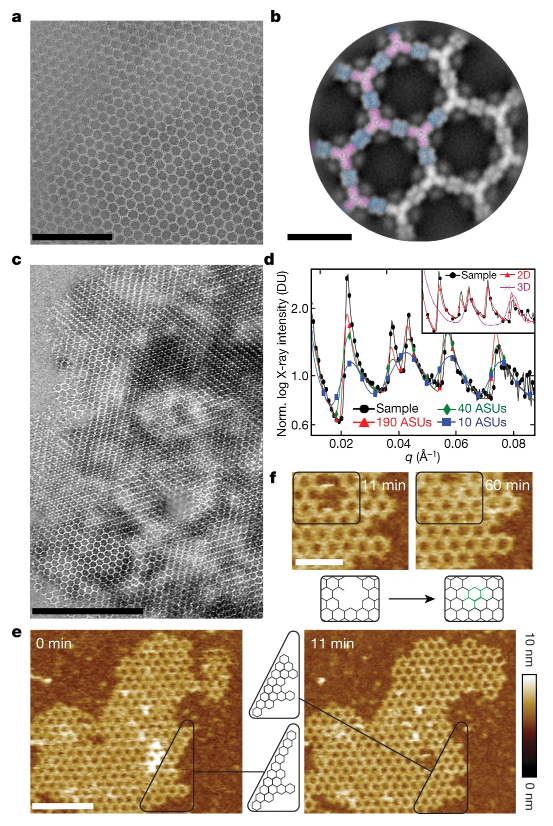
圖2. 組裝結構
由于該材料是從頭開始設計的,因此可以輕松地對構筑單元進行功能化,并重新構造它們的對稱性,從而能夠形成具有可區分表面的配體陣列。使用原子力顯微鏡和定量顯微鏡,研究人員發現,在膜上組裝的陣列具有與體外形成的陣列相似的化學計量和結構。這表明,在細胞膜這種無序基底上實現有序組裝,是可能的。
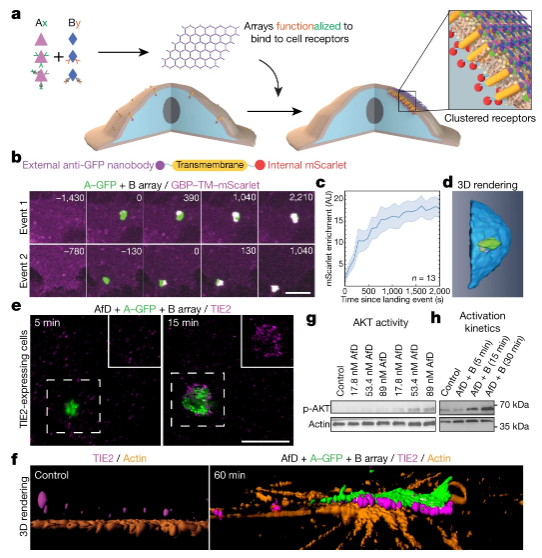
圖3. 動力學
之前的研究發現,細胞表面受體結合元件(例如抗體和納米籠)迅速被內吞。相比之下,這次在細胞表面組裝的大陣列可以以可調的方式抑制內吞作用,具有擴大受體參與和逃避免疫的潛在治療意義。
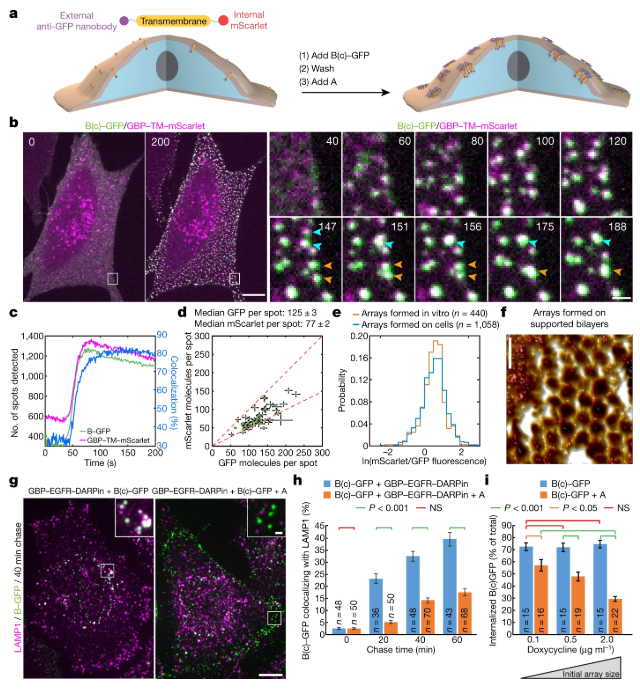
圖4. 大規模組裝陣列
總之,這項研究為合成細胞生物學奠定了基礎,也為二維材料的發展打開了新的大門!
參考文獻:
Ariel J. Ben-Sasson et al. Design of biologically active binary protein 2D materials. Nature 2020.
https://www.nature.com/articles/s41586-020-03120-8











