共價鍵、氫鍵作用
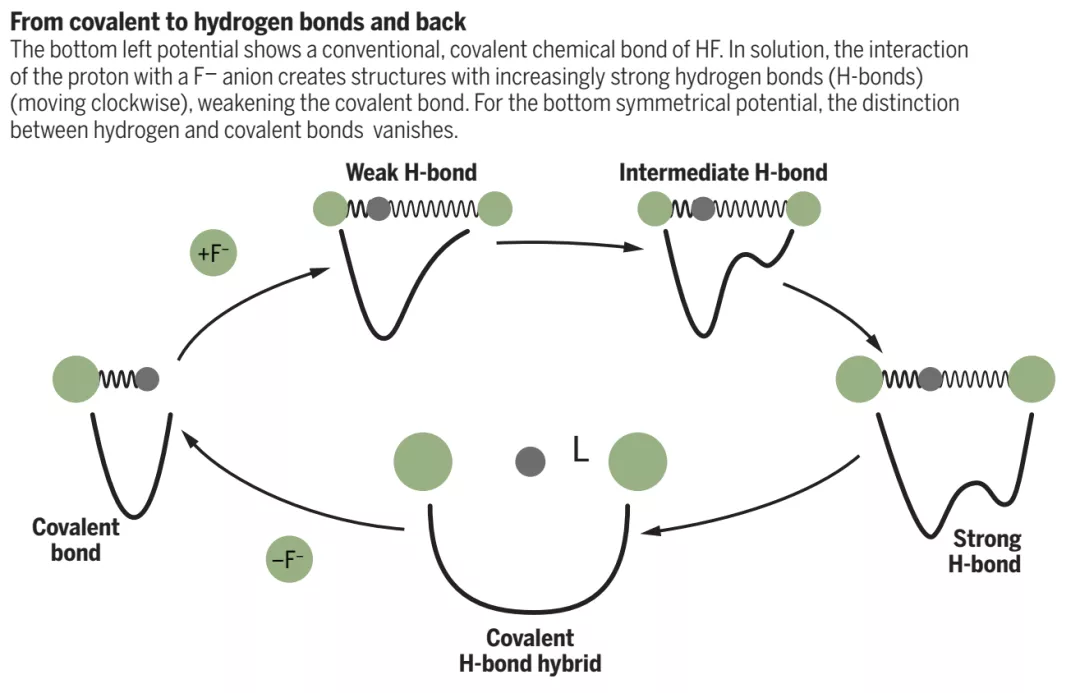
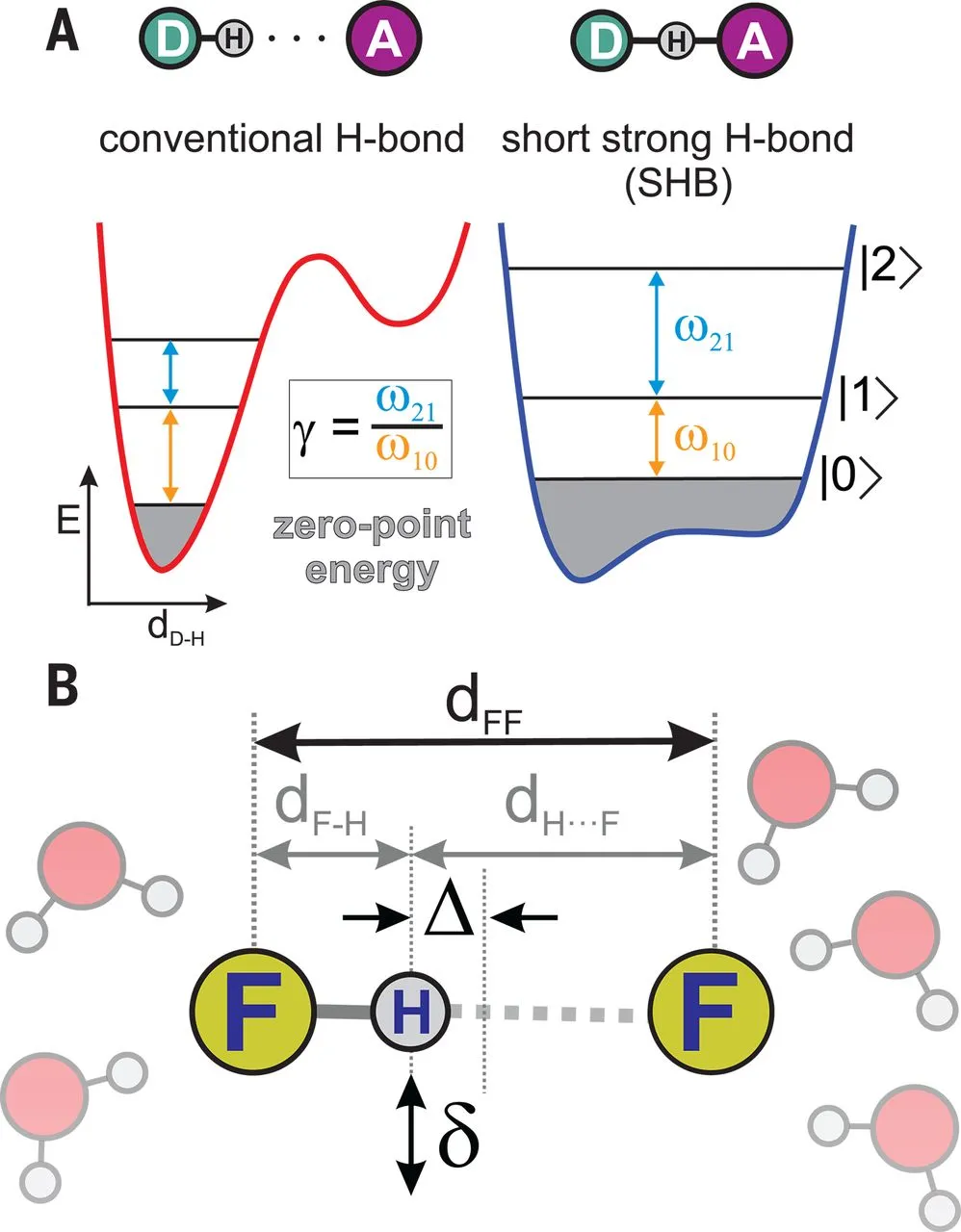
對分子的認識可以追溯到Robert Boyle在1661年在一篇論文”The Sceptical Chymist”中提出的將分子看作一系列束縛原子,化學工作者通常將分子中的強共價鍵描述為不同原子間的球棍、彈簧相互作用;但是相對較弱的相互作用,比如液體、固體狀態分子間van der Waals力難以描述,不能通過球棍、彈簧模型說明此類作用。氫鍵是一種比較特殊的作用方式,當兩個分子之間攜帶相反電荷,能夠在分子之間構建較強的相互作用。這導致共價鍵、強氫鍵的區分非常困難。有鑒于此,芝加哥大學Andrei Tokmakoff等報道了通過飛秒2D紅外光譜、量子化學計算相結合,實現了一種有效的方法研究強氫鍵相互作用。具體的,他們對溶液體系中[F-H-F]-離子的多重耦合運動進行定量表征,分別給出了傳統的氫鍵、短距離強氫鍵的特征,發現[F-H-F]-中的化學鍵不是簡單的共價鍵或者氫鍵,而是一種短程強氫鍵。特別的,發現了當分子間氫鍵的強度達到共價鍵的強度水平,挑戰了傳統的分子概念。馬克斯·普朗克聚合物研究所Mischa Bonn等對此項工作的意義進行總結和展望。
芝加哥大學Andrei Tokmakoff等通過對水中的FHF-的中間體物種進行表征,該分子中H以相同的模式和F原子結合,作者通過將FHF-中的H遠離平衡位置,表征勢能面的變化,從而對其中的化學鍵合作用進行深入理解,發現了其中共價鍵向強氫鍵變化的過程中經歷了弱氫鍵、中間體氫鍵;由強氫鍵向共價鍵變化的過程中經歷了共價性氫鍵(covalent-hydrogen bonded state)。
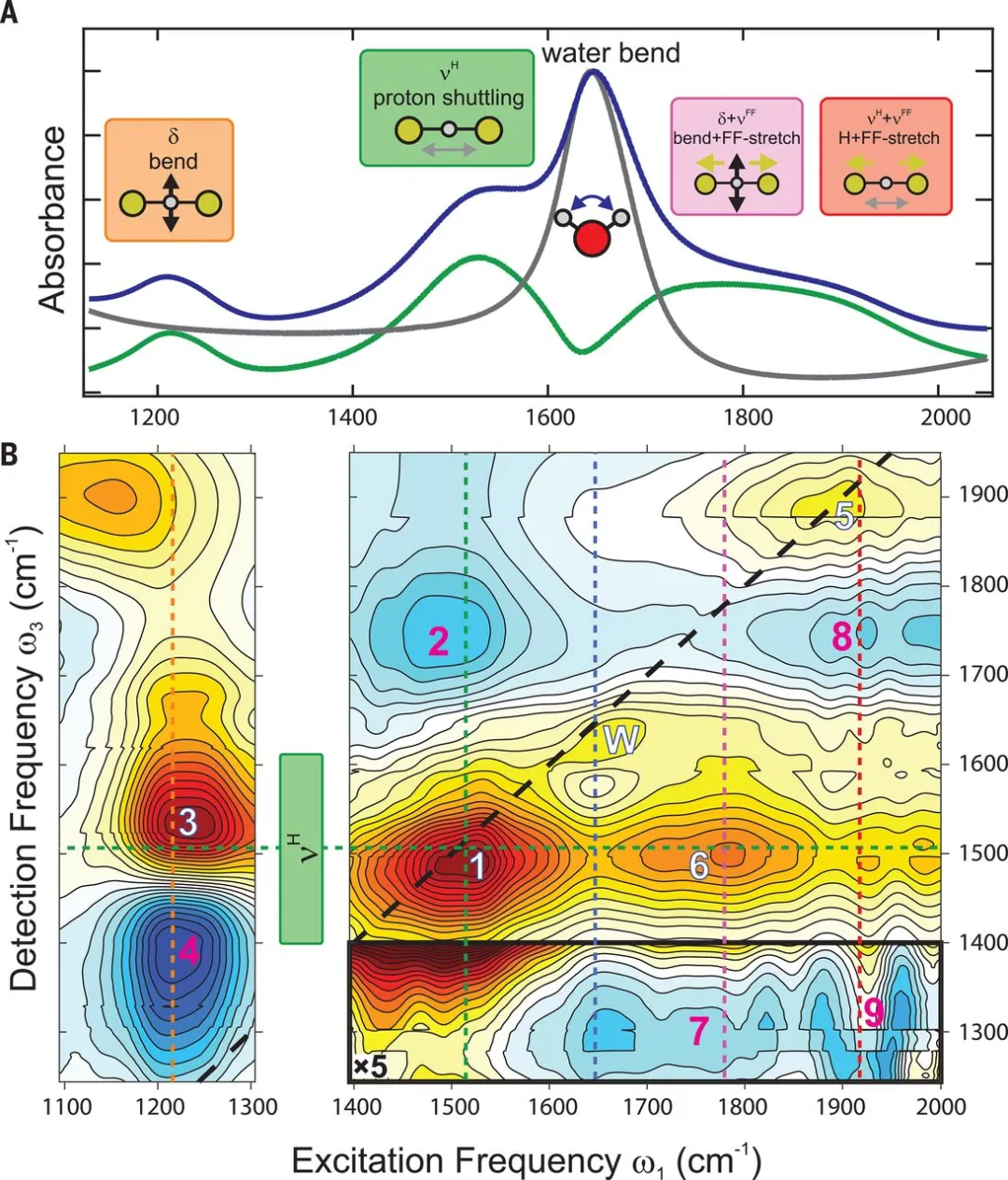
圖3. 2D飛秒紅外測試短程強氫鍵作用(A. 藍線:3.6 M KHF2溶液的紅外譜 灰色:水的紅外吸收 綠線:溶液、水的差分譜 B. 3.6 M KHF2溶液在150 fs、100 fs等待時間的各向同性紅外吸收譜)。進一步的,討論了強氫鍵的性質、強氫鍵與傳統氫鍵之間的區別。在傳統氫鍵中,靜電相互作用是主導性的;在強氫鍵作用中,由于原子間距更靠近,靜電相互作用僅起到52~62 %,另外的部分由共價、電荷轉移、Pauli排斥相互作用貢獻。Andrei Tokmakoff教授,美國藝術與科學院院士。分別在加州州立大學薩克拉門托分校獲學士學位(1989年),在斯坦福大學獲碩士(1992年)、博士學位(1995年)。隨后分別在慕尼黑工業大學、芝加哥大學、加州大學伯克利分校做博士后研究,1998年加入麻省理工學院任職,2013年起轉入芝加哥大學任教。他主要研究水的化學,以及蛋白質折疊、DNA雜交等生物物理過程的分子動力學。使用尖端光譜學技術,對分子結構隨時間的改變進行可視化處理。他曾是Alfred P. Sloan研究員,并曾獲得諸多榮譽,包括美國物理學會Ernest Plyler獎。https://chemistry.uchicago.edu/faculty/andrei-tokmakoff-professor-and-chair1. Mischa Bonn*, Johannes Hunger, Crossover from hydrogen to chemical bonding, Science 2021, 371 (6525), 123-124DOI: 10.1126/science.abf3543https://science.sciencemag.org/content/371/6525/1602. Bogdan Dereka, Qi Yu, Nicholas H. C. Lewis, William B. Carpenter, Joel M. Bowman, Andrei Tokmakoff*, Crossover from hydrogen to chemical bonding, Science 2021, 371 (6525), 160-164DOI: 10.1126/science.abe1951https://science.sciencemag.org/content/371/6525/123