相信大家都聽說過肉毒素美容,在1986年,加拿大一位眼科教授發現用來麻痹肌肉神經的肉毒素可以阻斷運動神經和肌肉之間信息傳導,使肌肉松弛來達到舒展皺紋的效果,對動力性皺紋比較有效。很快,注射肉毒素的美容手術應運而生,并迅速風靡全球。
但是,我們要知道,它還是迄今為止科學家發現的毒性最強的一種生物毒素。肉毒桿菌中毒是一種以肌肉麻痹為特征的嚴重且可能致命的疾病。病原體肉毒桿菌神經毒素(BoNT)具有進入運動神經元并阻止神經傳遞的能力。
肉毒桿菌中毒很少見,每年記錄不到200例,但這種毒素也是一種潛在的可怕生物武器。目前的治療方法是抗體混合物(BoNT/A - BoNT/G),可以使血液中的毒素失活,但這種方法不能進入神經。然而,當癥狀出現時,一些毒素進入神經后,抗體就無法觸及了。
近日,在兩項獨立的研究中,研究人員采取特洛伊木馬策略,開發出了無毒形式的肉毒桿菌毒素,然后將抗體搭便車進入神經細胞,然后將致命的肉毒桿菌毒素趕出神經并解除其武裝。如果這種療法對人有效,它將是首個逆轉細胞內毒素麻痹作用的療法,并可能使患者長期不用呼吸機。兩篇研究論文同時發表在Science Translational Medicine,并被選為該期的封面。且Science對其深度報道。

利用神經毒素進行藥物輸送并不是什么新鮮事,但是使用它們遞送抗體卻是非常直觀。
基于嵌合毒素的平臺將單域抗體遞送
首先,我們來看看第一篇研究論文,美國波士頓兒童醫院Min Dong等人通過將BoNT的受體結合結構域與最近發現的BoNT樣毒素BoNT/X的膜易位結構域和失活的蛋白酶結構域融合在一起,開發了一種基于嵌合毒素的遞送平臺,它可以將貨物跨過內體膜傳遞到細胞質。然后通過將抗BoNT/A的單域抗體(納米抗體)與遞送平臺融合來創建治療性蛋白。

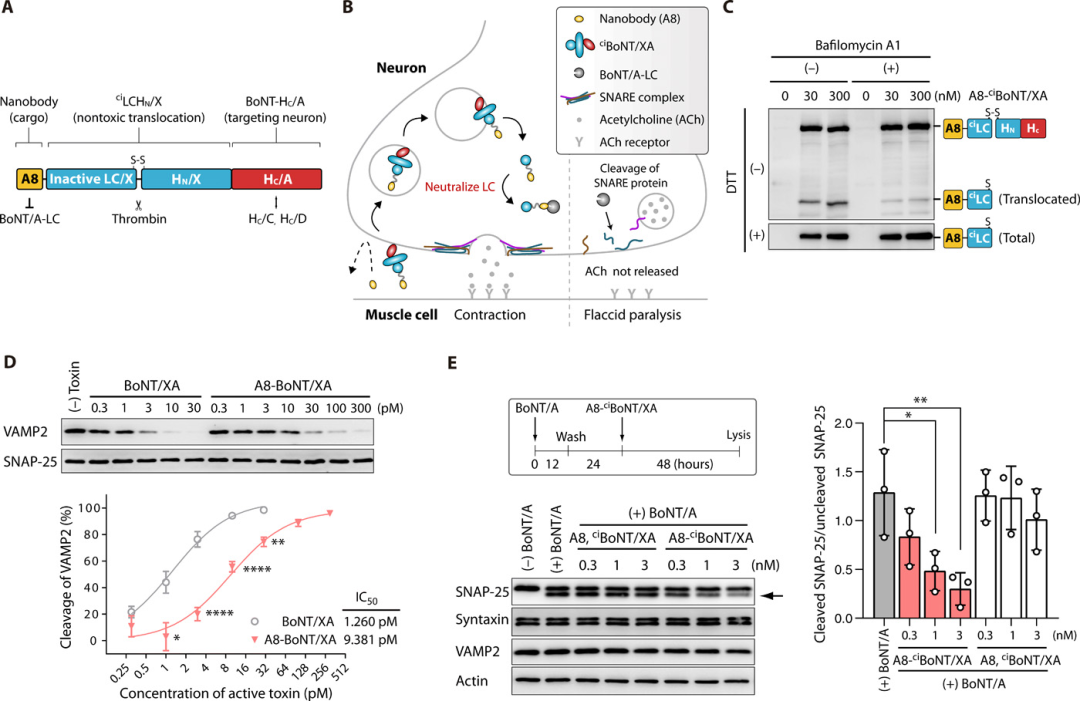
圖|嵌合的無活性毒素ciBoNT / XA將針對LC / A的融合納米抗體傳遞到神經元中
體外表征表明,納米抗體被遞送到培養的神經元中,并中和了神經元中的BoNT/A。在向小鼠注射了致死劑量的肉毒桿菌毒素,并在麻痹已經開始的9小時后對其進行了治療。結果表明,在小鼠中施用這種蛋白質可縮短局部肌肉麻痹的持續時間,給予最高治療劑量的10只小鼠在6小時內可活動,并使小鼠免于致命劑量的BoNT / A的全身毒性,而未經治療的小鼠呼吸困難。
此外,該小組將修飾的毒素與兩個不同的納米抗體融合,一個針對BoNT / A,另一個針對BoNT / B,產生了一種多價治療性蛋白質,能夠中和小鼠的BoNT / A和BoNT / B,成功地一次性解除了兩個常見的肉毒桿菌變種。這些研究為肉毒中毒提供了有效的暴露后治療,并為靶向胞質蛋白和過程的治療藥物的細胞內遞送建立了平臺。
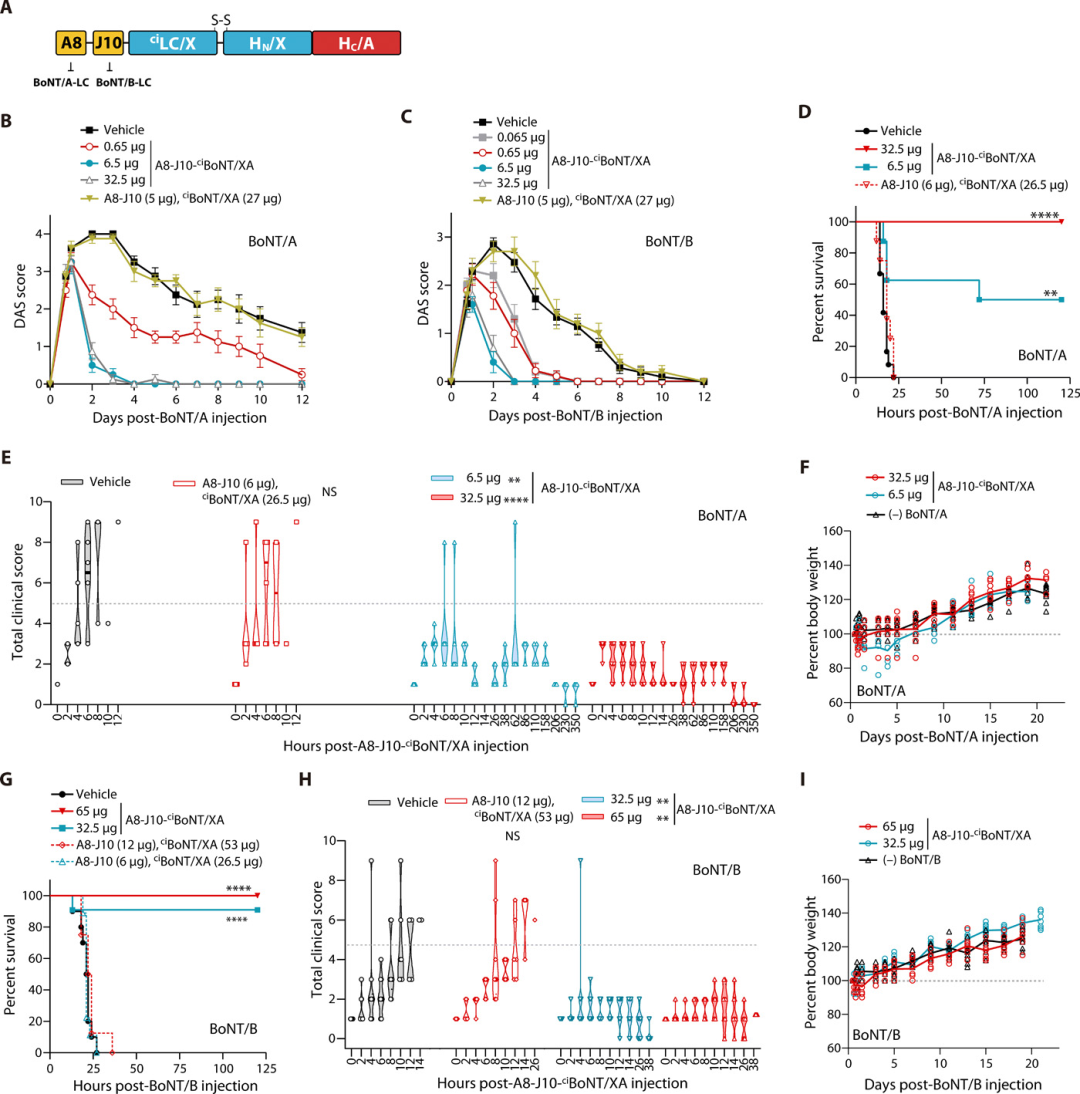
圖|使用ciBoNT / XA遞送兩個納米抗體以進行BoNT/A和BoNT/B中毒后治療
無毒衍生物遞送抗體
在另一項研究中,紐約大學Konstantin Ichtchenko等人利用肉毒桿菌神經毒素(BoNT)無毒衍生物的結構和運輸特性,由單結構域抗體(sdAb; B8)貨物融合到C1ad遞送載體(形成B8C1ad)組成的精確生物治療劑,可將功能阻斷性單域抗體轉運到神經元胞質溶膠中,從而可以抑制BoNT血清型A(BoNT / A1)分子毒性。


圖|B8C1ad的設計及對BoNT/A1的體外抑制
對癥治療后,小鼠、豚鼠和非人靈長類動物的肉毒中毒癥狀減輕。接受治療的6只猴子在獲得毒素后10天都還活著;7只未經治療的猴子都活不過3.5天。數據表明,在實驗模型中,可以利用毒性BoNT衍生物將治療性蛋白質部分輸送到神經元細胞質,在細胞內它們結合并中和細胞內靶點。該平臺的推廣可能使抗體和其他基于蛋白質的治療藥物能夠輸送到以前無法到達的神經內靶點。
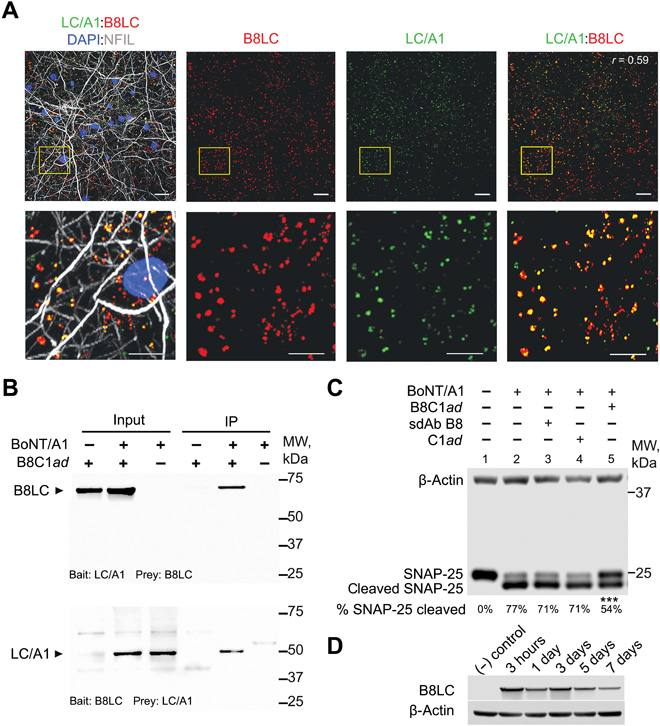
圖|B8C1ad保護SNAP-25免受大鼠皮層神經元的BoNT/A1金屬蛋白酶活性
該兩個團隊都將他們的工程毒素與源自羊駝的微小抗體聯系在一起,該抗體可以使毒素失活。與全尺寸抗體相比,納米抗體可以更容易地工程化以達到細胞中的特定靶標,并且一旦進入體內就可以更好地保持其結構。
有研究人員指出,與只給予相對較小的肉毒桿菌劑量的實驗動物相反,人類受害者通常在腸道中有大量的“毒素庫”毒素,毒素會在數天或數周內進入血液。因此,即使該方法可行,患者也可能還需要批準的抗毒素治療以從血液中去除毒素。
據悉,這兩個小組都計劃改進其產品,并尋求美國FDA的批準,而且人類臨床試驗也不符合倫理道德,從動物實驗結果到獲得批準的產品,該實驗藥物面臨漫長而艱難的道路,但這就是開始的地方。
參考文獻:
1. Decoy toxin harnessed to fight botulism. Science 2021.
DOI: 10.1126/science.371.6525.113
2. Shin-Ichiro Miyashita, et al., Delivery of single-domain antibodies into neurons using a chimeric toxin–based platform is therapeutic in mouse models of botulism. Science Translational Medicine 06 Jan 2021:
DOI: 10.1126/scitranslmed.aaz4197
3. Patrick M. McNutt, et al., Neuronal delivery of antibodies has therapeutic effects in animal models of botulism. Science Translational Medicine 06 Jan 2021:
DOI: 10.1126/scitranslmed.abd7789











