
第一作者:Zhaobin Wang
通訊作者:Gregory C. Fu?
通訊作者單位:加州理工學院
開發對映選擇性的高效率合成方法對構建季碳立體結構中心非常重要,這種季碳立體中心大量存在于生物活性分子中。目前的一種有應用前景的有機合成方法是,通過簡單易得的消旋三級碳中心分子出發作為親電試劑與金屬有機親核試劑進行對映收斂反應。通過該機制的相關反應仍然非常罕見。
有鑒于此,加州理工學院Gregory C. Fu?等報道了Ni手性催化劑,實現了大量三級碳親電試劑(α-鹵代羰基分子)、金屬烯烴試劑進行反應,以較高的產率和對映選擇性構建了含有季碳結構中心的有機分子。該反應能夠兼容較多種類的官能團,反應條件溫和。通過該方法學實現了兩種重要天然產物分子的全合成,(-)-象牙酮寧、madindoline A。
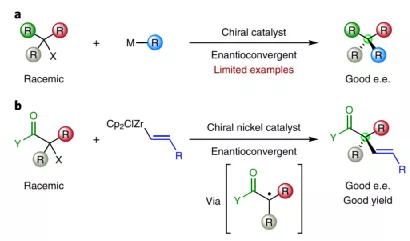
圖1. 本方法學的優勢
反應體系
以正己烯基鋯作為烯烴金屬試劑,對α-溴氮雜環戊酮進行親核取代反應,以0.5 mol % NiCl2 glyme/0.6 mol % 配體作為催化劑體系,在室溫二氧六環溶劑中進行反應。考察了多種不同結構的配體對該體系催化效率的影響,分別測試了吡啶-惡唑啉(L1)、雙惡唑啉(L2)、二惡唑啉-吡啶(NNN三齒)(L3)、鄰二胺(L4)多種配體結構,發現當配體結構為手性吡啶-惡唑啉L1時,該反應的產率達到80 %,對映選擇性達到98 % ee。L2~L4幾種配體在產率和對映選擇性上都無法實現較好的反應活性。
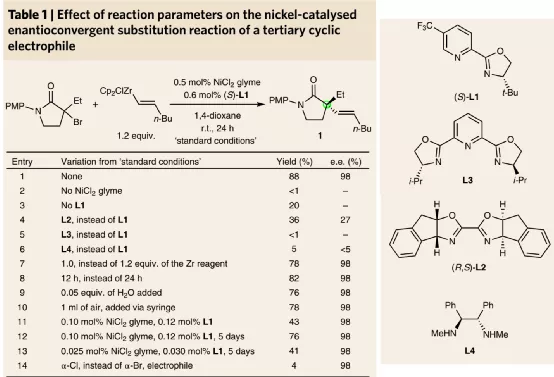
圖2. α-溴羰基分子反應條件優化
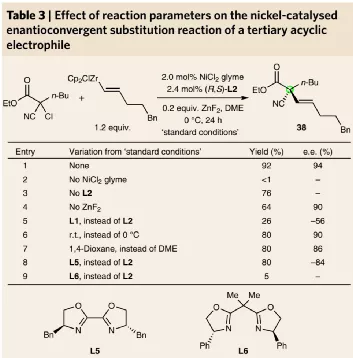
圖3. α-氯羰基分子反應條件優化
進一步的,作者考察了α-氯羰基化合物和正己烯基鋯烯烴金屬試劑的對映選擇性親核取代反應,以α-氰基-α-氯正己酸乙酯、己烯苯基鋯金屬試劑作為反應物,通過將催化劑的配體更換為二惡唑啉(L2),加入0.2倍量ZnF2,在2.0 mol % NiCl glyme/2.4 mol % L2的催化劑體系中,在0 ℃和DME溶劑中反應,實現了92 %的產率和94 % ee。
反應機理
通過在α-溴羰基底物的α-碳上安裝正戊烯基團,通過和烯烴鋯進行親核取代反應,產物中形成了螺環結構,同時產物的對映選擇性基本消除。在相同條件中,通過和Bu3SnH進行親核取代反應進行對比,驗證了該反應中的立體選擇性通過α-C自由基過程進行。
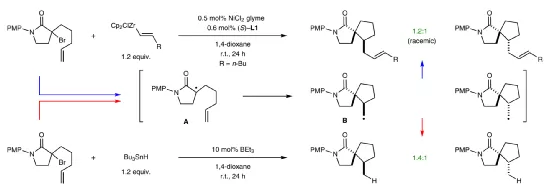
圖4. 反應機理研究
作者介紹
Gregory C. Fu教授于1985年在麻省理工學院獲得學士學位(導師是2001年諾貝爾化學獎得主K. B. Sharpless教授);1991年在美國哈佛大學獲得博士學位(導師:D. A. Evans教授),1991年-1993年在加州理工學院R. H. Grubbs教授(2005年諾貝爾化學獎得主)課題組從事博士后研究。1993-2012年于麻省理工學院工作,于1999年晉升為教授。2012年他作為教授加入加州理工學院。他曾獲得過Elias J. Corey Award 和Arthur C. Cope Scholar Award 等眾多獎項。目前擔任美國化學會期刊JACS副主編。他的主要研究方向是過渡金屬催化的偶聯反應的新方法學研究。
http://www.cce.caltech.edu/people/gregory-c-fu
參考文獻及原文鏈接
Zhaobin Wang, Ze-Peng Yang & Gregory C. Fu*, Quaternary stereocentres via catalytic enantioconvergent nucleophilic substitution reactions of tertiary alkyl halides, Nat. Chem. 2021,
DOI: 10.1038/s41557-020-00609-7
https://www.nature.com/articles/s41557-020-00609-7











