奇物論聯合納米人編輯部對2020年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是中國科學院長春應用化學研究所稀土資源利用國家重點實驗室,化學生物學實驗室曲曉剛研究員課題組。
曲曉剛,中科院長春應用化學研究所稀土資源利用國家重點實驗室研究員, 所學術委員會副主任,化學生物學實驗室主任。主要致力于化學與生物學交叉研究領域,研究方向包括化學調控生物分子構像與功能,藥物與靶分子作用機制,生物動力學及熱力學,生物功能材料等。主要成果包括:利用化學、生物物理、分子生物學、細胞學及材料化學等多學科交叉優勢,在對重要蛋白和基因識別、供能調控及潛在應用等方面做了大量系統的研究工作。為認識和調控重要的與疾病發生、發作相關的生物化學過程提供重要依據。

以下是課題組研究的主要方向:
1.DNA靶向配體設計、手性識別及功能調控
2.阿爾茨海默癥(AD)的藥物設計與合成
3.新型人工酶-納米酶的設計合成與應用
4.細胞行為動態調控
以下按照四個部分對曲曉剛團隊2020年期間發表的部分成果進行歸納,供大家學習和交流。
Part 1. 納米酶
Part 2. 靶向藥物遞送
Part 3. 光學診療試劑
Part 4. 可視化抗菌創可貼
一、納米酶
1. JACS: 仿生納米酶用做H2O2穩態干擾物,顯著增強化學動力學治療效果
化學動力療法(CDT)的有限療效與腫瘤細胞中細胞內過氧化氫量不足密切相關。盡管已經付出了巨大的努力,但仍然缺乏具有直接和安全的H2O2供應能力的CDT試劑。有鑒于此,中國科學院長春應用化學研究所的曲曉剛和任勁松受癌細胞中H2O2生成和消除的平衡啟發,合成了一種基于仿生納米酶的H2O2動態平衡破壞劑,通過促進H2O2的產生和抑制H2O2的消除來提高細胞內H2O2的水平,從而顯著增強CDT療效。
本文要點:
1)首先合成了ZIF-67納米顆粒,其次在ZIF-67納米顆粒上修飾小分子抑制劑3-氨基-1,2,4-三唑(3-AT),最后,在納米材料表面包裹PEG最終得到納米酶(PZIF67-AT)。
2)具有類超氧化物歧化酶活性的納米酶可以將O2.-轉化為H2O2,從而促進H2O2的產生。同時,納米酶可以消耗谷胱甘肽,3-AT可以抑制納米酶本身的過氧化氫酶活性,從而減少了H2O2向H2O的轉化。因此,精準設計的破壞劑擾亂了H2O2的平衡,并導致H2O2在癌細胞中的積累。升高的H2O2濃度最終將放大基于類Fenton 反應的CDT效果。此外,PZIF67-AT很容易在活體動物中代謝和清除,保證了其良好的生物相容性。
3)不僅為臨床設計了一種具有H2O2供給能力的具有增強CDT效果的CDT替代劑,而且為仿生材料的設計提供了新的靈感。
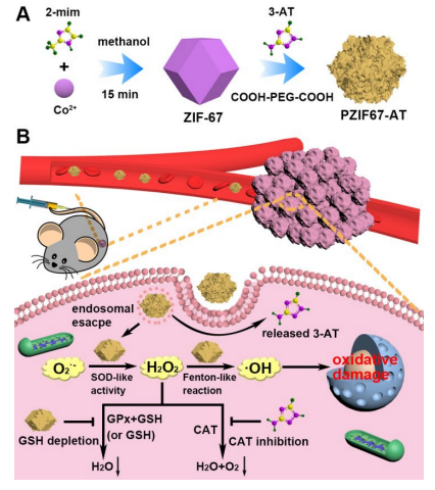
Yanjuan Sang et al. Bioinspired Construction of a Nanozyme-Based H2O2 Homeostasis Disruptor for Intensive Chemodynamic Therapy. J. Am. Chem. Soc., (2020)
DOI: 10.1021/jacs.9b12873
https://pubs.acs.org/doi/abs/10.1021/jacs.9b12873
2. Biomaterials:可被激活的超小納米酶發生器用于增強穿透和深層催化治療
設計開發可在腫瘤微環境中被激活的超小納米酶能夠有效克服傳統活性氧基納米試劑的腫瘤穿透深度,外部能量的組織穿透深度有限、對氧氣嚴重依賴以及非特異性毒性等缺陷。中科院長春應化所曲曉剛研究員將葡萄糖氧化酶(GOx)和超小的過氧化物納米酶嵌入酸解性的 ZIF-8中,構建了一種具有級聯反應能力的納米系統,并將這種具有增強的腫瘤穿透深度的超小納米酶發生器用于深度催化治療。
本文要點:
1)在腫瘤的偏酸性微環境中,瘤內的葡萄糖所產生的葡萄糖酸可逐漸誘導ZIF-8解離,進而釋放超小的過氧化物酶納米酶,實現顯著的瘤內穿透效果。另一方面,生成的壽命相對較長的過氧化氫可在隨后被過氧化物納米酶催化生成高毒性的羥基自由基,從而實現深度催化治療。
2)研究結果表明,該納米平臺不僅可以極大地增強納米酶在腫瘤中的穿透能力,而且可以在不需要氧氣參與和外部能量輸入的情況下直接誘導產生ROS,從而徹底避免了傳統ROS基納米試劑在極度乏氧環境下的失活情況,最終實現了優異的深度催化治療效果。
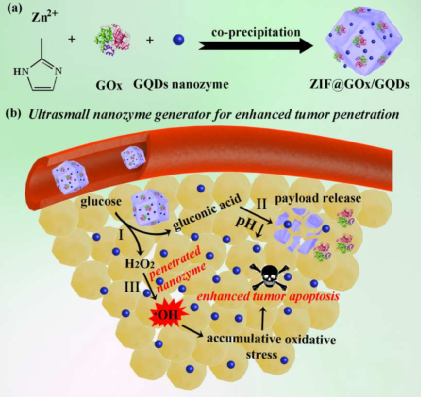
Xinping Liu. et al. Tumor-activatable ultrasmall nanozyme generator for enhanced penetration and deep catalytic therapy. Biomaterials. 2020
https://www.sciencedirect.com/science/article/pii/S0142961220305093
3. ACS Nano:生物相容性NIR-Ⅱ納米酶用于頭皮和顱骨淀粉樣蛋白沉積的時空非侵入性衰減
光療,如光動力療法和光熱療法,在調控阿爾茨海默氏癥β-淀粉樣蛋白(Aβ)自組裝方面具有巨大的潛力。遺憾的是,目前對阿爾茨海默病(AD)的光療工作僅采用可見光或第一近紅外(NIR-I)光,組織穿透性有限,無法避免通過致密的顱骨和頭皮損傷AD患者附近的正常組織。為了克服AD光療的缺點,中科院長春應用化學研究所曲曉剛等人在此報道了一種淀粉樣蛋白靶向、N摻雜的三維介孔碳納米球(KD8@N-MCNs)作為第二近紅外(NIR-II)PTT試劑。
本文要點:
1)KD8@N-MCNs的利用使得在NIR-II窗口中通過頭皮和顱骨對Aβ聚集體進行光熱解離成為可能,而不會損傷附近的正常組織。
2)KD8@N-MCNs同時具有超氧化物歧化酶和過氧化氫酶活性,可以清除細胞內多余的活性氧,減輕體內的神經炎癥。
3)此外,KD8@N-MCNs由于在納米球表面共價接枝了KLVFFAED的靶肽,可以有效地跨越血腦屏障。體內研究表明,KD8@N-MCNs減少了3xTg-AD小鼠模型中Aβ的沉積,改善了記憶缺陷,并減輕了神經炎癥。
綜上所述,此工作提供了一種生物相容性和非侵入性的方法來減輕AD相關的病理改變。
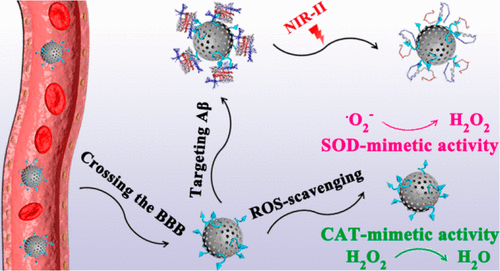
Mengmeng Ma, et al. A Biocompatible Second Near-Infrared Nanozyme for Spatiotemporal and Non-Invasive Attenuation of Amyloid Deposition through Scalp and Skull. ACS Nano, 2020.
DOI: 10.1021/acsnano.0c02733
https://doi.org/10.1021/acsnano.0c02733
4. Chem. Sci:構建手性人工酶以在活細胞中實現對映選擇性催化
作為人工酶家族的新成員,納米酶相比天然酶來說具有一些突出的優勢,例如其在惡劣環境下的高穩定性、易于大規模生產、儲存時間長、成本低和對生物降解的抵抗力強等。然而,如何設計具有高選擇性特別是高對映體選擇性的納米酶仍然是一個很大的研究挑戰。中科院長春應化所曲曉剛研究員提出了一種新型的構建手性人工過氧化物酶的方法。
本文要點:
1)實驗從天然酶辣根過氧化物酶(HRP)的結構出發,以鐵磁性納米粒子(Fe3O4 NP)為催化內核,以帶有氨基酸的手性聚合物外殼為手性選擇器,構建了一系列立體選擇性納米酶(Fe3O4@Poly(AA))。其中,Fe3O4@Poly(D-Trp)表現出最高的對映選擇性。有趣的是,實驗通過利用L-Trp取代D-Trp,它們的對映體選擇性則會發生逆轉,其選擇性系數高達5.38,甚至高于HRP。動力學參數、透析實驗、分子模擬以及活化能表明,D-/L-Trp的選擇性來源于其聚合物外殼的D-/L-Trp附加物,這也使得D-/L-酪氨醇具有更好的親和力和催化活性。
2)此外,通過利用熒光標記的FITC酪氨醇L和RhB-酪氨醇D,實驗證明了該人工過氧化物酶可以催化綠色或紅色熒光的手性酪氨醇,從而在酵母細胞、金黃色葡萄球菌、大腸桿菌和枯草桿菌之間選擇性地標記活酵母細胞。綜上所述,這項研究工作也為更好地設計立體選擇性人工酶開辟了新的途徑。
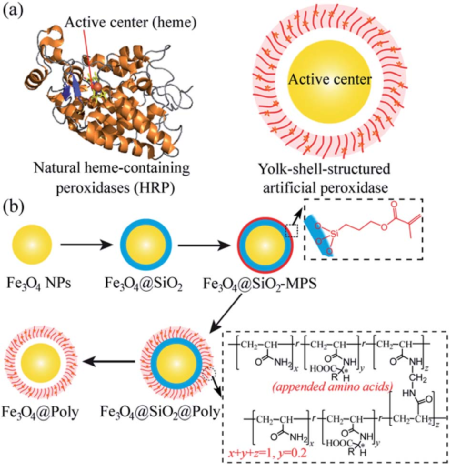
Ya Zhou. et al. Construction of a chiral artificial enzyme used for enantioselective catalysis in live cells. Chemical Science. 2020
DOI: 10.1039/d0sc03082a
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc03082a#!divAbstract
5.Angew:仿生構建具有類偽足表面的MOF@COF納米酶以用于抑制細菌
許多MOFs結構具有模擬酶的功能,但由于其催化活性較低,其在催化和治療方面的效果往往不盡人意。中科院長春應化所曲曉剛研究員和任勁松研究員對,利用源于自然的靈感,設計了一種具有高效的過氧化物模擬酶活性的MOF@COF納米酶。
本文要點:
1)該納米酶以MOF的金屬節點為活性中心,隨后生長的COF結構會產生多級納米空腔以在活性位點附近形成合適的孔環境,可以富集并激活底物分子,進而增強對細菌的抑制作用。
2)此外,COFs具有的類偽足表面使得該系統能夠有效地捕捉細菌,從而進一步增強該納米酶的治療效率。綜上所述,這一研究不僅可以促進新型納米酶的發展,而且也將拓寬MOF/COF基雜化材料的生物學應用。
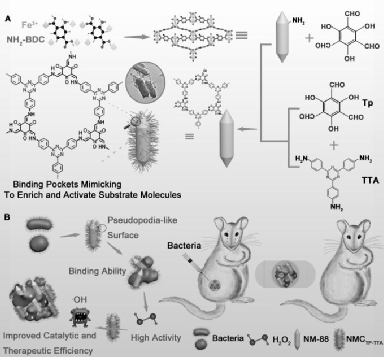
Lu Zhang. et al. Nature-Inspired Construction of MOF@COF Nanozyme with Active Sites in Tailored Microenvironment and Pseudopodia-like Surface for Enhanced Bacterial Inhibition. Angewandte Chemie International Edition. 2020
DOI: 10.1002/anie.202012487
https://onlinelibrary.wiley.com/doi/10.1002/anie.202012487
6.JACS:仿生納米酶選擇性協同清除阿爾茨海默病模型外周β淀粉樣蛋白
外周β淀粉樣蛋白(Aβ)的清除有助于克服血腦屏障(BBB)障礙,消除與阿爾茨海默病(AD)相關的腦源性Aβ。即便如此,當前開發的清除外周Aβ的治療方法仍面臨著如何避免某些生物分子的干擾以及如何防止觸發免疫反應和凝血的挑戰。在此,中科院長春應用化學研究所曲曉剛等人設計并合成了一種具有增強蛋白質吸附抗性,最小化免疫原性和增強生物相容性的仿生納米酶(CuxO@EM-K)。
本文要點:
1)CuxO@EM-K由包裹有修飾3xTg-AD小鼠紅細胞膜和Aβ靶向五肽KLVFF的CuxO納米酶制成。
2)KLVFF是Aβ特異性配體,可與紅細胞膜協同作用以選擇性捕獲血液中的Aβ。同時,紅細胞膜涂層可阻止蛋白質冠的形成,從而保持生物流體中CuxO@EM-K的Aβ靶向能力。
3)更重要的是,具有多種抗氧化酶樣活性的CuxO核穩定了紅細胞外膜,同時減輕了Aβ誘導的膜氧化損傷,使吸附Aβ必不可少的系統循環得以延長。
4)體內研究表明,在廣泛使用的3xTg-AD小鼠模型中,CuxO@EM-K不僅可以減少血液和大腦中的Aβ負荷,而且可以改善記憶缺陷。而且,CuxO@EM-K對3xTg-AD小鼠無明顯毒性。
綜上所述,這項工作為開發與AD相關的外周Aβ的生物相容性和協同清除提供了一個范例。
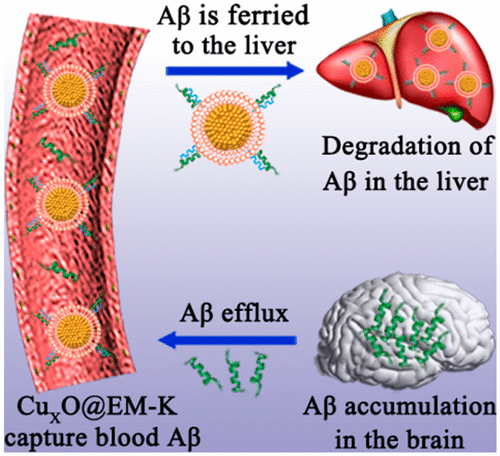
Mengmeng Ma, et al. Self-Protecting Biomimetic Nanozyme for Selective and Synergistic Clearance of Peripheral Amyloid-β in an Alzheimer’ Disease Model. J. Am. Chem. Soc., 2020.
DOI: 10.1021/jacs.0c08395
https://doi.org/10.1021/jacs.0c08395
二、靶向藥物遞送
7. Chem:中性粒細胞膜導向生物正交法合成炎癥靶向手性藥物
本文研究亮點:
1)手性MSN-Pd催化劑用于體內ATH生物正交反應
2)中性粒細胞膜賦予催化劑炎癥靶向性
3)手性模型藥物布洛芬通過靶向性ATH合成以減輕炎癥
靶向生物正交催化在局部前藥活化方面具有巨大潛力。盡管對映體純藥物在臨床中至關重要,但幾乎沒有報道通過生物正交反應在生物體內合成手性藥物。為了實現這一目標,長春應化所曲曉剛研究員等人使用甲酸鈉作為生物相容性還原劑,構建了手性改性Pd催化劑用于不對稱轉移氫化(asymmetric transfer hydrogenation,ATH)反應。
本文要點:
1)通過結合ATH反應和嗜中性粒細胞膜的趨化性,本文實現了活細胞中炎癥部位選擇性手性藥物的合成。
2)作為概念的證明,研究人員通過靶向ATH反應原位合成了手性模型藥物布洛芬,以減輕作為體內模型的小鼠爪中的炎癥。與對照相比,中性粒細胞膜包覆的手性Pd催化劑在抗炎作用中同時表現出靶向炎癥的能力和對映選擇性。這項研究可以為靶向性前藥活化中的生物正交催化提供新的視角。
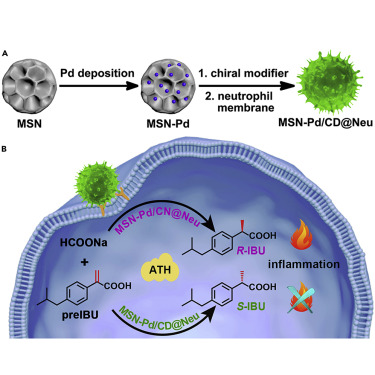
Zhi Du, et al., Neutrophil-Membrane-Directed Bioorthogonal Synthesis of Inflammation-Targeting Chiral Drugs. Chem 2020.
https://doi.org/10.1016/j.chempr.2020.06.002
8. Chem. Sci:類酚基團功能化的石墨烯量子點用于高效治療急性腎損傷
急性腎損傷(AKI)是一種以快速喪失腎代謝功能為特征的綜合征,其死亡率很高。在AKI期間,腎臟內活性氧(ROS)的過量產生被認為是造成腎功能衰竭的主要原因。然而,目前可治療AKI的抗氧化劑往往缺乏良好的抗氧化效果及腎臟富集效率。在此,中科院長春應化所任勁松研究員和曲曉剛研究員受天然酚類抗氧化劑結構的啟發,構建了具有高效清除ROS和腎臟富集能力的類酚基團功能化的石墨烯量子點(h-GQDs),并將其用于對AKI進行抗氧化治療。
本文要點:
1)與天然多酚相似的是,h-GQDs中豐富的類酚基團被證明是其發揮抗氧化作用的關鍵活性成分。進一步的機理研究表明,h-GQDs的超高抗氧化活性其實不僅來源于類酚基團,還與相鄰類酚基團之間的協同作用以及對h-GQDs上的羰基的去除有關。
2)在AKI小鼠模型中,實驗證明了僅用臨床抗氧化劑N-乙酰半胱氨酸(NAC)的十六分之一劑量的h-GQDs就能有效保護腎臟不受氧化損傷,且無毒副作用產生。這一研究工作證明了利用結構-活性關系可以促進高性能碳基抗氧化平臺的開發,進而用于治療AKI和其他ROS相關的疾病。
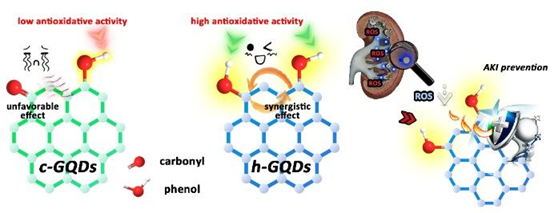
Huan Wang. et al. Phenol-Like Groups Functionalized Graphene Quantum Dots Structurally Mimicking Natural Antioxidants for Highly Efficient Acute Kidney Injury Treatment. Chemical Science. 2020
DOI: 10.1039/D0SC03246H
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc03246h#!divAbstract
9. ACS Nano:用于增強化療/化學動力學協同治療的智能納米顆粒遙控自毀巨噬細胞
巨噬細胞可以穿透腫瘤中心缺氧區,在腫瘤藥物遞送方面具有巨大的潛力。然而,如何防止早期藥物泄漏,和充分在腫瘤部位釋放治療藥物,是目前基于巨噬細胞的藥物遞送系統(MDDSs)面臨的一大挑戰。此外,這些MDDSs在實體瘤中會遇到耐藥性和缺氧的微環境,這進一步影響了其治療效果。因此,通過將智能納米粒子(載阿霉素(DOX)的介孔碳納米球包裹在MnO2殼中)內化到巨噬細胞中,中科院長春應用化學研究所曲曉剛、任勁松等人開發了一種用于增強化療/化學動力協同治療的巨噬細胞載體(MMDM)。
本文要點:
1)產生的MMDM可以避免過早藥物泄漏導致的細胞功能障礙,并最大限度地維持細胞活力。
2)在腫瘤組織中積聚后,MMDM可以在近紅外激光下被破壞,使納米顆粒從載體巨噬細胞中充分釋放出來。然后,釋放的納米顆粒可以分解腫瘤微環境中的H2O2產生O2,以緩解腫瘤缺氧。
3)同時,納米顆粒的MnO2殼層被細胞內的谷胱甘肽還原為Mn2+,引發DOX的釋放,從而增強Mn2+介導的類Fenton反應。
綜上所述,這項研究為基于巨噬細胞的遞送系統提供了一種有趣的策略,可用于增強化療/化學動力協同治療。
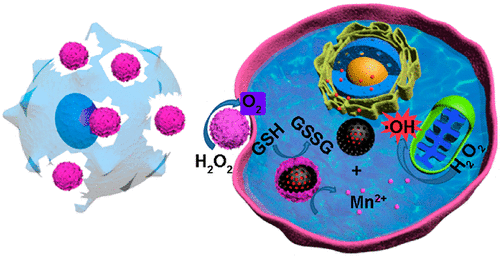
Panpan Sun, et al. A Smart Nanoparticle-Laden and Remote-Controlled Self-Destructive Macrophage for Enhanced Chemo/Chemodynamic Synergistic Therapy. ACS Nano, 2020.
DOI: 10.1021/acsnano.0c06290
https://doi.org/10.1021/acsnano.0c06290
三、光學診療試劑
10. ACS NANO:近紅外雙促進非均相銅納米催化劑用于體內高效生物正交化學

由于具有較好的穩定性和生物安全性,非均相銅納米顆粒(CuNPs)作為Cu(I)催化的疊氮二烷基環加成(CuAAC)反應的有力候選材料。但由于Cu(0)本身活性差,限制了其廣泛的生物應用。中國科學院長春應用化學研究所曲曉剛研究員團隊利用生物相容性非均相銅納米催化劑在近紅外(NIR)照射下的的光動力和光熱效應對CuAAC反應進行了雙重促進。
本文要點:
1)非均相銅納米催化劑在NIR照射下的光動力學活性可以促進Cu(0)向Cu(I)的轉化,加速CuAAC的催化過程。
2)非均相銅納米催化劑在NIR照射下的較高的光熱轉換效率(η=50.6%)可以提高反應的局部溫度,進一步促進整個反應的進行。
3)從細胞實驗到到線蟲的活體系統及小鼠體內腫瘤治療實驗發現,在NIR照射下,熒光激活和藥物合成明顯加快。該研究為高催化性能和效率完成CuAAC反應有很好的指導意義。
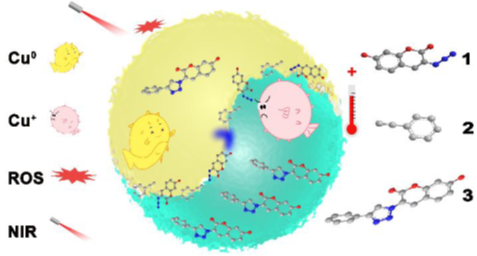
You, Y., et al., Near-InfraredLight Dual-Promoted Heterogeneous Copper Nanocatalyst for Highly EfficientBioorthogonal Chemistry In Vivo. ACS Nano. 2020;14(4):4178‐4187.
doi:10.1021/acsnano.9b08949.
https://dx.doi.org/10.1021/acsnano.9b08949
11.Nano Letters:自推進式主動光熱納米游泳器,用于清除體內深層生物膜
增加抗菌藥物對生物膜的滲透性是提高治療效果、減緩抗生素耐藥性的有效策略。在此,中國科學院長春應用化學研究所曲曉剛等人設計了一種近紅外(NIR)光驅動的納米級游泳器(HSMV)來應對這一挑戰。
本文要點:
1)在近紅外光照射下,由于非對稱分布的AuNPs的光熱轉化作用,HSMV能夠在5min內高效地自我推進并穿透到生物膜中。
2)萬古霉素(Van)的局部熱(~45℃)和熱觸發釋放可將光熱治療和化療有效地結合在一個系統中。
3)HSMV的主動運動增加了光熱治療(PTT)的有效距離,提高了抗生素的治療指數,使體外生物膜去除率達到90%以上。值得注意的是,HSMV可以在10分鐘的激光照射下消除體內生長的金黃色葡萄球菌生物膜,而不會對健康組織造成損害。
綜上所述,這項工作可能會為體內治療生物膜相關感染的治療策略提供幫助。
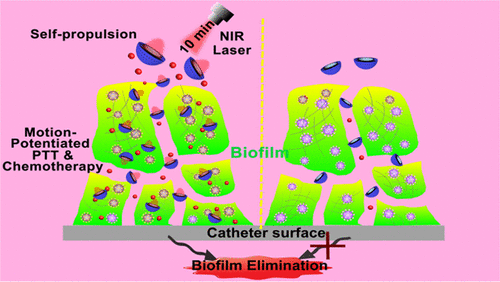
Tingting Cui, et al. Self-Propelled Active Photothermal Nanoswimmer for Deep-Layered Elimination of Biofilm In Vivo. Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.0c02767
https://doi.org/10.1021/acs.nanolett.0c02767
12. Chem. Sci:靶向驅動的自組裝超分子用于選擇性治療阿爾茨海默病
對淀粉樣蛋白(Aβ)進行光氧化被認為是治療阿茲海默病(AD)的一種有效方法。然而,現有的光敏劑往往不能穿透血腦屏障(BBB)以及對Aβ進行選擇性光氧化,因此其治療效果較差,并會產生嚴重的脫靶毒性。中科院長春應化所曲曉剛研究員設計了一種具有增強BBB穿透能力和可切換光活性的自組裝超分子(PKNPs),并證明其可以在體內有效地防止Aβ發生聚集。
本文要點:
1)實驗通過對靶向Aβ的多肽KLVFF和FDA批準的卟啉衍生物(5-(4-羧基)-10,15,20-三苯卟啉)進行自組裝以制備了PKNPs。由于PKNPs具有光熱效應,因此在激光輻照下,PKNPs對BBB的通透性比單獨的卟啉高出8.5倍。此外,PKNPs在與Aβ發生選擇性相互作用后,它會從球形形態轉變為非晶態形態,從而實現了光熱活性向光動力活性的轉變,進而可以選擇性地氧化Aβ。
2)體內實驗表明,PKNPs可以有效地緩解氧化石墨烯誘導的神經毒性,延長常用的AD轉基因秀麗隱桿線蟲CL2006的壽命。綜上所述,這一研究工作將自組裝超分子作為可切換型光學診療試劑,從而為選擇性地預防Aβ聚集和相關的神經毒性提供了一條新的途徑。
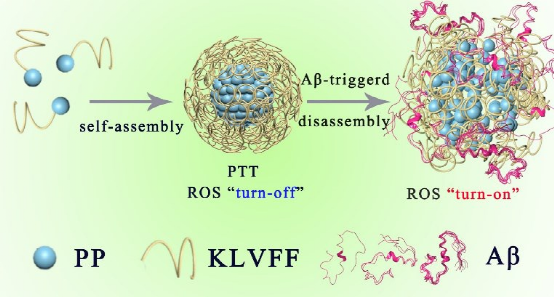
Zhenqi Liu. et al. Target-driven Supramolecular Self-assembly for Selective Amyloid-β Photooxygenation Against Alzheimer’s Disease. Chemical Science. 2020
DOI: 10.1039/D0SC04984K
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc04984k#!divAbstract
四、可視化抗菌創可貼
13. ACS central science:一種便攜式的可視化創可貼用于定點檢測和治療細菌感染

對于細菌感染和細菌耐藥性的前期監測對于選擇治療方案非常重要。然而,常用的電阻傳感方法受時間、專業人員要求和昂貴儀器的限制。尤其是現在抗生素的濫用加速了細菌耐藥性的過程。中國科學院長春應用化學研究所曲曉剛研究員團隊構建了一種便攜式紙基創可貼(PBA),該創可貼在檢測到耐藥性后,即可實施選擇性抗菌策略。
本文要點:
1)合成了一種卟啉基金屬有機骨架,在其內部負載氨芐西林(抗生素,治療多種細菌感染),在其外部包裹殼聚糖,以吸引帶負電荷的細菌,實現酸敏感藥物釋放。
2)溴麝香草酚藍(BTB)對感染部位的酸性環境有反應,顏色由綠色變為黃色。因此將上述納米材料及BTB整合到纖維素紙中,制備出PBA。
3)對于敏感性細菌(DS)引起的感染,PBA由綠色變為黃色,并釋放抗生素以根除DS-E.coli(基于抗生素的化療)。
4)對于耐藥性細菌(DR)引起的感染,PBA由黃色變為紅色,并補充光照以消除耐藥性。與傳統的基于光動力學療法(PDT)的抗菌策略相比,可以用肉眼實時跟蹤耐藥情況,減輕了靶外副作用(基于卟啉基金屬有機骨架的PDT療法)。
5)PBA性能優良、成本低、操作方便優點,可以開發出適合實際應用的PBA。

Sun, Y., et al., ColorimetricBand-aids for Point-of-Care Sensing and Treating Bacterial Infection. ACSCentral Science 2020, 6 (2), 207-212.
doi:10.1021/acscentsci.9b01104
https://doi.org/10.1021/acscentsci.9b01104
此外,曲曉剛團隊2020年還發表了其他相關的高水平研究論文,由于篇幅關系就不在此一一展示,感興趣的讀者可前往該課題組網站進行學習。課題組網站:http://yjsb.ciac.cas.cn/dsjj/wjhx_hxswx/201905/t20190507_486687.html
個人簡介:

曲曉剛博士,中科院長春應用化學研究所稀土資源利用國家重點實驗室研究員, 所學術委員會副主任,化學生物學實驗室主任。1995 年在中科院長春應化所獲博士學位并獲中科院院長獎;1996-2002 在美工作學習, 曾師從加州理工學院諾貝爾獎獲得者A. H. ZewaiI 教授;2006.12-2007.5 UCSB 訪問教授,與諾貝爾獎獲得者Alan J. Heeger 實驗室開展合作研究。國家杰出青年基金獲得者(2002), 英國皇家化學會會士( FRSC) , 昆士蘭大學榮譽教授, 目前擔任刊J Mater Chem B 和Mater Adv 副主編,J Inorg Biochem, Chemosensors, Mater Today Chem, 高等學校化學學報, 稀土學報, 應用化學等期刊編委。
主要從事化學與生命科學交叉的新興領域。獲美國授權專利1 項,中國授權專利11項。論文被評為2006 年國際“百篇優秀基因治療論文“ ,2013 年”中國百篇最具影響國際學術論文“。目前共發表論文390 余篇,SCI 他引> 2.61 萬次,SCI H-index 86;2017-2019 連續3 年入選科睿唯安(CIarivate Analytics) 全球" 高被引學者(Highly Cited Resea rchers)" ;第七屆國際四鏈核酸會議主席;多次在國際及國內會議作大會報告和邀請報告。











