免疫療法,尤其是免疫檢查點抑制劑(ICI)療法,徹底改變了臨床癌癥治療方法。利用納米技術提高免疫治療效率是近年來的研究熱點。然而,在復雜的免疫激活過程中,使用單一納米顆粒來滿足所有要求存在著矛盾和障礙。
成果簡介
鑒于此,中科院長春應用化學研究所陳學思、宋萬通等人報道了一種超分子組裝的可編程免疫激活納米藥物(PIAN),其在靜脈注射后可連續完成多個步驟,并在原位誘導強大的抗腫瘤免疫。成果以題為Supramolecular Assembled Programmable Nanomedicine As In Situ Cancer Vaccine for Cancer Immunotherapy發表在Advanced Materials上

整體過程
1)在血液中循環,
2)由于EPR效應而在腫瘤組織中積累,
3)CpG / PAMAM和PEG響應于腫瘤組織內的高活性氧(ROS)水平;
4)腫瘤細胞的PPCD內吞作用,促進腫瘤細胞死亡和抗原釋放;
5)CpG / PAMAM捕獲釋放的抗原;
6)CpG / PAMAM /抗原到達TdLN,
7)樹突狀細胞(DC)的CpG / PAMAM /抗原內吞作用,
8)DC的激活,
9)從激活的DC到T細胞的抗原呈遞
10)腫瘤抗原特異性效應T細胞返回腫瘤床發揮抗腫瘤作用。
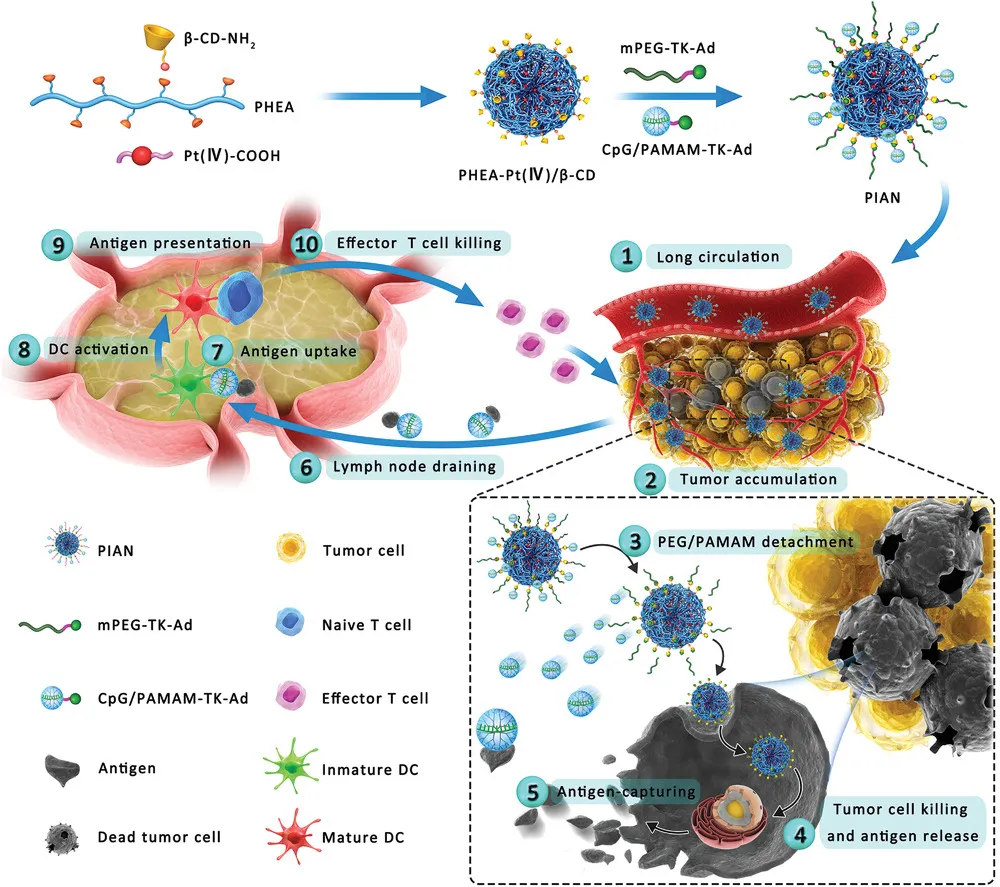
示意圖
材料構建
可編程納米藥物是通過聚[(N-2-羥乙基)-天冬酰胺]- Pt(IV) /β-環糊精(PPCD)、CpG/聚酰胺胺-硫代縮酮-金剛烷(CpG/PAMAM - TK - Ad)和甲氧基聚(乙二醇)-硫代縮酮-金剛烷(mPEG - TK - Ad)之間的主客體相互作用通過超分子組裝而成。
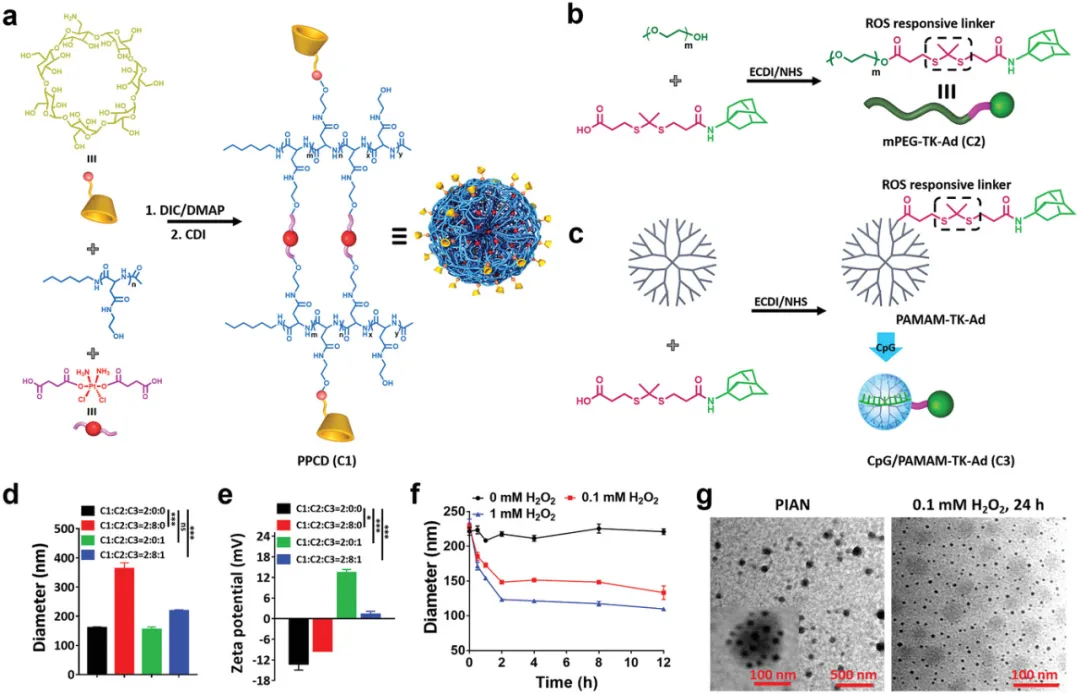
納米粒子構建和表征
體內外試驗
在靜脈注射和腫瘤部位積聚后,腫瘤微環境中的高水平活性氧促進了PIAN的解離和PPCD(介導腫瘤細胞殺傷和抗原釋放)以及CpG/PAMAM(介導抗原捕獲和轉移到腫瘤引流淋巴結)的釋放,導致抗原提呈細胞激活、抗原提呈和強大的抗腫瘤免疫應答。結合抗PD‐L1抗體,該藥物可治愈40%結腸直腸癌模型小鼠。
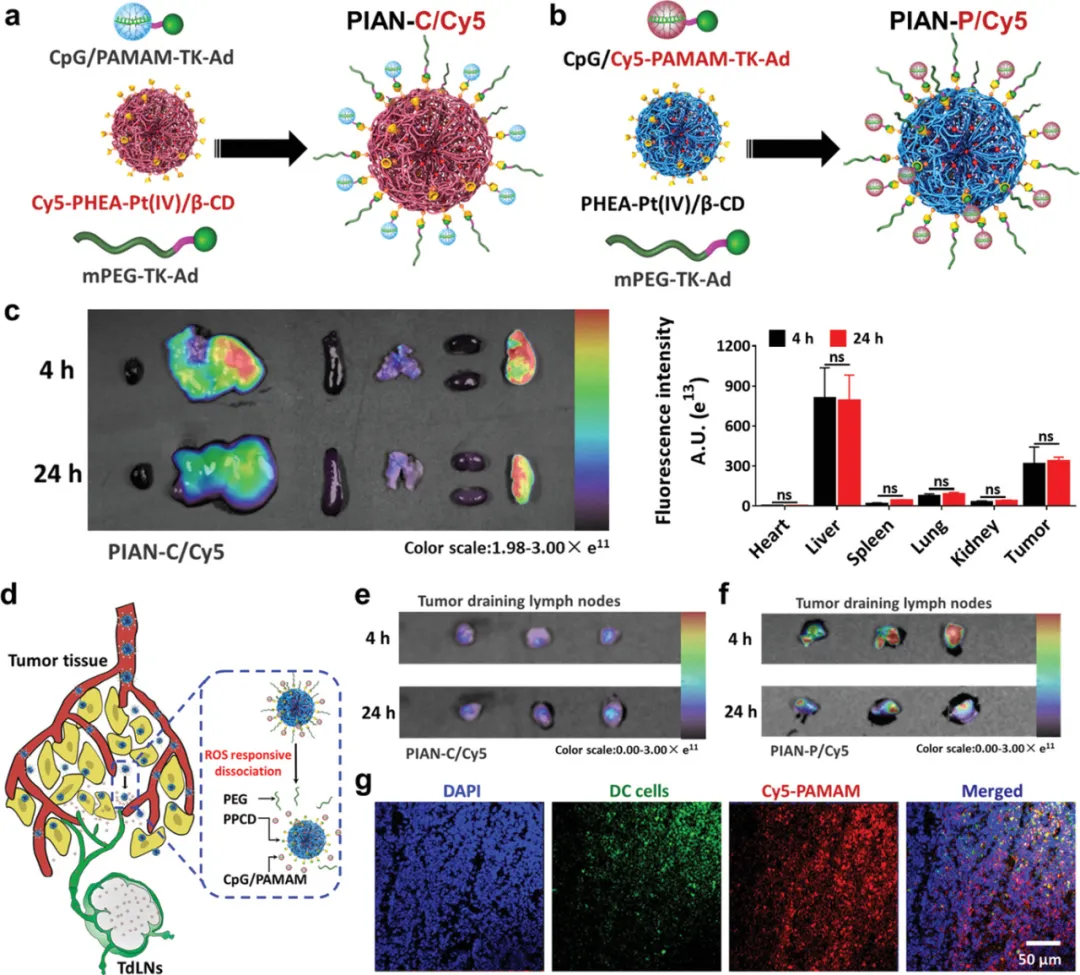
圖|腫瘤處累積和引流到淋巴
小結
綜上所述,這項研究報告了一種可編程的納米藥物,可用于腫瘤治療并引發強大的抗腫瘤免疫反應。靜脈注射后,PIAN可以通過響應腫瘤特異性刺激而自動轉化并完成引發強烈的抗腫瘤免疫反應的連續多個步驟,從而充當原位癌疫苗。這項研究證明了納米材料介導的癌癥免疫療法的新范例。
參考文獻:
Yu Zhang, et al. Supramolecular Assembled Programmable Nanomedicine As In Situ Cancer Vaccine for Cancer Immunotherapy. Adv. Mater., 2020.
DOI: 10.1002/adma.202007293
https://doi.org/10.1002/adma.202007293











