奇物論聯(lián)合納米人編輯部對2020年國內(nèi)外重要科研團(tuán)隊(duì)的代表性成果進(jìn)行了梳理,今天,我們要介紹的是武漢大學(xué)化學(xué)與分子學(xué)院副院長張先正教授課題組。
張先正,武漢大學(xué)化學(xué)與分子學(xué)院副院長。長期從事生物醫(yī)用高分子/多肽的研究,包括腫瘤診斷與治療、藥物傳遞、基因治療等,研究成果獲教育部自然科學(xué)一等獎(jiǎng)1項(xiàng)、二等獎(jiǎng)1項(xiàng)、湖北省自然科學(xué)一等獎(jiǎng)1項(xiàng)。已在Nat. Biomed. Eng.、Prog. Polym. Sci.、Nat. Commun.、Sci. Adv、Adv. Mater.、JACS、Angew. Chem. Int. Ed.、Nano Lett.、ACS Nano、Adv. Func. Mater.、Biomaterials、Small等期刊發(fā)表SCI論文500多篇,其中IF大于10的160多篇。論文SCI他引18000多次,H因子73。

以下是課題組研究的主要方向:
1.腫瘤診斷與治療
2.藥物遞送
3.基因治療
以下按照六個(gè)部分對張先正團(tuán)隊(duì)2020年期間發(fā)表的部分成果進(jìn)行歸納,供大家學(xué)習(xí)和交流。
Part 1. 仿生材料與代謝療法
Part 2. 免疫治療
Part 3. 光治療
Part 4. 藥物遞送
Part 5. 氣體治療
Part 5. 其他
一、仿生材料與代謝療法
1. Nature Biomed. Eng.:口服微生物雞尾酒,級聯(lián)系統(tǒng)除廢物,未來還需要透析機(jī)嗎?
張先正教授研究團(tuán)隊(duì)報(bào)告了一種降解腸道含氮廢物的口腔微生物組微生態(tài)系統(tǒng)的設(shè)計(jì),展示了在腎損傷動(dòng)物體內(nèi)口服的一種細(xì)菌雞尾酒可以在血氮廢物通過腸黏膜屏障擴(kuò)散之前代謝掉。相關(guān)成果于7月6日發(fā)表于Nature Biomedical Engineering上。

研究思路
1)首先,建立了一個(gè)將代謝廢物轉(zhuǎn)化為營養(yǎng)的合成微生物群落。微生物完全有潛力代謝各種含氮廢物。研究人員選擇了可以代謝尿素(埃希氏菌屬的菌株1)或肌酐(芽孢桿菌屬的菌株2)轉(zhuǎn)化為氨,考慮到氨的高毒性,再加上可將氨轉(zhuǎn)化為氨基酸的腸桿菌菌株(菌株3)。
2)然后,通過微流控技術(shù),將三種細(xì)菌包裹在藻酸鈣微球中以實(shí)現(xiàn)空間共定位。該人工生態(tài)系統(tǒng)可促進(jìn)不同菌株之間的代謝級聯(lián)。
3)還在微球表面原位聚合了一層聚多巴胺(PDA)納米膜,選擇性地使小分子氮源進(jìn)入細(xì)菌微生態(tài)系統(tǒng)(bacterial micro-ecosystem,BME),以防止含氮大分子的過量消耗。該涂層還提高了含氮廢物在復(fù)雜環(huán)境中的降解率。且假設(shè)口服BME可以有效清除代謝廢物而不會引起明顯的不良反應(yīng)。
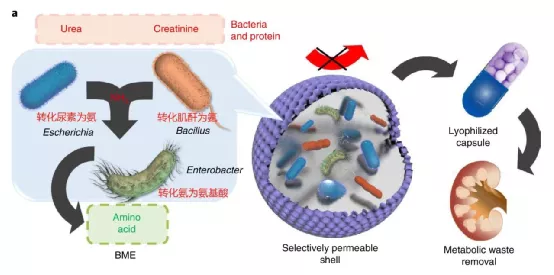
示意圖
綜上所述,研究人員全面研究了BME在清除代謝廢物方面的功效。包裹微生物混合物顯著降低了血液中尿素和肌酐的濃度,并且沒有導(dǎo)致任何不良影響。
細(xì)菌具有多種代謝途徑,經(jīng)過進(jìn)一步的菌種篩選,人工菌群可降解的廢物種類可進(jìn)一步擴(kuò)大。同時(shí),保護(hù)性益生菌也可以加入到BME中,在減輕腎臟損傷的同時(shí)清除代謝廢物。根據(jù)不同類型腎功能衰竭的特點(diǎn),可以將具有不同代謝特性和功能的細(xì)菌組合起來,實(shí)現(xiàn)個(gè)性化治療。可以將這種策略發(fā)展為一種與透析協(xié)同作用并減少透析頻率和時(shí)間的技術(shù)。
然而,具體的治療機(jī)制和安全性仍有一些問題需要進(jìn)一步研究解決。最重要的是,利用合成材料的高度可控性和智能響應(yīng),仍然有很大的空間來更新當(dāng)前基于微生物組的療法,以治療除腎功能衰竭以外的代謝性疾病。
參考文獻(xiàn):
Zheng,D., et al. An orally delivered microbial cocktail for the removal ofnitrogenous metabolic waste in animal models of kidney failure. Nat Biomed Eng(2020).
https://doi.org/10.1038/s41551-020-0582-1
2. Angew:通過將細(xì)菌呼吸和腫瘤代謝進(jìn)行偶聯(lián)來干預(yù)腫瘤發(fā)展
武漢大學(xué)張先正教授利用希瓦氏菌MR-1 (S. oneidensis MR-1)可以通過將電子轉(zhuǎn)移給金屬礦物的方式以厭氧分解乳酸從而進(jìn)行呼吸作用的這一特性,將二氧化錳(MnO2)納米花修飾到S. oneidensis MR-1表面,構(gòu)建了一個(gè)以乳酸為燃料的生物混合材料(Bac@MnO2)。
本文要點(diǎn):
1)Bac@MnO2中的MnO2納米花可作為電子受體,而腫瘤的代謝產(chǎn)物乳酸可作為電子供體,進(jìn)而在腫瘤部位建立完整的細(xì)菌呼吸通路,導(dǎo)致細(xì)胞間的乳酸被持續(xù)消耗分解。
2)此外,修飾的MnO2納米花還可以催化內(nèi)源性過氧化氫(H2O2)生成氧氣(O2),氧氣可以通過下調(diào)缺氧誘導(dǎo)因子-1 (HIF-1)的表達(dá)來進(jìn)一步抑制乳酸的生成。由于乳酸在腫瘤發(fā)生過程中起著關(guān)鍵的作用,因此該生物混合材料Bac@MnO2可以通過將細(xì)菌呼吸作用與腫瘤代謝過程進(jìn)行偶聯(lián)以顯著地干預(yù)腫瘤的發(fā)展。
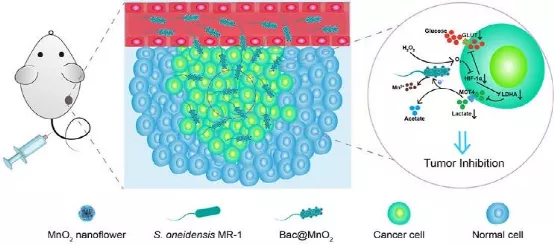
Qi-Wen Chen. et al. Intervening Tumor Progression by Coupling Bacteria Respiration with Tumor Metabolism. Angewandte Chemie International Edition. 2020
DOI: 10.1002/anie.202002649
https://onlinelibrary.wiley.com/doi/10.1002/anie.202002649
3. AM: 益生元包裹的益生菌孢子可調(diào)節(jié)腸道菌群并抑制結(jié)腸癌
盡管基于微生物的治療被認(rèn)為是治療結(jié)腸癌等疾病的有效策略,但其安全性仍然是最大的挑戰(zhàn)。于此,武漢大學(xué)張先正教授等人利用益生菌和益生元具有理想的生物相容性(已經(jīng)被廣泛用作食品和藥品的添加劑),將它們結(jié)合起來構(gòu)成一種安全的微生物調(diào)節(jié)材料。
本文要點(diǎn):
1)通過商業(yè)丁酸梭菌和化學(xué)修飾的益生元葡聚糖之間的宿主-客體化學(xué)反應(yīng),制備了益生元包裹的益生菌孢子(孢子-dex)。研究人員發(fā)現(xiàn)孢子-dex在口服后可以特異性地富集結(jié)腸癌。在病灶中,葡聚糖被丁酸梭菌發(fā)酵,從而產(chǎn)生抗癌短鏈脂肪酸(short‐chain fatty acids,SCFA)。
2)此外,孢子-dex調(diào)節(jié)腸道菌群,增加了產(chǎn)生SCFA的細(xì)菌(例如真細(xì)菌和玫瑰菌)的豐度,并顯著增加菌群的總體豐富度。在皮下和原位腫瘤模型中,載藥孢子-dex分別抑制腫瘤的生長,分別高達(dá)89%和65%。重要的是,未發(fā)現(xiàn)明顯的不良影響。這項(xiàng)工作揭示了使用高度安全的策略來調(diào)節(jié)腸道菌群的可能性,并為治療各種胃腸道疾病提供了有希望的途徑。
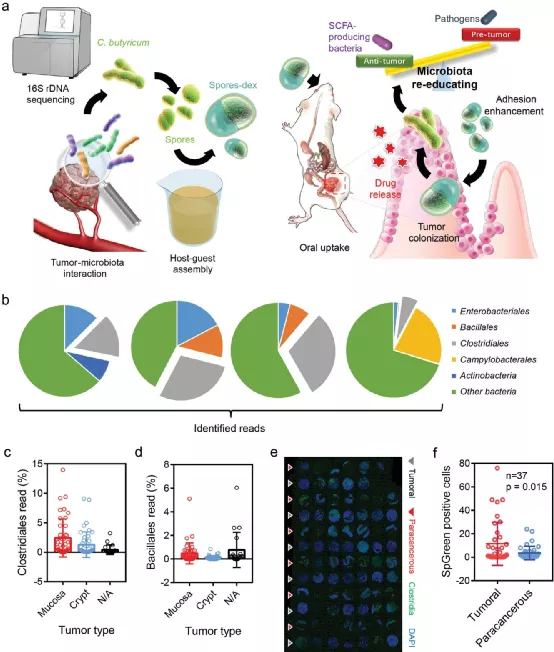
Zheng, D.‐W., et al., Prebiotics‐Encapsulated Probiotic Spores Regulate Gut Microbiota and Suppress Colon Cancer. Adv. Mater. 2020, 2004529.
https://doi.org/10.1002/adma.202004529
4. Nature Commun.:兵糧寸斷!人工仿ECM對實(shí)體瘤進(jìn)行圍捕!
作為腫瘤微環(huán)境中最重要的非細(xì)胞成分之一,ECM對于滿足癌細(xì)胞維持快速生長和持續(xù)增殖的需求至關(guān)重要。據(jù)報(bào)道,ECM結(jié)構(gòu)的變化會引起限制性的代謝反應(yīng),那么,能否通過在ECM中引起化學(xué)反應(yīng),以切斷營養(yǎng)供應(yīng)并同時(shí)改善腫瘤灌注?
鑒于此,啟發(fā)于凝血過程,武漢大學(xué)張先正教授課題組報(bào)告了基于纖維蛋白原和凝血酶的凝血系統(tǒng),以構(gòu)建用于選擇性切斷腫瘤代謝通量的人工ECM(aECM)。一旦誘導(dǎo)了微傷口,就可以觸發(fā)aECM的級聯(lián)凝膠化來圍攻腫瘤。最重要的是,aECM的凝膠化可以通過諸如超聲治療、手術(shù)或放射療法之類的臨床操作來誘導(dǎo),這意味著該策略有可能被轉(zhuǎn)化為臨床聯(lián)合治療方案。
整體思路
該課題組主要是利用兩種FDA認(rèn)證的藥物(纖維蛋白原和凝血酶原),其中纖維蛋白原使用疊氮基修飾(Fb-N3),凝血酶原使用偶氮二苯并環(huán)辛炔(DBCO)接枝(Ptb-DBCO)。
首先,尾靜脈注射Fb-N3后,通過手術(shù)、RT或超聲(US)處理形成的微傷口來觸發(fā)Fb-N3在腫瘤處特異性累積。
然后,再注射Ptb-DBCO,并且利用DBCO和N3基團(tuán)之間的生物正交反應(yīng)使得Ptb-DBCO在腫瘤處累積。由于血管結(jié)構(gòu)的改變,Ptb會輕易地轉(zhuǎn)化為凝血酶,并發(fā)生凝血過程。形成地網(wǎng)狀血凝塊圍住腫瘤,產(chǎn)生aECM纖維蛋白凝膠,用于阻斷營養(yǎng)物質(zhì)交換并防止腫瘤細(xì)胞遷移。
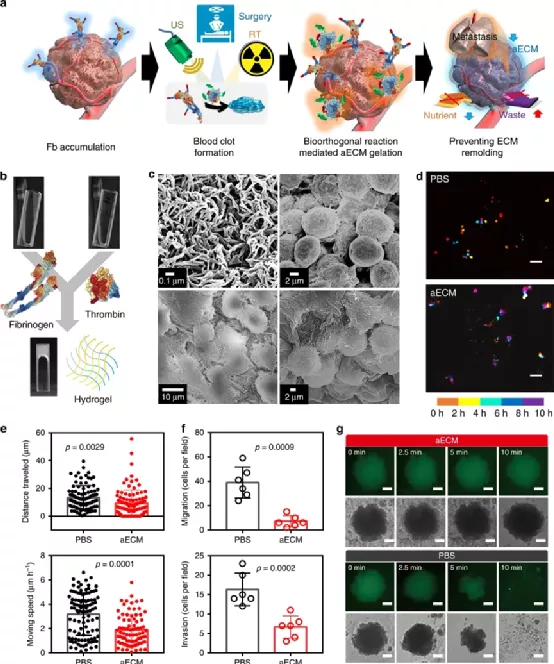
圖| aECM的體外凝膠化
小結(jié):
綜上所述,這項(xiàng)研究開發(fā)了一種基于酶促反應(yīng)的實(shí)體瘤圍捕療法。結(jié)合US、手術(shù)或RT,成功在多種癌癥類型中誘導(dǎo)了aECM凝膠化。這種能力還確立了將aECM凝膠引入標(biāo)準(zhǔn)治療方案的優(yōu)勢,以用于大多數(shù)癌癥病例的一線治療。盡管目前這種基于酶促反應(yīng)的療法目前仍處于起步階段,但研究人員認(rèn)為該策略將為更新當(dāng)前的癌癥療法和有益于個(gè)性化醫(yī)學(xué)提供一條嶄新的途徑。
參考文獻(xiàn):
Zheng, D., et al. Controllable gelation of artificial extracellular matrix for altering mass transport and improving cancer therapies. Nat Commun 11, 4907 (2020).
https://doi.org/10.1038/s41467-020-18493-7
5. Chem. Soc. Rev:增強(qiáng)癌癥治療的細(xì)胞原基仿生功能材料
武漢大學(xué)張先正教授對細(xì)胞原基仿生功能材料在增強(qiáng)癌癥治療方面的研究進(jìn)行了綜述介紹。
本文要點(diǎn):
1)細(xì)胞原基功能材料結(jié)合了天然物質(zhì)和納米技術(shù)的各自優(yōu)點(diǎn),已成為一種極具吸引力的癌癥治療藥物。細(xì)胞原體具有獨(dú)特的生物學(xué)功能,如長時(shí)間的體內(nèi)循環(huán)、腫瘤特異性靶向和免疫調(diào)節(jié)等。此外,具有獨(dú)特理化性質(zhì)的合成納米材料也已被廣泛用作治療癌癥的藥物載體或抗癌試劑。因此,這兩種材料的結(jié)合將有望產(chǎn)生具有多種功能、高生物相容性的生物材料,進(jìn)而實(shí)現(xiàn)精確的癌癥治療。
2)本在文中綜述了近年來以細(xì)胞原基為基礎(chǔ)、具有腫瘤治療功能的材料的研究進(jìn)展;介紹了不同的細(xì)胞原體,包括細(xì)菌、噬菌體、細(xì)胞、細(xì)胞膜和其他生物活性物質(zhì)的獨(dú)特生物活性和功能;同時(shí),作者也討論了將其與合成材料特別是納米系統(tǒng)相結(jié)合以構(gòu)建功能化生物材料的策略;最后,作者也對該領(lǐng)域未來的研究方向進(jìn)行了展望。
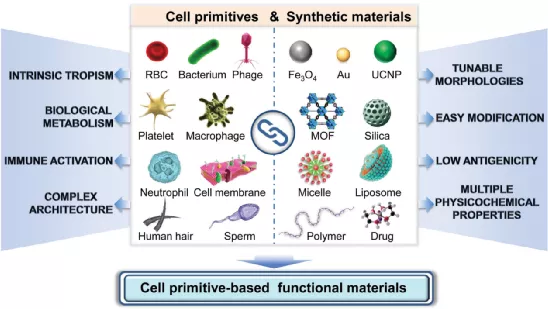
Guo-Feng Luo. et al. Cell primitive-based biomimetic functional materials for enhanced cancer therapy. Chemical Society Reviews. 2020
DOI: 10.1039/d0cs00152j
https://pubs.rsc.org/en/content/articlelanding/2020/cs/d0cs00152j#!divAbstract
二、免疫治療
6. Nature Commun.:一種基于疫苗的納米系統(tǒng)用于提高腫瘤免疫治療
免疫檢查點(diǎn)阻斷(ICB)免疫治療的應(yīng)答率不理想,嚴(yán)重限制了其作為腫瘤治療的臨床應(yīng)用。在此,武漢大學(xué)張先正等人通過將Cd274的siRNA整合到商品化的人乳頭瘤病毒(HPV)L1(HPV16 L1)蛋白中,生成了一個(gè)基于疫苗的納米系統(tǒng)。
本文要點(diǎn):
1)該納米系統(tǒng)具有良好的生物安全性,提高了抗腫瘤免疫治療的療效。
2)HPV16 L1蛋白通過I型干擾素途徑激活先天免疫,與ICB聯(lián)合治療時(shí)顯示出有效的抗癌作用。
3)對于可切除以及不可切除的乳腺腫瘤,該納米系統(tǒng)減少了71%的腫瘤復(fù)發(fā),并將無進(jìn)展生存期延長了67%。
4)最重要的是,該納米系統(tǒng)在具有不同抗原負(fù)載的各種轉(zhuǎn)基因乳腺癌模型中成功誘導(dǎo)了高應(yīng)答率。這種以基于疫苗的納米系統(tǒng)所激發(fā)的強(qiáng)大免疫刺激可能是顯著改進(jìn)當(dāng)前ICB免疫治療的一種途徑。
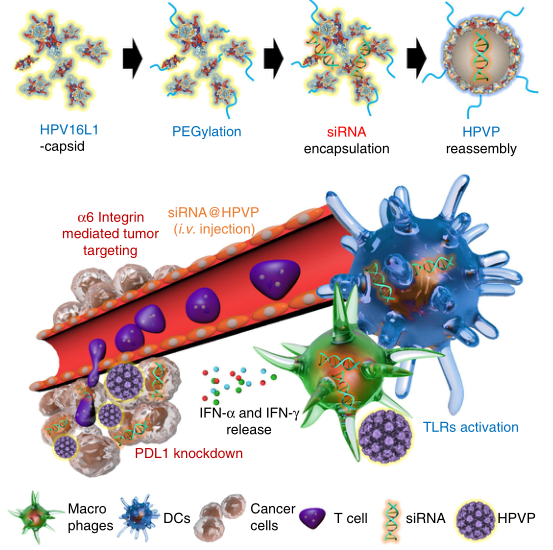
Di-Wei Zheng, et al. A vaccine-based nanosystem for initiating innate immunity and improving tumor immunotherapy, Nat. Commun., 2020.
DOI: 10.1038/s41467-020-15927-0
https://doi.org/10.1038/s41467-020-15927-0
7. Science Advances: 生物無機(jī)雜合噬菌體可調(diào)節(jié)腸道菌群以重塑抗結(jié)直腸癌的腫瘤免疫微環(huán)境
越來越多的證據(jù)表明,腸道菌群有助于結(jié)直腸癌(CRC)的腫瘤發(fā)生,其中共生核酸核梭菌(Fn)選擇性地增加了免疫抑制的髓樣來源的抑制細(xì)胞(MDSC),以阻礙宿主的抗癌免疫反應(yīng)。于此,武漢大學(xué)張先正教授等人通過噬菌體展示技術(shù)篩選了一株特異性Fn結(jié)合的M13噬菌體。然后,將銀納米顆粒(AgNP)靜電組裝在其表面衣殼蛋白(M13@Ag)上,以實(shí)現(xiàn)Fn的特異性清除并重塑免疫腫瘤的微環(huán)境。
本文要點(diǎn):
1)體外和體內(nèi)研究均顯示,M13@Ag治療可清除腸道Fn,并導(dǎo)致腫瘤部位MDSC擴(kuò)增減少。
2)此外,抗原呈遞細(xì)胞(APC)被M13噬菌體激活,以進(jìn)一步喚醒宿主免疫系統(tǒng)以抑制CRC。M13@Ag與免疫檢查點(diǎn)抑制劑(α-PD1)或化學(xué)治療劑(FOLFIRI)的結(jié)合可顯著延長原位CRC模型小鼠的總體存活時(shí)間。
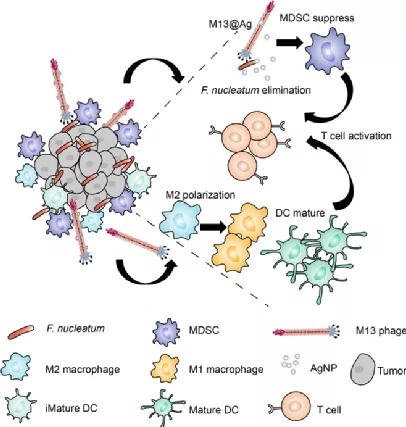
Dong X, et al. Bioinorganic hybrid bacteriophage for modulation of intestinal microbiota to remodel tumor-immune microenvironment against colorectal cancer. Science Advances. 2020;6(20):eaba1590.
https://advances.sciencemag.org/content/6/20/eaba1590
8. AFM:基于集成核殼納米顆粒的近紅外觸發(fā)級聯(lián)抗腫瘤免疫反應(yīng)
目前,抗腫瘤免疫治療的臨床應(yīng)用仍面臨著與療效相關(guān)的嚴(yán)峻挑戰(zhàn)。在此,武漢大學(xué)張先正等人設(shè)計(jì)了一種光觸發(fā)核殼納米系統(tǒng),旨在通過控制釋放抗PD-L1(αPD-L1)抗體和增強(qiáng)抗原提呈來增強(qiáng)抗腫瘤免疫反應(yīng)。
本文要點(diǎn):
1)以金納米棒(Au NRs)為光熱核,沸石咪唑框架-8(ZIF-8)為殼用于αPD-L1遞送,并進(jìn)一步聚乙二醇化構(gòu)建了納米系統(tǒng)--AZ-P@P。
2)在此納米系統(tǒng)中,ZIF-8外殼保護(hù)αPD-L1抗體免受復(fù)雜的生理環(huán)境和高溫的影響。一旦在腫瘤部位聚集,AZ-P@P在近紅外線(NIR)光觸發(fā)加熱下誘導(dǎo)腫瘤細(xì)胞死亡,釋放腫瘤衍生蛋白抗原(TDPAs)和三磷酸腺苷(ATP)。此后,釋放的ATP降解ZIF-8外殼,暴露出Au NRs,通過捕獲TDPA并將其轉(zhuǎn)運(yùn)到樹突狀細(xì)胞(DC)來促進(jìn)T細(xì)胞在腫瘤內(nèi)的浸潤。同時(shí),大量的αPD-L1在原位釋放,以恢復(fù)T細(xì)胞活性。
3)機(jī)制研究表明,AZ-P@P可促進(jìn)DC的成熟和活化T細(xì)胞的浸潤,從而誘導(dǎo)強(qiáng)大的抗腫瘤免疫。研究表明,近紅外光觸發(fā)的AZ-P@P能顯著破壞原發(fā)腫瘤,抑制轉(zhuǎn)移。
綜上所述,這種多重免疫調(diào)節(jié)系統(tǒng)為腫瘤治療提供了一種很有前途的工具。
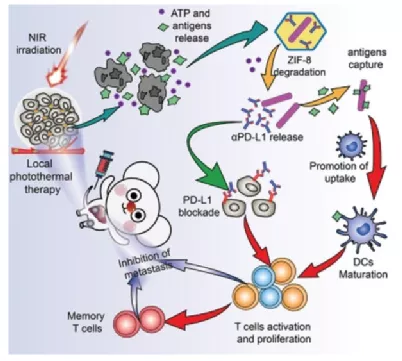
Qian Cheng, et al. Near‐Infrared Triggered Cascade of Antitumor Immune Responses Based on the Integrated Core–Shell Nanoparticle. Adv. Funct. Mater., 2020.
DOI: 10.1002/adfm.202000335
https://doi.org/10.1002/adfm.202000335
三、 光治療
9. Biomaterials:功能型COF用于重構(gòu)細(xì)胞外基質(zhì)以增強(qiáng)腫瘤光動(dòng)力治療
光動(dòng)力治療是一種很有前途的腫瘤治療方法。然而,大多數(shù)實(shí)體腫瘤的乏氧微環(huán)境都會阻礙PDT的療效。武漢大學(xué)曾旋和張先正教授合作制備了一個(gè)功能性的共價(jià)有機(jī)骨架(COF)結(jié)構(gòu),它可以通過重塑腫瘤細(xì)胞外基質(zhì)(ECM)來提高PDT的療效。實(shí)驗(yàn)將抗纖維化藥物吡非尼酮(PFD) 負(fù)載于以亞胺為基礎(chǔ)的COF (COFTTA-DHTA)中,并利用PLGA-PEG對其進(jìn)行修飾以得到PFD@COFTTA- DHTA@PLGA-PEG(PCPP)。在被靜脈注射后,PCPP可以在腫瘤部位積累并釋放PFD,使得ECM的HA和膠原蛋白I水平下調(diào),進(jìn)而有效改善腫瘤的乏氧微環(huán)境。此外,由PCPP介導(dǎo)的腫瘤ECM重構(gòu)也可增強(qiáng)隨后注射的原卟啉IX (PPIX)-共軛肽納米顆粒(NM-PPIX)的腫瘤攝取效果,并通過協(xié)同作用大大增強(qiáng)對體內(nèi)腫瘤的PDT效果。
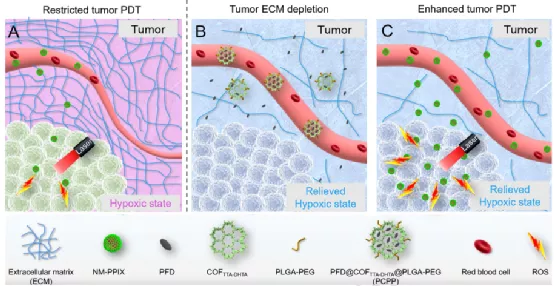
Shi-Bo Wang, Xuan Zeng, Xian-Zheng Zhang. et al. Remodeling extracellular matrix based on functional covalent organic framework to enhance tumor photodynamic therapy. Biomaterials. 2020
https://www.sciencedirect.com/science/article/pii/S0142961220300181
10. Biomaterials: AgNPs /卟啉MOF納米體系協(xié)同金屬離子療法和光動(dòng)力療法
基于金屬的治療劑已被廣泛研究用于疾病治療,但仍面臨脫靶和急性毒性等挑戰(zhàn),精確控制金屬離子的釋放成為迫切需要解決的問題。近日,武漢大學(xué)張先正教授課題組設(shè)計(jì)了一種通過近紅外(NIR)誘導(dǎo)的光動(dòng)力療法(PDT)控制氧化條件,實(shí)現(xiàn)按需激活和釋放金屬離子的納米體系(PAM),應(yīng)用于抗腫瘤和抗菌領(lǐng)域。
本文要點(diǎn)
1) 研究人員將銀納米顆粒(AgNPs)修飾到卟啉多孔配位網(wǎng)絡(luò)(PCN)上,并用具有炎癥靶向能力的中性粒細(xì)胞膜(NM)進(jìn)一步修飾,來構(gòu)建PAM。
2)PAM在沒有照射的情況下處于非活動(dòng)狀態(tài),不會對正常組織造成損害;然而,在腫瘤或受感染組織處照射近紅外輻射時(shí),PCN會局部產(chǎn)生單線態(tài)氧(1O2),使AgNPs部分降解以釋放出細(xì)胞毒性Ag+,以用于金屬離子治療(MIT)。Ag+的光控活化和釋放使納米體系在循環(huán)過程中具有生物惰性,并且毒性可以可控地恢復(fù),巧妙地避免了當(dāng)前金屬離子包載過程中不可避免的泄漏問題。
3)由于局部電場效應(yīng),摻入的AgNPs可以提高PCN產(chǎn)生1O2的效率。因此,在近紅外光的存在下,AgNPs輔助增強(qiáng)的光動(dòng)力療法與1O2活化的金屬離子治療之間協(xié)同相互作用,使PAM在體內(nèi)外均顯示出優(yōu)異的抗腫瘤和抗菌能力,且沒有明顯的副作用。
綜上,該研究設(shè)計(jì)的AgNPs /卟啉MOF納米體系,能夠協(xié)同利用金屬離子療法和光動(dòng)力療法,用于消除腫瘤和病原體。這種近紅外誘導(dǎo)的納米復(fù)合物為設(shè)計(jì)更多以安全、可控和有效地治療疾病的生物材料提供有意義的參考。
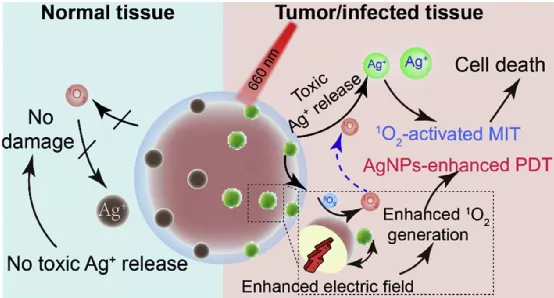
Lu Zhang et al. Near infrared light-triggered metal ion and photodynamic therapy based on AgNPs/porphyrinic MOFs for tumors and pathogens elimination. Biomaterials. 2020.
https://doi.org/10.1016/j.biomaterials.2020.120029
11.AM:腫瘤微環(huán)境引發(fā)的金屬-有機(jī)框架離子交換用于腫瘤的多模式成像和協(xié)同治療
集診斷功能和治療功能于一體的納米診療藥物(NTAs)在個(gè)體化治療方面具有巨大的潛力,但腫瘤特異性差嚴(yán)重制約了NTAs的進(jìn)一步臨床應(yīng)用。在此,武漢大學(xué)張先正等人報(bào)道了一種用于腫瘤組織原位合成NTA以增強(qiáng)腫瘤治療特異性的pro-NTA(納米診療藥物前體)激活策略。
本文要點(diǎn):
1)這種pro-NTA,也稱為PBAM,是由MIL-100(Fe)包覆的普魯士藍(lán)(PB)類似物(K2Mn[Fe(CN)6])組成的,在近紅外區(qū)的吸收和Mn2+離子的空間限制可以忽略不計(jì)。
2)在弱酸性腫瘤微環(huán)境(TME)中,PBAM可以被特異性地激活來合成光熱劑PB納米顆粒,由于內(nèi)部快速離子交換,釋放出游離的Mn2+離子,導(dǎo)致T1加權(quán)磁共振成像和光聲信號都處于“開啟”狀態(tài)。
3)此外,TME中Mn2+介導(dǎo)的化學(xué)動(dòng)力學(xué)療法和PB介導(dǎo)的光熱療法相結(jié)合,保證了比單一療法更有效的治療效果。
4)體內(nèi)實(shí)驗(yàn)數(shù)據(jù)進(jìn)一步表明,pro-NTA激活策略可以選擇性地使實(shí)體瘤變亮,并具有很高的特異性,可以檢測到看不見的淋巴結(jié)轉(zhuǎn)移。

Ying Chen, et al. Tumor‐Microenvironment‐Triggered Ion Exchange of a Metal–Organic Framework Hybrid for Multimodal Imaging and Synergistic Therapy of Tumors, Adv. Mater., 2020.
DOI: 10.1002/adma.202001452
https://doi.org/10.1002/adma.202001452
12. AFM:蛋黃-殼結(jié)構(gòu)納米材料誘導(dǎo)細(xì)胞內(nèi)氧化/熱應(yīng)激損傷以治療癌癥
腫瘤細(xì)胞因其獨(dú)特的代謝特點(diǎn),常表現(xiàn)出高水平的氧化還原穩(wěn)態(tài),這也有望作為腫瘤治療的一個(gè)可行靶點(diǎn)。武漢大學(xué)張先正教授和孫云霞副教授將液態(tài)金屬(LM)納米顆粒作為模板,設(shè)計(jì)了一種蛋黃-殼結(jié)構(gòu)的LM@ MnO2 (LMN),隨后利用該LMNs負(fù)載肉桂醛(CA)以形成 CLMN,并進(jìn)一步包覆透明質(zhì)酸(HA),以構(gòu)建可用于癌癥靶向治療的CA&LM@MnO2-HA納米花(CLMNF)。
本文要點(diǎn):
1)CLMNF顆粒可以迅速消耗谷胱甘肽(GSH)并產(chǎn)生錳離子,錳離子則能夠進(jìn)一步促進(jìn)過氧化氫轉(zhuǎn)化為羥基自由基(·OH)以殺滅癌細(xì)胞。并且隨著GSH的缺失,細(xì)胞內(nèi)氧化還原穩(wěn)態(tài)的平衡向氧化方向傾斜,導(dǎo)致CA引起的氧化損傷放大,最終導(dǎo)致癌細(xì)胞發(fā)生凋亡。
2)結(jié)合其具有的顯著近紅外(NIR)光熱轉(zhuǎn)換性能,該新型結(jié)構(gòu)CLMNF在體內(nèi)也對腫瘤表現(xiàn)出了良好的生長抑制作用,由此表明利用納米材料誘導(dǎo)癌細(xì)胞內(nèi)發(fā)生氧化/熱應(yīng)激損傷有望作為一種有新型高效的抗癌治療策略。
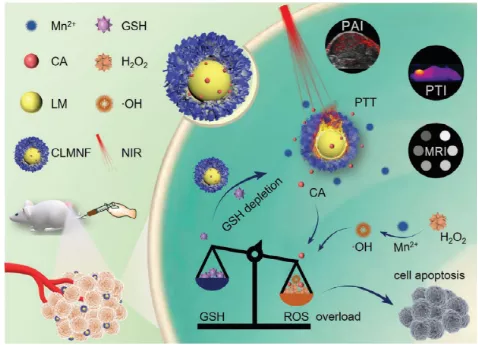
Miao-Deng Liu. et al. Yolk-Shell Structured Nanoflowers Induced Intracellular Oxidative/Thermal Stress Damage for Cancer Treatment. Advanced Functional Materials. 2020
DOI: 10.1002/adfm.202006098
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202006098
四、 藥物遞送
13. Angew:柔性-剛性混合相MOF結(jié)構(gòu)的構(gòu)建及其用于可控多藥遞送
多組分MOF材料包含多組獨(dú)特的層次性孔隙,具有多種功能性以實(shí)現(xiàn)多種應(yīng)用。武漢大學(xué)張先正教授構(gòu)建了一類具有精確排列結(jié)構(gòu)的柔性-剛性混合相MOFs,它具有獨(dú)特的棒狀體-八面體形貌。
本文要點(diǎn):
1)研究表明,構(gòu)建該混合型MOFs有兩個(gè)重要前提:一是兩種MOF之間的界面存在部分匹配的拓?fù)浣Y(jié)構(gòu),二是MOFs的結(jié)構(gòu)靈活性可以彌補(bǔ)晶格參數(shù)的差異。
2)此外,實(shí)驗(yàn)通過掃描透射電子顯微鏡能量色散x射線光譜元素映射觀察到,該混合相MOF可以有區(qū)域選擇性地負(fù)載多種分子,研究人員也這成功地將這一混合相MOF開發(fā)成為一種負(fù)載比可控、釋放動(dòng)力學(xué)可控的雙藥遞送系統(tǒng)。
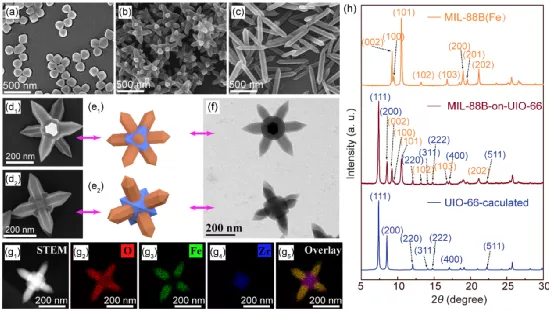
Xiao-Gang Wang. et al. Construction of Flexible-on-Rigid Hybrid-Phase Metal-Organic Frameworks (MOFs) for Controllable Multi-Drug Delivery. Angewandte Chemie International Edition. 2020
DOI: 10.1002/anie.202008858
https://onlinelibrary.wiley.com/doi/10.1002/anie.202008858
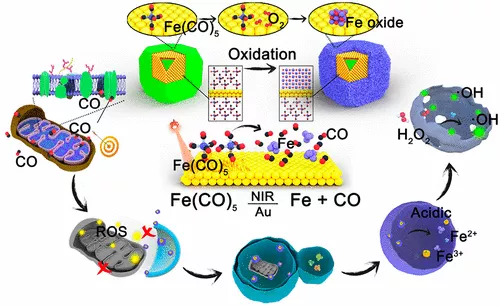
14. ACS Nano: 高穩(wěn)定性羰基鐵配合物納米給藥系統(tǒng)在腫瘤治療中的應(yīng)用
金屬羰基配合物在響應(yīng)活化刺激時(shí)能很容易地釋放一氧化碳(CO)。然而,由于金屬羰基配合物在潮濕和氧氣的自然環(huán)境條件下不穩(wěn)定,其適用性受到限制。在此,武漢大學(xué)張先正等人報(bào)道了一種用于改善癌癥治療的羰基鐵配合物納米遞送系統(tǒng)的合理設(shè)計(jì)。
本文要點(diǎn):
1)證明了五羰基鐵(Fe(CO)5)可以在無氧環(huán)境下被封裝到金納米籠中,然后在有氧條件下在金納米籠表面可控地形成氧化鐵。氧化鐵的形成有效地避免了籠狀Fe(CO)5的泄漏和氧化。
2)這種納米材料具有良好的安全性、生物相容性和穩(wěn)定性,可在近紅外(NIR)照射下于腫瘤環(huán)境中特異性活化產(chǎn)生CO和鐵。釋放的CO導(dǎo)致線粒體損傷,并引發(fā)自噬。
3)更重要的是,在自噬過程中,含有鐵和氧化鐵的納米材料會積累到自噬溶酶體中并導(dǎo)致自噬溶酶體的破壞。所產(chǎn)生的CO和鐵在癌細(xì)胞中有極好的協(xié)同作用。
Xiao-Shuang Wang, et al. Highly Stable Iron Carbonyl Complex Delivery Nanosystem for Improving Cancer Therapy, ACS Nano, 2020.
DOI: 10.1021/acsnano.0c02516
https://doi.org/10.1021/acsnano.0c02516
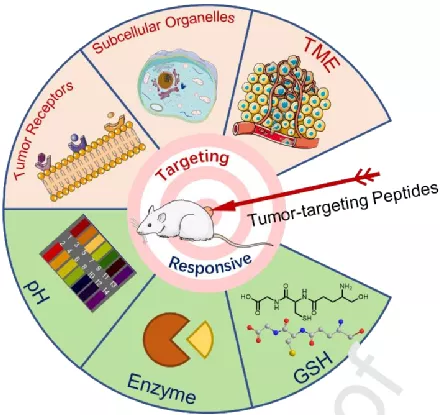
15.Adv. Drug. Deli. Rev:用于腫瘤治療的多功能多肽
武漢大學(xué)劉傳軍副教授和張先正教授對用于腫瘤治療的多功能多肽相關(guān)研究進(jìn)行了綜述。
本文要點(diǎn):
1)用于藥物遞送的納米系統(tǒng)可以根據(jù)實(shí)際需要將治療性藥物遞送到需要的位置。由于多肽具有多樣的生理功能,因此將多肽引入抗腫瘤納米系統(tǒng)可以實(shí)現(xiàn)二者的優(yōu)勢互補(bǔ),不僅能夠避免多肽在體內(nèi)的快速降解,而且也能提高納米系統(tǒng)的智能性和功能性。
2)作者在文中對具有靶向性和刺激響應(yīng)性的多功能多肽結(jié)構(gòu)進(jìn)行了介紹,并對近年來用于腫瘤治療領(lǐng)域的多肽基多功能納米材料進(jìn)行了綜述。
Ke Li. et al. Multifunctional Peptides for Tumor Therapy. Advanced Drug Delivery Reviews. 2020
https://www.sciencedirect.com/science/article/pii/S0169409X20301460
五、氣體治療
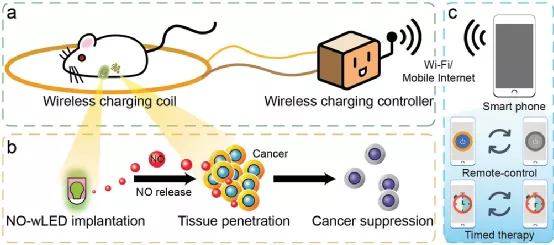
16. AM:腫瘤光穿透差?試試無線充電
傳統(tǒng)的光療法面臨著光穿透不足,難以到達(dá)深部病灶的問題,這大大降低了癌癥治療的可行性。于此,武漢大學(xué)張先正教授等人開發(fā)了一種可植入的一氧化氮(NO)釋放裝置,以實(shí)現(xiàn)對癌癥的長期、遠(yuǎn)距離、遠(yuǎn)程可控氣體治療。
本文要點(diǎn):
1)該裝置由一個(gè)無線供電的發(fā)光二極管(wLED)和用聚二甲基硅氧烷(PDMS)包裹的S-亞硝基谷胱甘肽組成,從而獲得NO釋放wLED(NO-wLED)。
2)研究發(fā)現(xiàn),無線充電可以觸發(fā)NO-wLED釋放NO,產(chǎn)生的NO濃度達(dá)到0.43×10-6 m min-1,這可以實(shí)現(xiàn)對癌細(xì)胞的殺傷作用。
3)體內(nèi)抗癌實(shí)驗(yàn)表明,當(dāng)植入的NO-wLED通過無線充電輻照時(shí),原位癌的生長表現(xiàn)出明顯的抑制作用。此外,手術(shù)后NO-wLED產(chǎn)生的NO可以預(yù)防癌癥的復(fù)發(fā)。
通過體內(nèi)照明,該策略克服了傳統(tǒng)光療法穿透力差、波長依賴性大的缺點(diǎn),這也為通過無線充電遠(yuǎn)程控制的體內(nèi)氣體療法提供了一種有前景的方法。
Li, B., et al., Nitric Oxide Release Device for Remote‐Controlled Cancer Therapy by Wireless Charging. Adv. Mater. 2020, 2000376.
https://doi.org/10.1002/adma.202000376
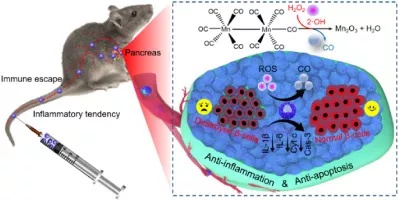
17.Biomaterials:仿生CO納米發(fā)生器用于I型糖尿病治療
糖尿病是一個(gè)日益嚴(yán)重的健康問題,并伴有嚴(yán)重影響患者生活質(zhì)量和生存的炎癥性并發(fā)癥。一氧化碳(CO)因其抗炎、抗凋亡等特性,已成為治療自身免疫性疾病的潛在治療分子。在此,武漢大學(xué)張先正、曾旋、Rong Lei等人構(gòu)建了一種基于介孔二氧化硅的仿生CO納米生成器(mMMn),用于I型糖尿病治療。
本文要點(diǎn):
1)此發(fā)生器負(fù)載有羰基錳(MnCO是一種CO分子前體藥,在H2O2和·OH等活性氧刺激下能釋放CO氣體),并用巨噬細(xì)胞膜進(jìn)行偽裝。在巨噬細(xì)胞膜主動(dòng)靶向炎癥部位的驅(qū)動(dòng)下,設(shè)計(jì)的mMMn可以有效地在I型糖尿病小鼠(連續(xù)給藥鏈脲佐菌素(STZ))胰腺組織中蓄積。
2)研究發(fā)現(xiàn),胰腺局部活性氧(ROS)可觸發(fā)mMMn持續(xù)釋放CO,通過減輕炎癥反應(yīng)和抑制β細(xì)胞凋亡,極大改善了糖尿病小鼠的血糖穩(wěn)態(tài)。綜上所述,外源性CO靶向胰腺組織為I型糖尿病的治療開辟了一條新的途徑。
Cheng Zhang, et al. Biomimetic carbon monoxide nanogenerator ameliorates streptozotocin induced type 1 diabetes in mice. Biomaterials, 2020.
DOI:10.1016/j.biomaterials.2020.119986
https://doi.org/10.1016/j.biomaterials.2020.119986
六、其他
18. Chem. Sci:分子雞尾酒策略用于細(xì)菌“指紋”檢測
越來越多的證據(jù)表明,微生物在調(diào)節(jié)人體健康和疾病方面起著至關(guān)重要的作用。因此,檢測微生物對于理解微生物與疾病的相互作用以及進(jìn)一步的疾病檢測是非常有意義的。武漢大學(xué)張先正教授開發(fā)了一種聯(lián)合代謝標(biāo)記策略,即通過具有紅、綠、藍(lán)(RGB)三種不同熒光的代謝物衍生物來識別不同的細(xì)菌種類和微生物群。
本文要點(diǎn):
1)與微生物共孵育后,這些熒光代謝物衍生物可與細(xì)菌結(jié)合,形成針對不同菌種、不同菌群的獨(dú)特真彩“指紋”。該研究還構(gòu)建了一種便攜式光譜儀,可用智能手機(jī)自動(dòng)進(jìn)行比色分析,以方便地識別不同的細(xì)菌種類和微生物群。
2)實(shí)驗(yàn)通過對皮膚感染、菌血癥等不同疾病小鼠的某些菌種和菌群的鑒定,驗(yàn)證了該策略的有效性;并通過對臨床患者和健康人唾液樣本的微生物菌群“指紋”進(jìn)行圖譜分析,證明了該策略能對口腔鱗癌、癌前的病變和健康狀態(tài)進(jìn)行準(zhǔn)確地區(qū)分。
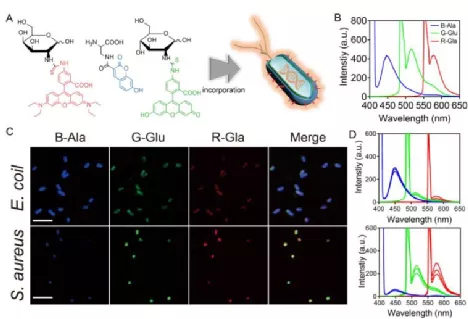
Sheng Hong. et al. RGB-Emitting Molecular Cocktail for the Detection of Bacterial Fingerprints. Chemical Science. 2020
https://pubs.rsc.org/en/content/articlelanding/2020/sc/d0sc01704c#!divAbstract
19.Biomaterials綜述:自由基用于癌癥治療
武漢大學(xué)張先正教授對自由基在癌癥治療領(lǐng)域中的應(yīng)用研究進(jìn)展進(jìn)行了綜述。
本文要點(diǎn):
1)自由基通常被認(rèn)為是一類具有高活性、短暫性和有害性的物種。事實(shí)上,也有一些自由基是不活躍,長壽并對人類健康有益的。由于具有這些獨(dú)特的性質(zhì),自由基在多個(gè)領(lǐng)域都有著廣泛的應(yīng)用。其中,得益于其開殼層的電子結(jié)構(gòu),自由基在生物醫(yī)學(xué)領(lǐng)域也有著獨(dú)特的優(yōu)勢,如高反應(yīng)性、光聲和光熱轉(zhuǎn)換能力和分子磁性等。
2)作者在文中綜述了近年來自由基在癌癥治療領(lǐng)域中的應(yīng)用研究進(jìn)展;介紹了一些能夠可控產(chǎn)生自由基的典型材料及其在光動(dòng)力治療(PDT)、化學(xué)動(dòng)力學(xué)治療(CDT)、聲動(dòng)力治療(SDT)、氣體治療、乏氧癌癥治療、光熱治療(PTT)、光聲成像(PAI)和磁共振成像(MRI)中的應(yīng)用實(shí)例。
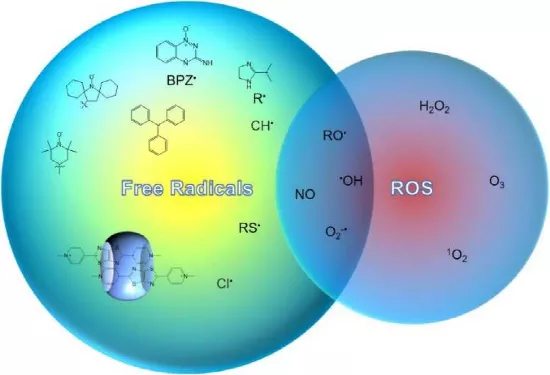
Xiao Qiang Wang. et al. Free Radicals for Cancer Theranostics. Biomaterials. 2020
https://www.sciencedirect.com/science/article/pii/S0142961220307201
此外,張先正團(tuán)隊(duì)2020年還發(fā)表了其他相關(guān)的高水平研究論文,由于篇幅關(guān)系就不在此一一展示,感興趣的讀者可前往該課題組網(wǎng)站進(jìn)行學(xué)習(xí)。
個(gè)人簡介:

張先正,男,出生于1971年8月,1994年于武漢大學(xué)獲學(xué)士學(xué)位,1997年于武漢大學(xué)獲碩士學(xué)位,2000年于武漢大學(xué)獲博士學(xué)位。2000年9月至2001年8月在新加坡材料研究所(IMRE)作ResearchAssociate。2001年9月至2004年9月在美國康奈爾大學(xué)(CornellUniversity)作博士后。自2004年9月起在武漢大學(xué)化學(xué)與分子科學(xué)學(xué)院高分子系任教授。
長期從事生物醫(yī)用高分子/多肽的研究,包括腫瘤診斷與治療、藥物傳遞、基因治療等,研究成果獲教育部自然科學(xué)一等獎(jiǎng)1項(xiàng)、二等獎(jiǎng)1項(xiàng)、湖北省自然科學(xué)一等獎(jiǎng)1項(xiàng)。已在Nat. Biomed. Eng.、Prog. Polym. Sci.、Nat. Commun.、Sci. Adv、Adv. Mater.、JACS、Angew. Chem. Int. Ed.、Nano Lett.、ACS Nano、Adv. Func. Mater.、Biomaterials、Small等期刊發(fā)表SCI論文500多篇,其中IF大于10的160多篇。論文SCI他引18000多次,H因子73。2015-2018年連續(xù)入選中國高被引學(xué)者榜單(材料科學(xué))。參與撰寫學(xué)術(shù)專著4部(共4章)。申報(bào)國內(nèi)外專利20余項(xiàng),部分專利已轉(zhuǎn)讓。
目前擔(dān)任武漢大學(xué)化學(xué)與分子科學(xué)學(xué)院副院長,生物醫(yī)用高分子材料教育部重點(diǎn)實(shí)驗(yàn)室主任,中國生物材料學(xué)會理事會常務(wù)理事,中國生物材料學(xué)會醫(yī)用高分子材料分會副主任委員,中國材料研究學(xué)會高分子材料與工程分會常務(wù)理事,中國化學(xué)會高分子學(xué)科委員會委員等。Materials Today Chemistry 主編、Materials Today、Molecular Pharmaceutics、中國科學(xué)-化學(xué)、高分子學(xué)報(bào)、化學(xué)學(xué)報(bào)、功能高分子、高分子材料科學(xué)與工程、膠體與聚合物等國內(nèi)外期刊編委等。











