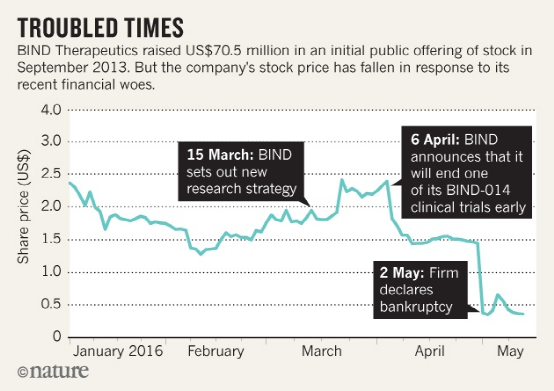
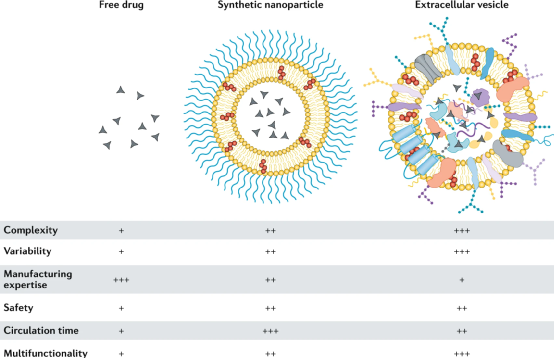
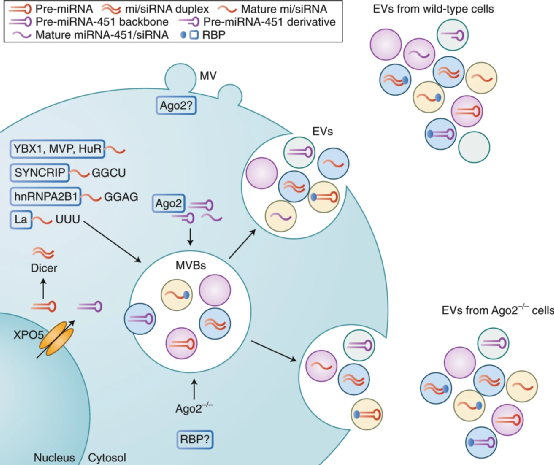
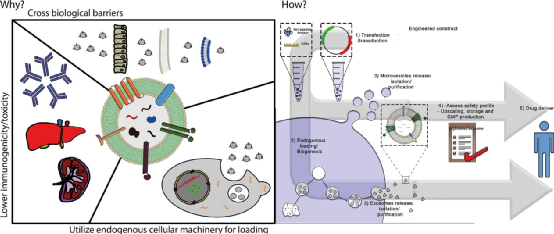
自20世紀90年代以來,合成納米顆粒被廣泛應用于臨床藥物遞送,納米遞送策略可以改善治療藥物在體內的空間和時間分布,從而減少副作用和或提高治療效果。通過優化納米載體的尺寸、形狀和表面性質,已經實現了更好的遞送。然而,復雜的分子靶向策略在臨床試驗中屢屢失敗;例如,BIND-014,一種具有表面配體的聚合物納米顆粒,它與富含腫瘤的前列腺特異性膜抗原(PSMA)結合。配體靶向納米給藥方法的臨床失敗部分歸因于納米顆粒與生物環境之間的復雜相互作用,包括形成一種蛋白質冠,可以掩蓋表面配體并觸發免疫識別。這種相互作用在臨床前研究中可能并不明顯,因為人和動物模型之間蛋白質冠的主要成分(例如補體蛋白)存在很大差異。此外,配體的類型、取向、密度和表面圖案對于優化遞送和與靶向分子的結合至關重要。因此,計算工具往往是必要的,以了解設計參數如何影響納米生物相互作用。市場上的大多數納米藥物都是簡單的脂質體,由多達兩種治療劑和多達四種脂質或類脂化合物組成,形成一個球形雙層。盡管脂質體在臨床上被用于遞送各種各樣的治療劑,包括小分子、肽和RNA,但是要實現納米遞送改善患者預后的真正潛力,還需要實施更復雜的多功能設計。藥物遞送系統的優化設計可能需要與生物環境相似的復雜程度,以便成功地穿過生物屏障。然而,目前尚不確定在合成納米給藥系統中成功整合多個功能成分是否能與具有成本效益和時間效益的臨床級制造工藝兼容。那么,如何能實現納米顆粒多功能化又極具有臨床潛力呢?近日,Nature Reviews Materials雜志發表了一篇評述文,討論了合成納米顆粒和細胞外囊泡用于藥物遞送的對比,細胞外囊泡結合自身優勢,有望成為納米醫學的一個臨床突破點。細胞外囊泡(EVs)是原核和真核細胞釋放的天然納米顆粒。EVs的大小,形狀和結構類似于脂質體,但具有更復雜的雙層結構,包含多達數百種不同的脂質、蛋白質和碳水化合物類型,以及內部貨物和與表面相關的分子。在各種病理生理過程中,EVs在短距離和長距離的細胞間通訊中起著重要作用。EVs將生物分子運輸到受體細胞的能力使其在藥物遞送方面具有吸引力。EVs可從培養細胞的條件培養基或生物組織或體液中獲得,并且各種方法(例如電穿孔,擠壓和超聲處理)已用于將治療劑裝載到EV中。通過開發用于體內分子貨物運輸的EVs結構的進化選擇,可以繞開納米醫學的多個設計和制造挑戰。然而,由于EV的分離和特性的挑戰,EVs在藥物傳遞方面的潛力仍然不確定,這阻礙了基礎研究和轉化研究。特別是EV類型之間的異質性以及其他具有重疊特性的生物納米顆粒的存在使得EV的分離變得困難。此外,在生物相容性和靶向給藥方面,在過早地將EVs描繪成優于合成納米顆粒的藥物載體時應謹慎。圖|游離藥物、臨床認可的合成納米顆粒和細胞外囊泡的特征納米醫學的挑戰是巨噬細胞介導的合成納米顆粒從循環中的肝快速清除。納米載體在肝臟中的螯合阻礙了特定部位的遞送機制,例如基于大小和形狀的納米載體靶向腫瘤。許多臨床上認可的合成納米顆粒已經用聚乙二醇(PEG)進行了功能化,從而減少了巨噬細胞的攝取,并將循環半衰期從數小時延長至數天。PEG的使用也有一些缺點,并且基于EV的藥物遞送已經被提出作為一種替代策略,以避免由于載體的固有性質而引起的免疫清除。然而,多項研究表明,全身注射的EV也會快速被肝臟清除,其循環半衰期只有幾分鐘。EV的分離、載藥和標記過程可能使EV更容易被巨噬細胞快速攝取。然而,一項對EV報告小鼠的研究表明,心臟EV主要在胸腺、睪丸、肺和腎臟中積聚,肝臟吸收較少,這表明在體內形成的天然EV可能經歷較少的肝臟清除。此外,EV的生物發生、細胞來源和生物分子組成對藥物動力學的影響尚不清楚。某些EV類型可能具有優越的循環半衰期和或超過肝臟清除率的位點特異性靶向機制。在適當的EV分離、鑒定和表征方面的實驗設計對于評估EVs作為藥物載體的潛力至關重要。與合成納米顆粒的直接比較常常被忽略;然而,這將允許在藥物毒性和療效方面確定EV遞送的益處。除了可能優于合成載體的生物分布特征外,基于EV的藥物遞送還有另一個好處:利用細胞過程進行藥物裝載和表面修飾的可能性。細胞可以通過基因工程來表達和包裝基于蛋白質和RNA的治療劑和或靶向配體。利用細胞機械進行藥物裝載和EV表面修飾是有利的,因為RNA和蛋白質在納米粒子合成過程中可能降解或受損。此外,EV內吞途徑或與受體細胞膜的融合事件可促進細胞內遞送,即將治療劑靶向特定的細胞內隔室或細胞器。在最近的一項研究中,通過基因工程使細胞在EVs中富集特異性小干擾RNA(siRNAs),與合成脂質納米載體相比,將siRNA的功能性傳遞給小鼠的效果提高了10倍以上。EV載體的優勢在于siRNA能夠逃逸溶酶體并定位于細胞質。值得注意的是,siRNA介導的敲除效率取決于EV來源和受體細胞類型。一些細胞類型,如常駐巨噬細胞,積累了高水平的EV遞送siRNA,但顯示出最小的靶基因敲除。這些結果表明,就生物分布和細胞內遞送而言,必須考慮EV異質性。圖自Nature BME(10.1038/s41551-019-0514-0)納米藥物通常比游離藥物產生更少的副作用,這是因為健康組織較少接觸治療劑,并且不需要有毒賦形劑溶解非水溶性小分子。事實上,一些納米藥物已經獲得了基于同等療效,但與自由給藥的小分子藥物相比,安全性有所提高的臨床批準。然而,臨床上批準的含有PEG的納米顆粒可以激活補體系統,在極少數情況下,會導致危及生命的超敏反應,通常可以通過降低輸注速率來緩解這種反應。以EV為基礎的治療方法尚未獲得臨床認可,但早期臨床試驗已經評估了自體樹突狀細胞衍生EV用于癌癥免疫治療和同種間充質干細胞衍生EV用于再生和抗炎應用的效果。這些試驗中的大多數報告了輕度到中度的副作用,一般認為EV給藥是安全的。同種異體的EV被認為是一種風險,因為它們可能引起受體的免疫反應。然而,血液和血漿中也含有高濃度的EVs(估計高達1010 EVs/ml),這些EVs從體內所有類型的細胞釋放到循環中。事實上,血漿和輸血很少引起不良免疫反應,這表明同種異體EV不太可能存在安全風險。然而,與自體EV相比,同種異體EVs的一個缺點可能是加速肝臟清除。此外,雖然臨床試驗的初步安全性結果是有希望的,但內源性藥物很難在不破壞EV結構的情況下清除,可能會引發不必要的影響。然而,內源性貨物也可能有助于添加劑或協同效應,特別是如果EVs是從細胞顯示治療性能,如間充質干細胞。圖自Adv. Drug Deliv. Rev. 159, 332–343 (2020).目前,有50多種臨床批準的納米藥物,它們都是基于包含少量成分的簡單設計。合成更復雜的納米顆粒,類似于具有數百種功能成分的生物結構,不太可能與大規模的臨床級制造兼容。EVs是實現多功能藥物載體潛力的一種很有前途的選擇。除了確定具有良好遞送性能的EVs外,還需要克服制造和擴大規模方面的挑戰,包括細胞培養的變異性。永生化細胞系的使用可以最大限度地減少變異性,但可能會帶來安全問題,因為永生化試劑可能會加載到EVs。血小板和紅細胞可能特別適合作為EV模擬物的來源,因為它們缺乏核物質,而核物質可能是免疫系統的危險信號。然而,與條件細胞培養基相比,EVs的成分更為復雜,因此從體液和組織中分離EVs具有挑戰性。對于某些應用,可能不需要高純度的EV制劑,如果去除輔因子,療效甚至可能下降。還有,只要預先確定的物理化學和效價試驗驗證批次間的一致性和有效性,其他生物成分的存在不一定是監管障礙。臨床試驗中常用超速離心(包括差速離心和密度離心)和切向流濾分離治療性ev。然而,大多數以EV為基礎的臨床試驗只涉及少數參與者,超速離心可能無法用于更大規模的研究和商業生產。此外,基于超速離心的過程可能導致EV損傷和聚集。切向流過濾與大規模生產相兼容,在保持EV結構的同時,實現了體積減小和部分凈化。純化后,EVs可以通過裝載治療劑(臨床級方案已被報道)或以“兩全其美”的方法與合成納米顆粒融合來進一步工程化。大多數臨床試驗使用生理鹽水或蔗糖冷凍保護劑緩沖液在-80°C下儲存EV。或者,凍干可能適用于某些EV貨物和功能,并允許簡化儲存、分配和護理點重建。合成納米醫學和EV領域之間合作的增加,可能會推動新興EV生物學與數十年來在合成藥物遞送的臨床失敗和成功方面的專業知識的成功整合。Witwer, K.W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater (2021). https://doi.org/10.1038/s41578-020-00277-6