奇物論聯合納米人編輯部對2020年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是Biophysics Reports 和Biomaterials副主編、國家納米科學中心梁興杰研究員課題組。

梁興杰課題組研究如何發展生物材料,利用納米技術提高小分子化合物和生物大分子生物利用度的分子和細胞生物學機制,并探索新型納米結構促進重大惡性疾病的藥物療效和臨床治療的方法;
基于對納米載藥顆粒的獨特生物物理化學過程以及相關生物功能的理解,該課題組正在探尋通過提高藥物分子的輸運效率來達到顯著改善治療效果或者預防癌癥和艾滋病的納米生物技術,利用生物響應型納米材料在細胞和組織水平提高藥物安全性和治療效果。作為通訊作者在國際一流期刊Nature Nanotechnology、Accounts of Chemical Research、PNAS、Advanced Materials、ACS Nano、Nano Lett、Cancer Research、Biomaterials等發表論文250余篇.
研究方向:納米藥物的設計合成、結構優化和功能測定及其臨床應用中的生物機制。

下面,我們簡要總結了梁興杰研究員課題組2020年部分研究成果,供大家交流學習。
以下內容分為三個方面展開:
Part Ⅰ 生物響應型納米材料
Part Ⅱ 光學治療
Part Ⅲ 其他
一、生物響應型納米材料
1. Nature Nanotech.: 納米界變形金剛,用于癌癥免疫治療!
高效抗腫瘤疫苗的開發,特別是可以有效誘導人類T細胞啟動的個性化疫苗,在目前仍然是一項難以攻克的挑戰。鑒于此,國家納米科學中心梁興杰和清華大學李景虹院士等人報告了一種基于質子驅動納米變形的疫苗(NTV),用于癌癥免疫治療。
該疫苗包括基于聚合物-肽結合物的納米變形器和負載的抗原肽(AP)。在酸性內體環境中,基于納米變形器的疫苗經歷了從納米球(直徑約100 nm)到納米片(長度或寬度幾微米)的劇烈形態變化,從而機械破壞了內體膜并將抗原性肽直接遞送至細胞質,并經過激活NLRP3炎性體途徑激活免疫系統,進而誘導強大而安全的抗腫瘤免疫力。
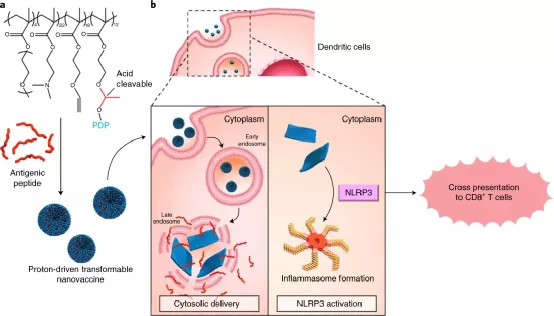
Gong, N., et al. Proton-driven transformable nanovaccine for cancer immunotherapy. Nat. Nanotechnol. (2020).
https://doi.org/10.1038/s41565-020-00782-3
2. Theranostics:貴金屬納米材料在體內外誘導產生的生物適應性變化
國家納米科學中心馬曉溦助理研究員和梁興杰研究員對貴金屬納米材料在體內外誘導的適應性變化相關研究進行了綜述
本文要點:
(1)貴金屬納米材料(NMNs)的獨特特性使其在治療學、診斷學和生物成像領域有著廣泛的應用前景。隨著NMNs的應用逐漸普及, NMNs暴露和存在于組織器官中的可能性也更大,因此需要對其體內外的生物學效應進行細致的研究。當有NMNs存在后,組織和細胞往往會在形態和功能上發生一系列適應性變化。在細胞水平上,溶酶體、內質網、高爾基體、線粒體、細胞核等亞細胞器內積累想NMNs會干擾其功能,導致消化、蛋白質合成與分泌、能量代謝、線粒體呼吸、增殖等多種細胞功能發生改變。在動物水平上,代謝器官、呼吸器官、免疫相關器官和其他器官中的NMNs也會可引起這些器官發生顯著的生理和病理變化,并影響其功能。由此可見,研究NMNs與組織和細胞之間的相互作用及其潛在機制對其未來的應用推廣來說至關重要。
(2)作者在文章詳細說明了NMNs誘導的生物體內外發生的適應性變化;討論了如何設計NMNs以最大化有益的適應性變化同時避免不利的變化,為正確利用這些NMNs提供了重要的參考。
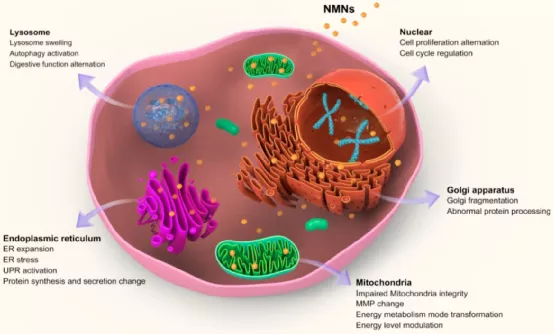
Qianqian Huang. et al. Adaptive changes induced by noble-metal nanostructures in vitro and in vivo. Theranostics. 2020
DOI: 10.7150/thno.42569
https://www.thno.org/v10p5649.htm
二、光學治療
3. AM:雙響應型Pt(IV)/Ru(II)雙金屬聚合物的抗耐藥腫瘤研究
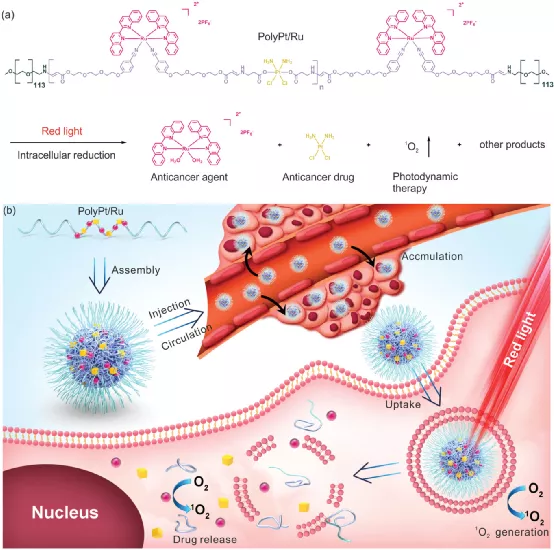
耐藥性是癌癥治療中的一個主要問題。在此,中國科學技術大學吳思、國家納米科學中心梁興杰等人設計了一種雙響應型Pt(IV)/Ru(II)雙金屬聚合物(PolyPt/Ru),以治療患者源性異種移植(PDX)模型中的順鉑耐藥腫瘤。
本文要點:
1)PolyPt/Ru是一種兩親性ABA型三嵌段共聚物。親水性A嵌段由生物相容性聚乙二醇(PEG)組成。疏水性B段含有還原響應型Pt(IV)和紅光響應型Ru(II)部分。PolyPt/Ru自組裝成納米粒子,能有效地被順鉑耐藥癌細胞攝取。
2)用紅光照射含有PolyPt/Ru納米粒子的癌細胞產生1O2,誘導聚合物降解,并觸發Ru(II)抗癌劑的釋放。同時,抗癌藥物順鉑通過Pt(IV)部分的還原在細胞內環境中釋放。釋放的Ru(II)抗癌劑、順鉑和生成的1O2具有不同的抗癌機制,它們的協同作用抑制耐藥癌細胞的生長。
3)此外,在PDX小鼠模型中,PolyPt/Ru納米粒子能抑制腫瘤生長,因為它們在血液中循環,在腫瘤部位聚集,表現出良好的生物相容性,并且不會引起副作用。
綜上所述,刺激響應型多金屬聚合物的開發為克服耐藥性提供了新策略。
Xiaolong Zeng, et al. Fighting against Drug‐Resistant Tumors using a Dual‐Responsive Pt(IV)/Ru(II) Bimetallic Polymer. Adv. Mater., 2020.
DOI: 10.1002/adma.202004766
https://doi.org/10.1002/adma.202004766
4. ACS Nano:NIR輻射誘導的溫和熱療促進GSH耗竭和DNA鏈間交聯形成以實現高效化療
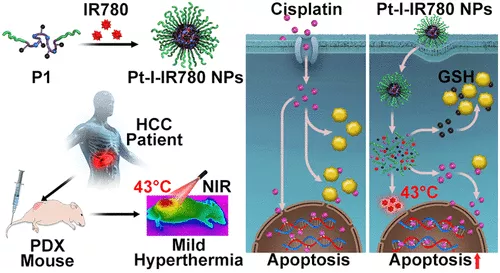
DNA烷化劑通常通過與DNA共價結合形成鏈間或鏈內交聯來殺死腫瘤細胞。然而,就順鉑而言,只有很少的DNA加合物(<1%)是毒性很強的、不可修復的鏈間交聯。此外,順鉑可被高水平的細胞內硫醇如谷胱甘肽(gsh)迅速解毒。自其作用機制被發現以來,人們一直在尋找直接有效地清除細胞內gsh和增加鏈間交聯以提高藥效和克服耐藥性的方法,但至今未見突破性進展。在此,< span="">中科院化學研究所肖海華、Yingjie Yu,國家納米科學中心梁興杰,北京理工大學武欽佩等人假設順鉑的抗癌效率可以通過碘硫醇點擊化學介導的GSH耗竭和通過近紅外光觸發的溫和熱療來增加DNA鏈間交聯來增強。
本文要點:
1)通過制備具有鉑(IV)(Pt(IV))前藥和懸垂碘原子(碘化物)的兩親性聚合物來實現這一目標。將該聚合物進一步用于包裹IR780,組裝成Pt-I-IR780納米粒子。
2)近紅外線照射誘導腫瘤部位亞高溫(43°C)有三種作用:(a)加速GSH介導的聚合物主鏈中Pt(IV)還原為Pt(II);(b)促進GSH與碘化物之間的碘硫醇取代點擊反應,從而減弱GSH介導的順鉑的解毒作用;(c)增加了高毒性和不可修復的Pt-DNA鏈間交聯比例。
綜上所述,通過近紅外輻射誘導的溫和熱療可以增強對癌細胞的殺傷作用,減輕腫瘤負擔,從而實現高效化療。
Jimei Zhang, et al. Near-Infrared Light Irradiation Induced Mild Hyperthermia Enhances Glutathione Depletion and DNA Interstrand Cross-Link Formation for Efficient Chemotherapy. ACS Nano, 2020.
DOI: 10.1021/acsnano.0c03781
https://doi.org/10.1021/acsnano.0c03781
5. Biomaterials:光激活的脂質體用于藥物的按需釋放以治療乏氧腫瘤
刺激響應型納米藥物具有可重復的藥物按需釋放特性。南方醫科大學喻志強教授、于夢教授和國家納米科學中心梁興杰研究員將Ce6和四價鉑前藥(Pt(IV))相結合,設計了一種光激活的脂質體Pt/Ce6-LP。
本文要點:
(1)該多功能系統可以利用不飽和磷脂以實現可重復的藥物按需釋放,并對乏氧腫瘤具有化學-光動力學治療作用和免疫增強的效果。在光動力治療(PDT)中,由于Pt(IV)前藥會向Pt(II)轉化并消耗谷胱甘肽(GSH),因此它能夠避免GSH對活性氧(ROS)的抵消作用。并且,這種正反饋環也可以改變腫瘤中H2O2和GSH的氧化還原平衡,進而緩解乏氧的腫瘤微環境。
(2)研究發現,改善乏氧能夠有效增強PDT的療效、逆轉腫瘤對順鉑的耐藥性以及使得腫瘤相關巨噬細胞(TAMs)向具有免疫活性的M1型轉變。在肝癌患者源性的異種移植瘤模型中,Pt/Ce6-LP也表現出了顯著的抗腫瘤效果和持續治療后抑制作用。

Yuanyuan Yang. et al. Light-activatable Liposomes for Repetitive On-demand Drug Release and Immunopotentiation in Hypoxic Tumor Therapy. Biomaterials. 2020
https://www.sciencedirect.com/science/article/pii/S014296122030702X
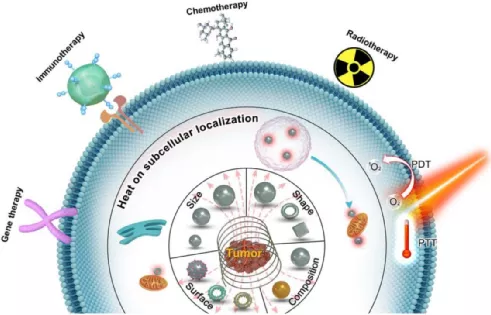
6. Theranostics:利用磁熱治療以增強抗腫瘤治療效果
磁熱治療(MH)作為腫瘤局部治療的一種新方法已被用于臨床。MH是利用磁性納米顆粒(MNPs)在交變磁場(AMF)作用下產生的熱量來殺死腫瘤細胞。由于其具有較高的生物安全性、較好的組織穿透深度、可進行靶向選擇性殺傷等諸多優點,已成為目前納米醫學領域的一個重要研究課題。然而,MH也面臨著諸多重大的挑戰。而提高MNPs的熱轉化效率則是提高其療效的根本策略。西北大學樊海明教授和國家納米科學中心梁興杰研究員合作對目前提高MNPs-MH抗腫瘤療效的有效策略進行了綜述討論。
本文要點:
(1)首先對工程化MNPs的尺寸、組成、形狀和表面等方面的最新研究進展進行了綜述,并介紹了局部熱療對選擇性破壞細胞或胞內結構的影響。
(2)回顧了MH療法與化療、放療、免疫治療、光熱/光動力治療(PDT)和基因治療相結合以提高治療效果的研究;最后闡述了基于MH的抗腫瘤治療的前景和面臨的重大挑戰,從而為今后MPS-MH在臨床醫學上的成功應用提供重要參考。
Xiaoli Liu. et al. Comprehensive understanding of magnetic hyperthermia for improving antitumor therapeutic efficacy. Theranostics. 2020
DOI: 10.7150/thno.40805
https://www.thno.org/v10p3793.htm
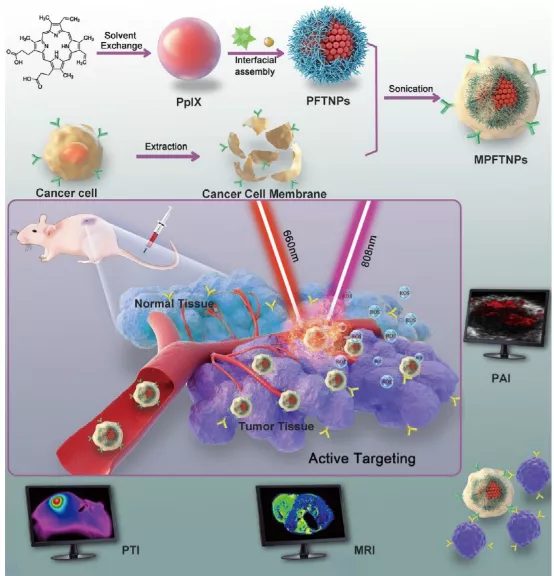
7. ACS Nano:具有穩定的光熱性能的人工納米靶細胞,用于多模式成像引導的腫瘤特異性治療
有機-無機雜化材料以其綠色合成、疏水性藥物載量高、輕易地摻入診療試劑鐵、光熱效率高而不含惰性組分或添加劑等優點,在腫瘤治療中受到越來越多的關注。于此,重慶醫科大學附屬第二醫院王志剛、國家納米中心梁興杰等人提出了一種仿生工程介導的增強腫瘤微環境光熱性能的策略。
本文要點:
1)該策略基于有機-無機雜化材料的特定特征,并使這些材料在TME中具有同源的靶向能力和光熱穩定性。雜化材料發揮癌細胞的功能,靶向同源性腫瘤(充當“人工納米靶細胞(ANTC)”)。
2)受鞣酸(TA)和三價鐵離子(FeIII)依賴于pH的分解行為以及隨后光熱性能減弱的啟發,癌細胞膜被自沉積在原卟啉包封的TA和FeIII納米顆粒表面,從而用TME實現ANTC穩定的光熱性能和腫瘤特異性光療。
3)所得的ANTC可以用作同時光聲成像,磁共振成像和光熱成像的造影劑,以指導治療。重要的是,原卟啉的高負載效率使得能夠啟動光動力療法以增強光熱療法的效率,從而提供具有最小副作用的抗腫瘤功能。
Bin Qiao, et al., Artificial Nanotargeted Cells with Stable Photothermal Performance for Multimodal Imaging-Guided Tumor-Specific Therapy. ACS Nano 2020.
DOI: 10.1021/acsnano.0c00771
https://pubs.acs.org/doi/abs/10.1021/acsnano.0c00771
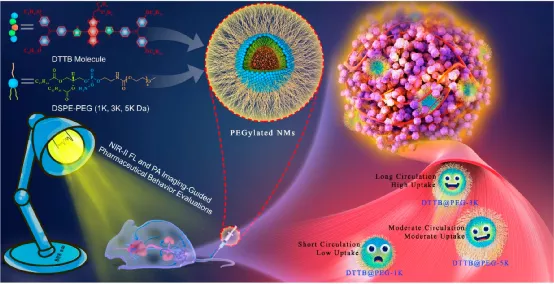
8. ACS Nano:用于腫瘤光熱消融的近紅外II熒光納米藥物結合聚乙二醇配體的體內實時藥物評價
納米藥物的藥物評估對于將其進一步推向工業和臨床領域具有重要意義。近紅外(NIR)熒光成像通過深入了解具有深層組織穿透力和高時空分辨率的體內藥物的生物分布,在臨床前藥物開發中起著至關重要的作用。但是,NIR-II熒光成像很少用于納米藥物的體內實時藥物評估。于此,國家納米科學中心梁興杰、廣州醫科大學郭偉圣等人開發了一種高發射率的NIR-II發光體,以建立通用的納米平臺,以無創方式實時監測結合各種聚乙二醇(PEG)配體的納米藥物的體內代謝。
合成了另一種D–A–D共軛低聚物(DTTB),以實現在約1050 nm處達到峰值的NIR-II發射,其高熒光QY為13.4%,吸收系數大。通過與DTTB分子錨定,制備了固有的熒光膠束,并與各種鏈長的PEG配體結合。體內NIR-II熒光和光聲成像結果表明,適當的PEG鏈長可以有效促進更長的血液循環和更好的腫瘤靶向。體內治療實驗也證實了優化的納米藥物具有有效的光熱消除腫瘤和良好的生物安全性。這項工作提供了一種替代的高熒光NIR-II材料,并展示了一種在體內對納米藥物進行實時藥物評估的有前途的方法。
Shengliang Li, et al., In Vivo Real-Time Pharmaceutical Evaluations of Near-Infrared II Fluorescent Nanomedicine Bound Polyethylene Glycol Ligands for Tumor Photothermal Ablation. ACS Nano 2020.
https://doi.org/10.1021/acsnano.0c05885
三、其他
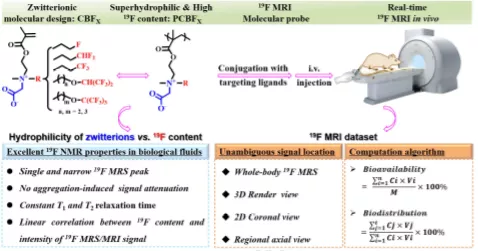
9. Biomaterials:超親水氟化聚合物和納米凝膠用于高性能19F MRI
19F磁共振成像(19F MRI)是一種無內源性背景信號的非侵入性、無放射性診斷技術,為精確的分子成像研究開辟了新的研究途徑。然而,19F MRI在很大程度上受到造影劑性能的限制。在此,中國醫學科學院生物醫學工程研究所Huang Pingsheng、王偉偉,國家納米科學中心梁興杰等人首次提出了兩性氟化聚合物和納米凝膠作為新型超親水、靈敏和超穩定的19F磁共振造影劑。
本文要點:
1)羧基甜菜堿兩性離子結構的超親水性完全克服了兩親性含氟聚合物納米探針的疏水聚集引起的信號衰減。
2)此外,該超親水造影劑具有19F-含量高(19.1wt%)、抗蛋白質吸附能力強、MR性質穩定、可在復雜生物體液中進行19F-MRS定量測定、靜脈注射后全身圖像中19F-?信號強等顯著優點。
3)結合血管生成靶向配體,將超親水造影劑應用于腫瘤的明確檢測。建立了從活體19F MRI數據集中直接定量測定生物利用度和腫瘤與全身比值(TBR)的計算算法,以非侵入性的方式提供實時信息。
4)交聯納米凝膠具有顯著延長的體循環,其中強烈的19F MRI信號非特異性地分布在腹主動脈和富含血液的器官中,而不是像最先進的超疏水全氟碳納米乳液那樣穩定地滯留在肝臟中。
綜上所述,這種超親水、兩性氟化聚合物和納米凝膠可以被定義為新一代高性能的19F磁共振造影劑,在基于圖像的明確疾病檢測和計算量化方面具有巨大的潛力。
Zujian Feng, et al. Superhydrophilic fluorinated polymer and nanogel for high-performance 19F magnetic resonance imaging. Biomaterials, 2020.
DOI: 10.1016/j.biomaterials.2020.120184
https://doi.org/10.1016/j.biomaterials.2020.120184
10. Nano Lett.:一種模塊化地塞米松納米前藥用于低毒、高效治療類風濕性關節炎
考慮到物理封裝的有效載荷具有藥物突釋和/或低載藥量,啟動創新的前藥策略以優化模塊化納米藥物的設計是至關重要的。在此,國家納米科學中心梁興杰、南開大學郭術濤等人設計了模塊化的pH敏感型地塞米松丙酮基縮酮連接前藥(AKP-dexs),并將其制成納米粒子。
本文要點:
1)報道了模塊化地塞米松AKPs(AKP-dexs)的合理設計和簡便合成,以及用于治療類風濕性關節炎(RA)的pH敏感、高負載的AKP-dexs納米粒子的制備。
2)綜合研究了AKP-dex結構與性質的關系,并根據其大小、載藥量和膠體穩定性選擇了兩種類型的AKP-dex納米粒子進行體內研究。在膠原誘導的關節炎大鼠模型中,這些AKP-dex納米粒子在炎癥關節中的積聚更高,治療效果比游離的地塞米松磷酸鹽更好,副作用更輕。
3)負載AKP-dex的納米粒子可能用于治療其他炎癥性疾病,因此具有很大的轉化潛力。該發現代表了開發丙酮基縮酮連接前藥實際應用的重要一步,對模塊化納米藥物的設計具有重要意義。
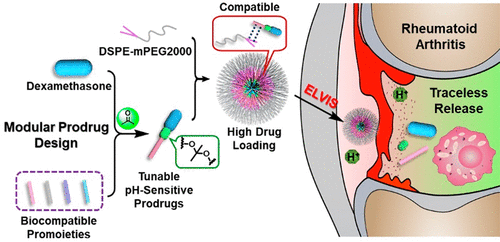
Yang Xu, et al. Modular Acid-Activatable Acetone-Based Ketal-Linked Nanomedicine by Dexamethasone Prodrugs for Enhanced Anti-Rheumatoid Arthritis with Low Side Effects, Nano Lett., 2020.
DOI: 10.1021/acs.nanolett.9b05340
https://doi.org/10.1021/acs.nanolett.9b05340
此外,梁興杰研究員課題組還有其他一些研究成果由于篇幅原因不在此一一列舉,有興趣的讀者可前往谷歌學術的網頁進行學習:
https://scholar.google.com.hk/citations?hl=zh-CN&user=vXQmsKUAAAAJ
個人簡介

梁興杰,中科院納米科學卓越中心納米藥物組負責人,國家納米科學中心研究員,博士生導師,享受國務院特殊津貼。2008年入選中科院“百人計劃”加入國家納米科學中心,現為中國科學院納米生物效應與安全性重點實驗室副主任,中國生物物理學會會員,中國藥學會高級會員, 《Biophysics Reports》 和《Biomaterials》 副主編,《ACS Nano》 顧問委員會編委,《Current Nanoscience》,《Advanced in Nano Research》,《Journal of Nanomaterials》,《Theranostics》和《Biomaterials Research》等雜志編委及《Biotechnology Advances》雜志客座編委。
中美納米醫學和腫瘤治療會議主席,納米生物醫藥專業委員會專家組副主任,中國藥學會藥物制劑專委會委員,中國材料學會納米生物材料分會常務副主任,中科院重大先導計劃A類納米化藥物創制技術項目負責人,國家“納米科學”重大計劃研究專項(納米973計劃)項目首席科學家;2004、2005、2006 連續三年獲得NIH優秀科研獎("Fellows Award for Research Excellence");2010獲得國務院政府有突出貢獻專家(自然科學類),2012年獲得中國藥學會青年藥物學家獎,2013年獲得中國科學院百人計劃優秀獎,2014年獲得國家質量監督檢驗檢疫總局“科技興檢獎”,2015年河北省科學技術獎(自然科學類),2015年中國科學院-BHHB(必和必拓)導師科研獎,2016 年度中科院-沙特基礎工業公司(SABIC-CAS)導師科研獎。











