
第一作者:Ting Li, Xinpeng Cheng
通訊作者:張立明、錢鵬程
通訊作者單位:加州大學圣巴巴拉分校、溫州大學
主要內容
對惰性炔丙基進行C-H鍵活化同醛進行一步不對稱加成反應,是一種原子經濟性的構建手性高丙炔醇的可行方法,但是目前仍未見諸報道。有鑒于此,加州大學圣巴巴拉分校張立明、溫州大學錢鵬程等報道了在溫和條件中的分子內轉化實現合成手性炔丙基修飾的醇。該反應通過Au催化劑在手性雙功能磷配體,該雙功能膦配體通過三級有機胺(pKa≈10),對分子的炔丙基C-H鍵(pKa>30)進行活化,底物分子中同時存在酸性醛的α-H(pKa≈17)。
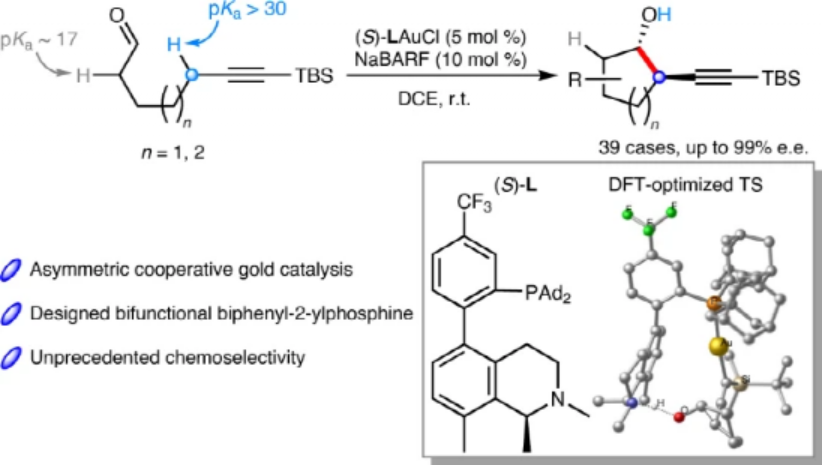
圖1. Au(I)催化分子內炔丙基C-H鍵活化合成手性醇
該反應具有廣泛的底物和官能團兼容性,能夠以優異的對映選擇性和反式選擇性合成連接到環戊烷/環己烷上的均炔丙基醇,對底物中含有、不含有手性位點都展示了反應活性。通過DFT計算對反應機理進行研究,通過能量變化計算、反應立體選擇性確立了金屬-配體協同催化作用。
傳統的醛不對稱炔丙醇化反應的缺點
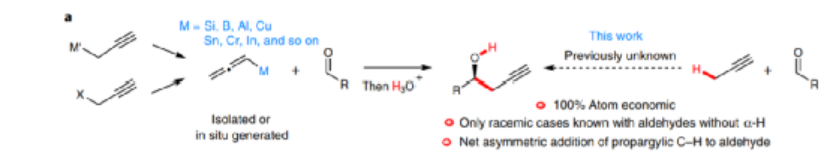
圖2. 傳統反應方法學中的挑戰
醛進行不對稱炔丙醇化能夠生成各種手性烯丙基醇物種,該反應過程在有機化學領域非常重要,通常在此類不對稱合成過程中,需要結合到Si, B, Al, Cu, Sn, Cr, In等金屬/非金屬炔丙基結構作為炔丙基親核試劑,通過原位產生或者直接作為原料參與炔丙醇化反應過程。
挑戰
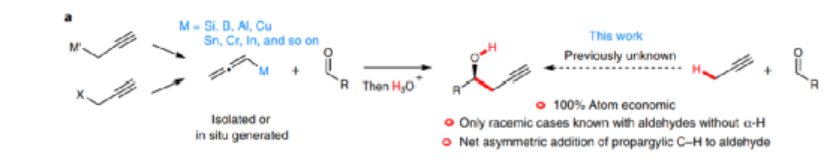
圖3. 反應方法學中的挑戰
與這種傳統方法相比,直接在炔丙基C-H鍵對羰基加成是一種原子經濟性方法,能夠避免消耗化學計量比的金屬或底物,避免生成化學計量比金屬鹽廢物。同時能夠通過連續的脫質子-炔丙基化-質子化催化反應過程進行反應。然而,這種催化反應在目前的相關文獻中并未有所報道。目前的相關報道中,僅僅能夠實現非手性選擇性的過程進行,而且無法兼容醛底物中含有α-C(sp3)-H鍵的分子。這種底物中在概念上通過正常的堿性催化無法實現,因為炔丙基位點的質子酸性(pKa>30)低于醛基α-H(pKa≈17)的酸性,因此該反應更容易通過自羥醛縮合反應過程進行。
反應方法學發展
2018年,作者通過Au(I)催化方法,實現了炔丙基C-H鍵、醛之間的炔丙基化反應。
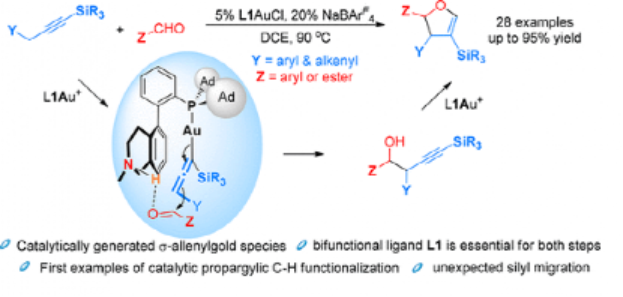
圖4. Ting Li and Liming Zhang*, J. Am. Chem. Soc. 2018, 140, 50, 17439–17443
在此基礎上,作者進一步的發展了該方法學,通過對有機手性雙官能團化配體進行發展,實現了優異的對映手性選擇性、立體選擇性進行非活化炔丙基C-H鍵和醛的加成,而且對含有α-C(sp3)-H鍵的醛底物兼容。
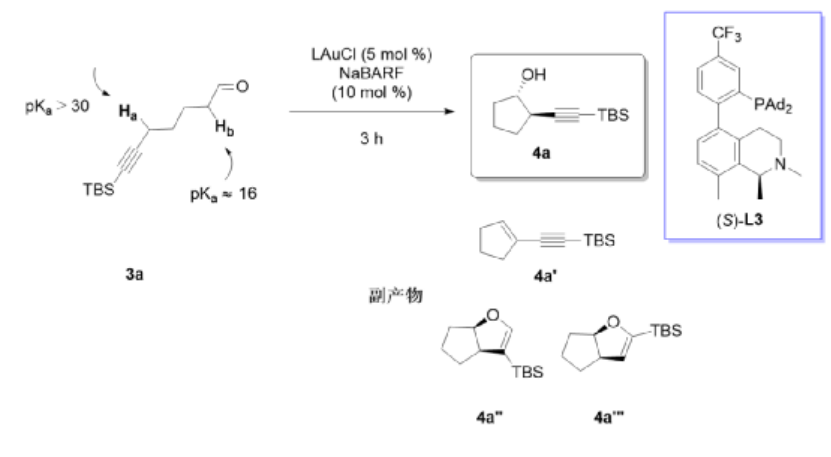
圖5. 反應實施
以TBS保護的6-庚醛炔(3a)作為反應底物,以LAuCl作為催化劑,加入10 mol % NaBARF(四(3,5-二(三氟甲基)苯基)硼酸鈉)添加劑,在室溫中DCE溶劑中反應3 h,優化反應配體,當配體為三氟甲苯基修飾的修飾環己基四氫喹啉手性配體(S)-L3作為與Au(I)進行配合的催化劑體系,實現了77 %的產率、99 %的對映選擇性。同時三種副反應產物(4a', 4a'',4a''')的選擇性都非常低(0/<3%/<3%)。
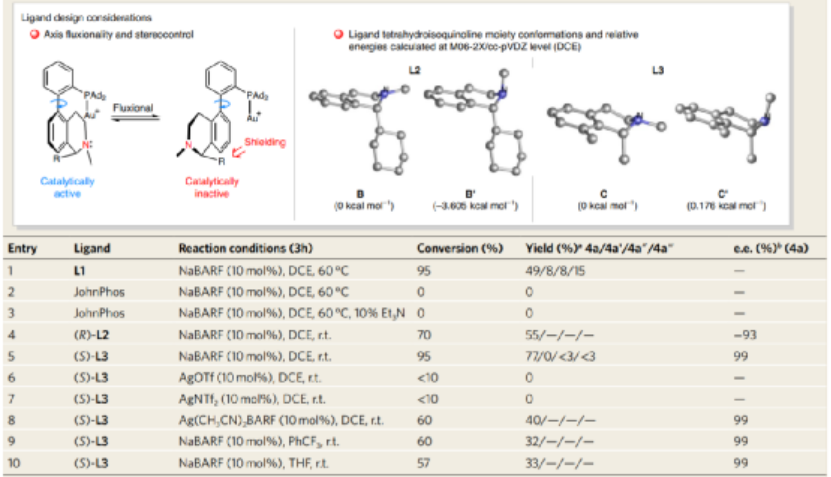
圖6. 反應優化
底物種類
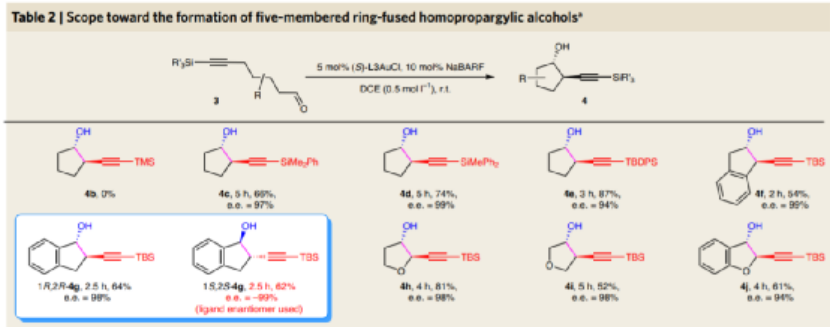
圖7. 底物兼容性(部分)(I)
圖8. 底物兼容性(部分)(II)
對炔丙基底物中的保護劑進行測試,發現當將TBS替換為體積較小的TBS,產物中目標產物的選擇性基本上消失。當將TBS替換為體積較大的SiMe2Ph、SiMePh2、TBDPS,該反應同樣能夠很好的進行(當選擇TBDPS,反應中的對映選擇性ee稍微有所降低)。該反應兼容修飾苯環的底物種類,能夠以中等收率和較高的對映選擇性進行反應。當底物中骨架中含有氧原子,反應同樣能夠很好的進行,能夠兼容電子、立體結構變化的底物。
類似的,該方法學能夠以類似五元環合成過程生成六元環手性炔丙基產物。
參考文獻:
Li, T., Cheng, X., Qian, P. et al. Gold-catalysed asymmetric net addition of unactivated propargylic C–H bonds to tethered aldehydes. Nat Catal 4, 164–171 (2021).
DOI: 10.1038/s41929-020-00569-8
https://www.nature.com/articles/s41929-020-00569-8











