具有多種表面化學性質的過渡金屬硫化物納米材料已經成為有前途的納米平臺,可用于藥物輸送�、癌癥治療���、生物成像和生物傳感����。過渡金屬硫化物的不同化學性質使其對環境因素敏感����;例如���,氧氣的存在會導致其氧化�。微量元素鉬對幾乎所有生物都是必不可少的。因此���,從MoS2納米材料中降解的鉬可能誘導獨特的生物學過程和體內命運,涉及生物分布�����、生物轉化和生物利用度�����。生物醫學納米材料的行為所基于的幾個基本原理仍然不清楚,包括納米顆粒如何與生物屏障相互作用以及長期的生物效應����。從給藥到清除的體內運輸過程仍然是一個“黑匣子”�����。血液中形成的蛋白質電暈是納米材料與生物相互作用的第一個明確指示。但是�����,需要全面了解納米顆粒與器官和組織的基本相互作用���。為了闡明血液中納米粒子與蛋白質相互作用的作用���,國家納米科學中心陳春英研究員等人開發了分別缺乏載脂蛋白E(ApoE)����,纖維蛋白原(Fg),補體3(C3)和免疫球蛋白M(IgM)的轉基因小鼠���,從復雜的蛋白質暈中剝離這些重要蛋白質,并揭示其主要驅動力�����,然后通過體內實驗和分子動力學模擬的結合描述了MoS2納米材料的在體內的運輸�����,轉化和生物利用。成果發表在Nature Nanotechnology上。

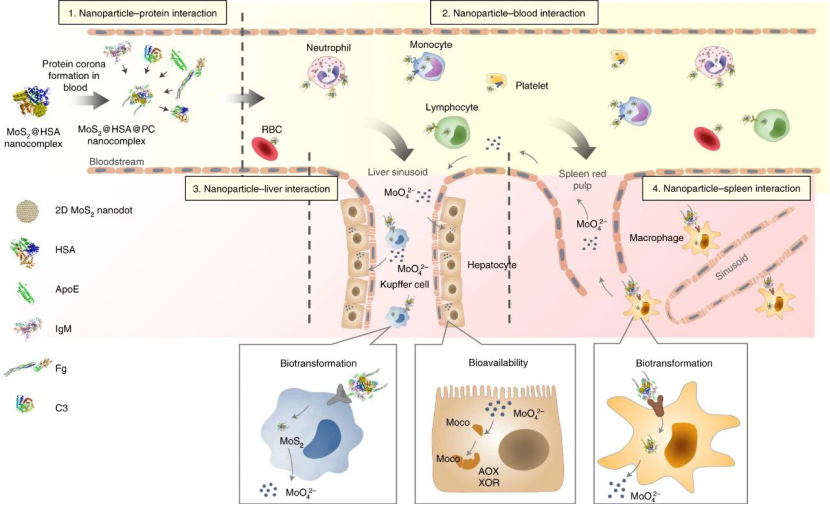
整體架構如下��,納米粒子-蛋白質界面(蛋白質暈)發生的相互作用在決定體內轉運過程中起著至關重要的作用��。位于肝竇和脾紅髓中的大多數隔離的MoS2納米材料經歷氧化���,隨后降解為鉬酸鹽��,可用于肝臟中Moco生物合成,以增強鉬酶的特定活性。也就是說,納米粒子與生物系統之間的基本相互作用是通過蛋白質電暈橋聯的運輸-轉化-生物利用鏈實現的����。
通過靜脈內注射施用納米材料后�,它們遇到的第一個生物屏障是生物分子(主要是蛋白質)和血液中的細胞。結果表明,MoS2 @ HSA納米復合物的分布和清除半衰期分別為3.5和56.7 min�����。定量測定不同血液成分中的鉬含量:注射后5分鐘���,血漿中總鉬的含量為69.6%±11.5%�����。其余的被血細胞吸收了����。注射后30分鐘��,血漿中鉬的百分比下降到3.9%±1.0%。其中,PBMC和中性粒細胞內化量最高。隨后研究了在MoS2@HSA納米復合物上形成的蛋白質暈的組成。由于蛋白質暈具有很高的動態性�����,因此原始的HSA中約32%的蛋白質被血液中的蛋白質交換���。蛋白質電暈中蛋白質的相對豐度按以下順序排列:凝結蛋白>免疫球蛋白>載脂蛋白>補體�。
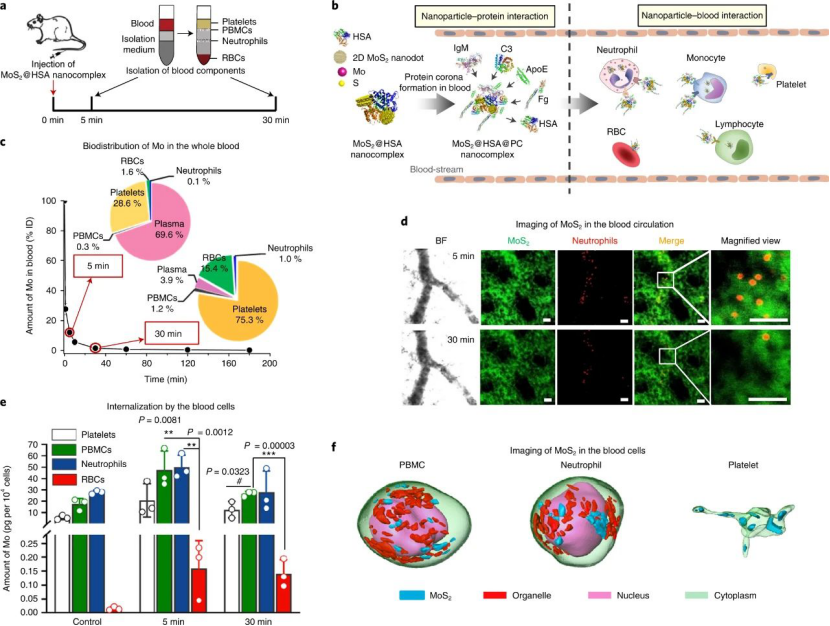
圖|MoS2 @ HSA納米復合物與血液蛋白和免疫細胞快速相互作用
為了確定納米粒子與蛋白質界面相互作用的機理,研究人員進行了分子動力學模擬��,以分析MoS2納米點與Fg�����、HSA和ApoE之間的相互作用�。結果表明���,與HSA和ApoE相互作用相比��,MoS2納米點與Fg之間的相互作用更為優先��。不出所料,MoS2-Fg相互作用具有最低的能量����,反映出更穩定的吸附��。為了研究MoS2@HSA納米復合物的運輸過程,研究人員量化了鉬在幾個階段的生物分布。結果表明��,即使在60 天后����,MoS2@HSA納米復合物仍被螯合在單核吞噬細胞系統(主要是肝臟和脾臟)中。靜脈注射后���,MoS2@HSA納米復合物在脫氧的血液中在最初的30分鐘內從心臟轉移到肺部�,初始攝取量很高。由于肺毛細血管系統���,納米顆粒直接通過血液循環迅速離開肺。它們被MPS吞噬��,該過程支持納米顆粒在更長的時間內轉運到其他器官�����,例如肝臟和脾臟�。
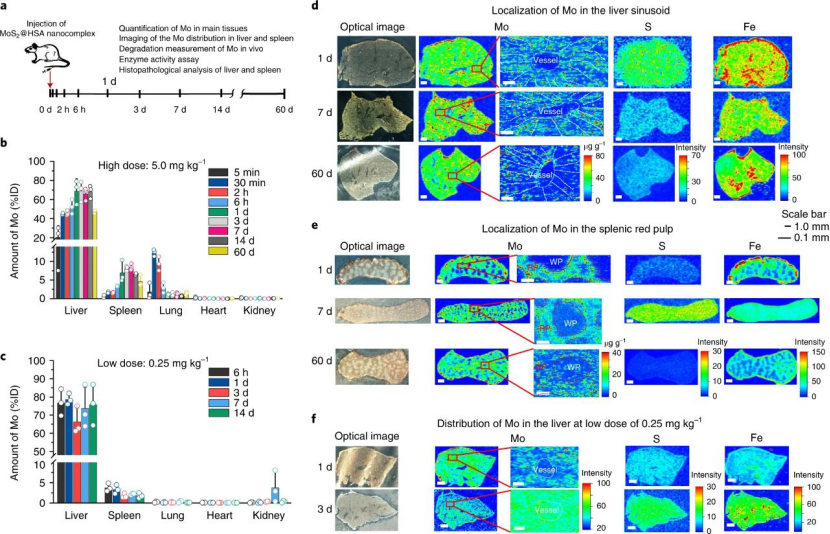
大量研究表明����,免疫球蛋白,載脂蛋白和補體成分是決定納米顆粒轉運的關鍵蛋白�。但是��,本文結果表明這三種蛋白質對MoS2 @HSA納米復合物的生物分布沒有影響。簡而言之����,血源性MoS2 @HSA納米復合物位于肝竇和脾紅髓的常駐巨噬細胞�,它們受冠狀動脈ApoE調節�。
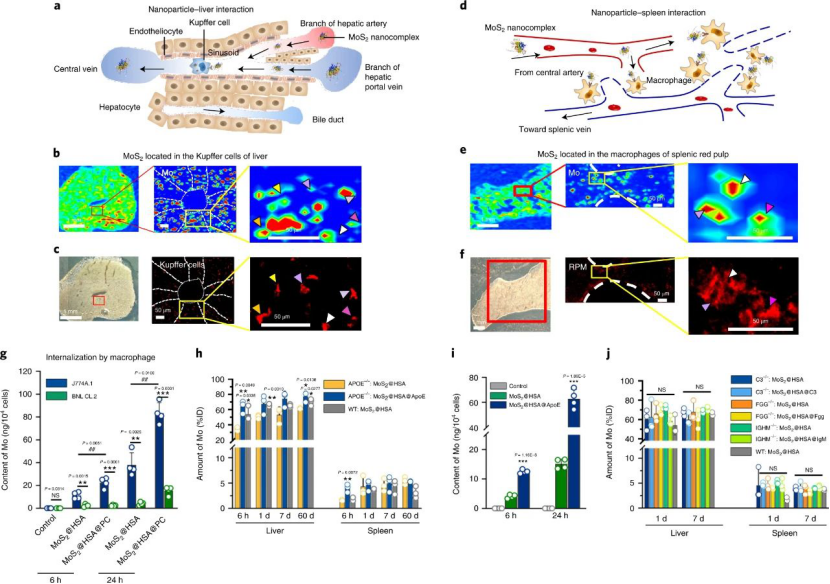
圖|肝竇和脾紅髓中的常駐巨噬細胞隔離MoS2 @HSA納米復合物
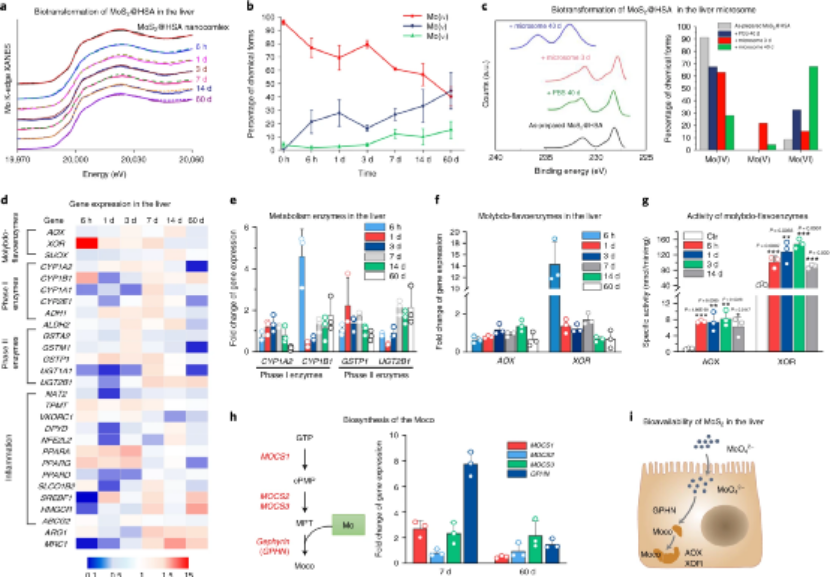
接下來,研究人員研究了MoS2 @ HSA納米復合物在肝臟中的生物轉化過程����。研究表明����,MoS2在肝臟中被氧化,鉬從Mo(IV)化學轉化為Mo(VI)����。在肝臟中�,異源生物的生物轉化是由I相和II相酶進行的�����,它們分別負責I相(即氧化,還原和水解反應)和II相(即共軛反應)的代謝�����。結果顯示���,肝微粒體將MoS2氧化為MoO42-����,這暗示著I相酶(肝微粒體中的主要氧化酶)有助于MoS2的氧化。此外,在與MoS2@HSA納米復合物孵育的巨噬細胞中檢測到了活性氧,這可能有助于脾中MoS2的生物轉化。此外���,用HSA和小鼠血漿蛋白修飾的納米點可保護MoS2免受氧化。鉬是唯一的第二行過渡金屬��,是當以鉬酸鹽形式存在時可生物利用的必需微量元素�。它被摻入到鉬輔助因子中,這是許多酶催化重要化學轉化的活性位點��。醛氧化酶(AOX)和黃嘌呤氧化還原酶(XOR)是哺乳動物中的兩種主要的黃酮類黃酮酶���。同樣����,結果顯示,由MoS2@HSA納米復合物衍生的氧化鉬在摻入鉬輔因子(Mocos)后明顯增強AOX和XOR的活性�����。XOR和AOX的比活增加表明�,螯合在肝臟中的MoS2衍生的鉬很容易被生物利用。圖|MoS2作為肝臟中的鉬輔助因子的生物轉化和生物利用度總體而言�����,研究人員評估了體內MoS2納米點的生物動力學和分布����,以及MoS2納米點與生物系統(納米粒子-蛋白質����、納米粒子-血液、納米粒子-肝臟和納米粒子-脾臟)的基本相互作用�����。該課題組揭示了ApoE是負責組織之間MoS2 @ HSA納米復合物的運輸�。經過對體內納米材料的運輸-轉化-生物利用度鏈的全面研究,證明MoS2 @ HSA納米復合物在肝竇和脾臟紅髓中被截獲,并且MoS2降解產生的氧化成分最終并入肝中的鉬酶中,影響其新陳代謝�。因此����,本文提出了關于帶有必需微量元素的納米材料的獨特體內命運����。Cao, M., Cai, R., Zhao, L. et al. Molybdenum derived from nanomaterials incorporates into molybdenum enzymes and affects their activities in vivo. Nat. Nanotechnol. (2021).https://doi.org/10.1038/s41565-021-00856-w