北京時(shí)間2021年1月29日,西湖大學(xué)施一公教授研究組在《科學(xué)》(Science)發(fā)表題為《激活狀態(tài)的人源次要剪接體的結(jié)構(gòu)》(Structure of the Activated Human Minor Spliceosome)的科研論文,是剪接體結(jié)構(gòu)與機(jī)理研究的又一個(gè)重大突破。?
在這篇論文中,他們首次報(bào)道了迄今整體研究知之甚少的次要剪接體的高分辨率三維結(jié)構(gòu),展示了在剪接反應(yīng)中的一個(gè)關(guān)鍵構(gòu)象——激活態(tài)次要剪接體(activated minorspliceosome,定義為“次要Bact復(fù)合物”),整體分辨率高達(dá)2.9埃。該結(jié)構(gòu)第一次展示了人源次要剪接體的組成、以及對(duì)稀有內(nèi)含子(U12依賴型內(nèi)含子)的識(shí)別機(jī)理,首次揭示了次要剪接體的催化中心以及活性位點(diǎn),并且通過(guò)結(jié)構(gòu)解析鑒定了次要剪接體的全新蛋白組分、揭示了它們對(duì)次要剪接體及罕見(jiàn)內(nèi)含子剪接的重要作用等一系列重要科學(xué)問(wèn)題。
此次重大突破,使施一公研究組在繼2015年首次解析世界上第一個(gè)剪接體結(jié)構(gòu)、2017年解析第一個(gè)人源剪接體結(jié)構(gòu)之后,再次成為世界上首個(gè)解析了次要剪接體高分辨率三維結(jié)構(gòu)的團(tuán)隊(duì)。

圖1 施一公研究組最新《科學(xué)》長(zhǎng)文
在高等生物中,一段又一段的遺傳密碼埋在核酸分子中。其中,“無(wú)效”的遺傳信息不具有翻譯功能,被稱為內(nèi)含子,而可以被核糖體翻譯的有效遺傳信息叫做外顯子。把這些遺傳密碼中“無(wú)效”的內(nèi)含子“剪”出來(lái),“有效”的外顯子“接”到一起的過(guò)程叫做RNA剪接,它是生命體解讀遺傳密碼的核心步驟。負(fù)責(zé)執(zhí)行這一步驟的就是細(xì)胞核內(nèi)復(fù)雜精密的分子機(jī)器——剪接體。每個(gè)細(xì)胞對(duì)于每一條剪接前的基因信使——前體信使RNA的剪接在時(shí)空上是非常精準(zhǔn)的。剪掉誰(shuí),剪掉多長(zhǎng),什么時(shí)候剪,按照什么順序把外顯子拼接起來(lái),每一個(gè)“操作”都是可能改變細(xì)胞命運(yùn)的關(guān)鍵問(wèn)題。一步走錯(cuò),結(jié)果千差萬(wàn)別,基因的表達(dá)和傳遞也會(huì)因此出現(xiàn)錯(cuò)誤,于是就導(dǎo)致了人類某些先天遺傳疾病以及后天疑難雜癥的出現(xiàn)。研究發(fā)現(xiàn),人類的遺傳疾病大約有35%都是因?yàn)榧艚赢惓T斐傻摹?/strong>從1977年首次發(fā)現(xiàn)RNA剪接至本世紀(jì)初,科學(xué)家們通過(guò)免疫沉淀、基因敲除、交聯(lián)質(zhì)譜、建立體外剪接反應(yīng)系統(tǒng)等研究手段,初步建立起剪接體的組裝、激活與解聚的發(fā)生過(guò)程,以及蛋白與蛋白、蛋白與核酸之間的相互作用、相互調(diào)控等復(fù)雜的RNA剪接調(diào)控網(wǎng)絡(luò)。
20世紀(jì)90年代,科學(xué)家在對(duì)高等真核生物內(nèi)含子序列的研究分析中,發(fā)現(xiàn)了一類非經(jīng)典的內(nèi)含子剪接序列(5’剪接位點(diǎn)為AT,3’剪接位點(diǎn)為AC),一種全新的剪接體開(kāi)始逐漸進(jìn)入科學(xué)家的視野。在隨后的研究中,科學(xué)家們逐漸確定了這個(gè)全新剪接體的核酸組成,其中U11、U12、U4atac、U6atac四種新的snRNA參與該類內(nèi)含子的識(shí)別與剪接。由于這種非經(jīng)典的內(nèi)含子占比不足百分之一,該類內(nèi)含子被稱作稀有內(nèi)含子,而因其特殊的剪接位點(diǎn)及識(shí)別該位點(diǎn)的特殊snRNA組分,該類內(nèi)含子又被命名為AT-AC內(nèi)含子(AT-AC intron)或U12依賴型內(nèi)含子(U12-type intron),催化該類內(nèi)含子剪接的這種全新剪接體被命名為次要剪接體(minor spliceosome)。盡管由次要剪接體進(jìn)行剪接的稀有內(nèi)含子含量極低,但是這些基因卻與許多重要的細(xì)胞基本生命活動(dòng)密切相關(guān),比如DNA的復(fù)制與修復(fù)、RNA轉(zhuǎn)錄與翻譯等等。然而,對(duì)于U12依賴型內(nèi)含子以及次要剪接體的研究卻發(fā)展緩慢,次要剪接體的蛋白組成、重塑調(diào)控等等關(guān)鍵的科學(xué)問(wèn)題,一直沒(méi)有答案。其中非常重要的一步——如何捕獲并純化次要剪接體,是領(lǐng)域內(nèi)面臨的一個(gè)巨大難題。
施一公研究組一直致力于剪接體的三維結(jié)構(gòu)與RNA剪接分子機(jī)理的研究,自2015年報(bào)道了第一個(gè)剪接體的高分辨率三維結(jié)構(gòu)后,相繼解析了釀酒酵母和人源主要剪接體(major spliceosome)的全部已被鑒定的基本構(gòu)象。這些已解析的剪接體覆蓋了整個(gè)RNA剪接循環(huán),從分子層面揭示了剪接體催化RNA剪接兩步反應(yīng)的工作機(jī)理,同時(shí)為理解剪接體的組裝、激活和解聚等過(guò)程的發(fā)生提供結(jié)構(gòu)依據(jù),首次將剪接體介導(dǎo)的RNA剪接過(guò)程完整的串聯(lián)起來(lái),為理解RNA剪接的分子機(jī)理提供了最清晰、最全面的結(jié)構(gòu)信息(圖2)。與此同時(shí),施一公研究組也將目光聚焦在了研究更為匱乏的次要剪接體研究領(lǐng)域。
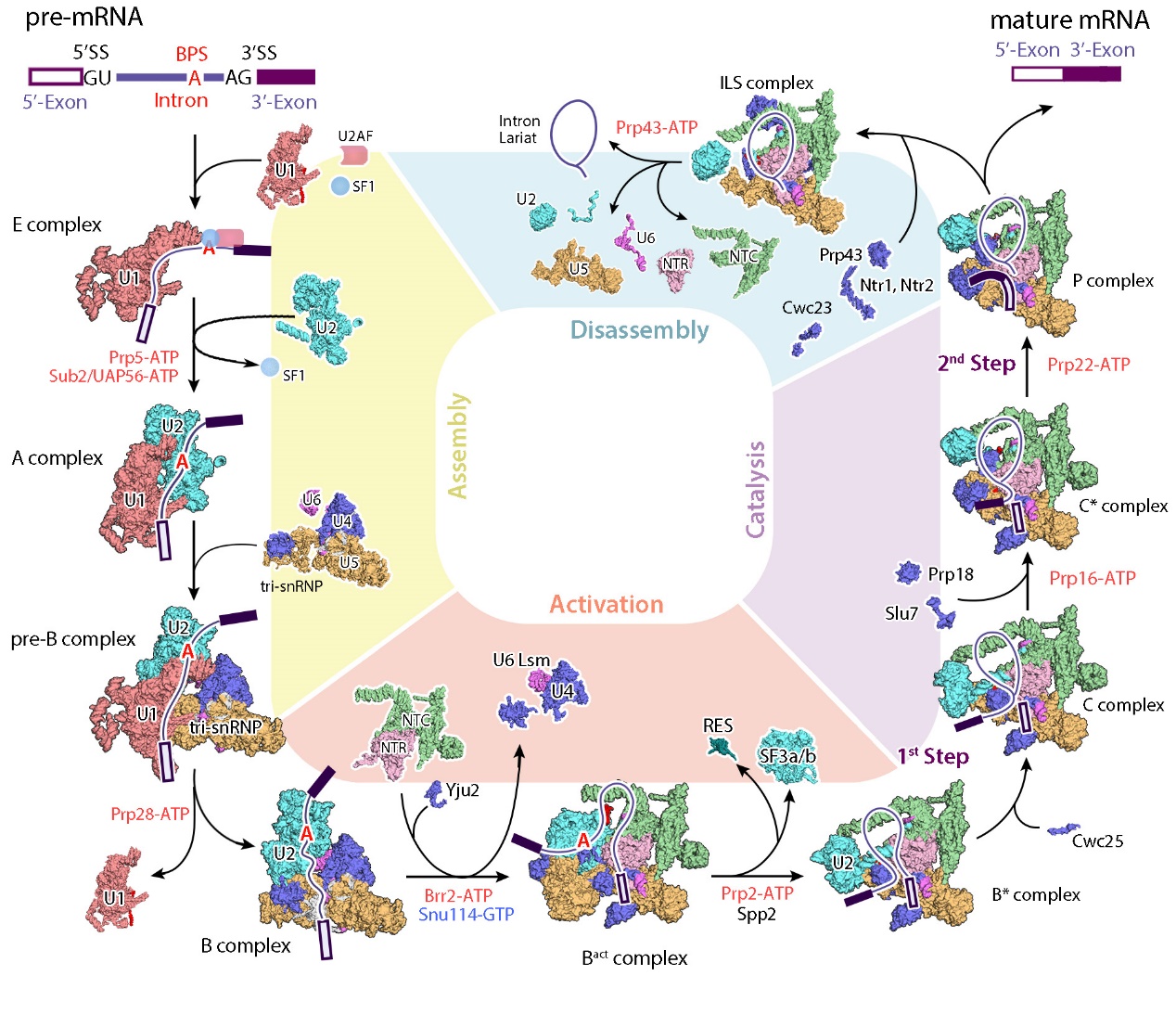
圖2施一公研究組解析的剪接體結(jié)構(gòu)匯總
(圖片來(lái)源: Wan et.al, 2020, Annu Rev Biochem)
在沒(méi)有任何次要剪接體的捕獲與純化等相關(guān)文獻(xiàn)的情況下,摸索并建立次要剪接體的捕獲與純化方法迫在眉睫。施一公研究組的白蕊博士與萬(wàn)蕊雪博士,長(zhǎng)期從事剪接體的純化與結(jié)構(gòu)研究工作,并積累了大量剪接體結(jié)構(gòu)研究的經(jīng)驗(yàn)。在此研究經(jīng)驗(yàn)基礎(chǔ)之上,結(jié)合次要剪接體識(shí)別位點(diǎn)的特異性,研究組首次設(shè)計(jì)出一條全新的U12依賴型的pre-mRNA。通過(guò)改良前人的體外剪接反應(yīng)實(shí)驗(yàn)條件,成功地確定了該U12依賴型的pre-mRNA具有極高的特異性與剪接的高效性。由于次要剪接體的含量極低,如何進(jìn)一步獲得性質(zhì)良好的次要剪接體樣品,成為本文研究的第二大難點(diǎn)。白蕊和萬(wàn)蕊雪在原有的剪接體純化基礎(chǔ)之上,進(jìn)一步探索與改良,最終首次建立起一套完整的次要剪接體捕獲與純化方法,成功獲得了處于激活態(tài)的次要剪接體的蛋白樣品,隨后利用單顆粒冷凍電鏡技術(shù)重構(gòu)出了世界上首個(gè)次要剪接體的冷凍電鏡結(jié)構(gòu),整體分辨率為2.9埃,并搭建了第一個(gè)次要剪接體的原子模型,其中包含了4條RNA和45個(gè)蛋白(圖3)。
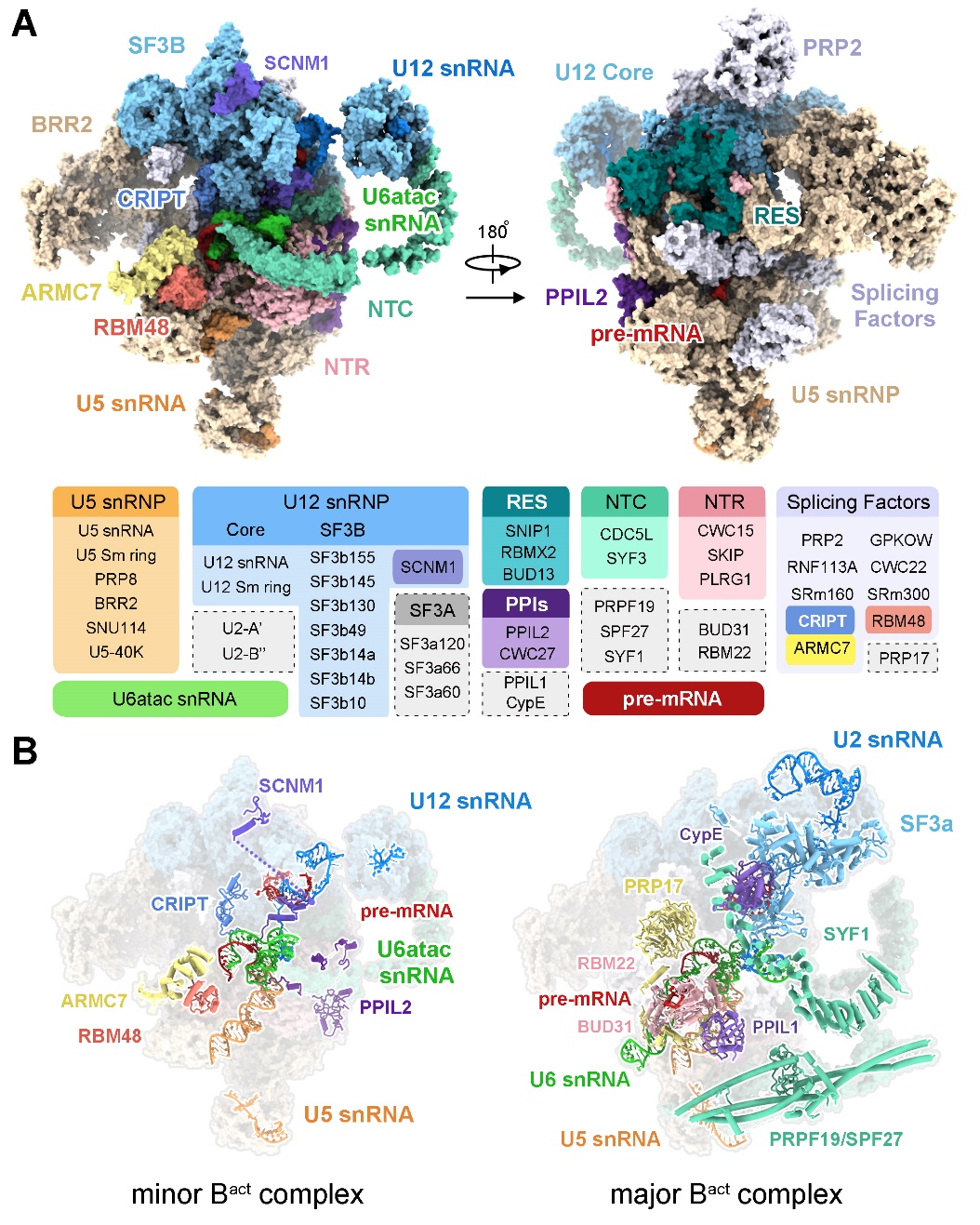
圖3人源次要剪接體的三維結(jié)構(gòu)
該文解析的人源次要剪接體Bactcomplex結(jié)構(gòu),首次觀察到了次要剪接體特有組分U6atac snRNA和U12 snRNA的三維結(jié)構(gòu),揭示了識(shí)別U12-type內(nèi)含子剪接位點(diǎn)的結(jié)構(gòu)基礎(chǔ),第一次展示了次要剪接體活性位點(diǎn)和催化中心的三維結(jié)構(gòu)。在次要剪接體的活性位點(diǎn)中,兩個(gè)具有關(guān)鍵作用的催化鎂離子被周圍的RNA配位結(jié)合,為剪接反應(yīng)的發(fā)生提供了基礎(chǔ)。該結(jié)構(gòu)的成功解析,首次鑒定出了5個(gè)全新的蛋白組分,它們參與組成次要剪接體因此在U12依賴型內(nèi)含子的剪接中起重要作用。SCNM1、CRIPT為U12 snRNP的特有組分,參與識(shí)別和穩(wěn)定內(nèi)含子上的剪接位點(diǎn);RBM48與ARMC7形成復(fù)合物,結(jié)合在U6atac snRNA的5’末端,結(jié)合并保護(hù)U6atac snRNA特有的γ-甲基磷酸帽結(jié)構(gòu),起到穩(wěn)定U6atac snRNA構(gòu)象的作用。此外,參與泛素化通路的PPIL2蛋白在剪接體中的結(jié)構(gòu)首次解析,該蛋白深入次要剪接體的活性位點(diǎn),與U5 snRNA有直接的相互作用,參與穩(wěn)定U5 snRNP以及次要剪接體的催化中心。值得一提的是,在主要剪接體激活過(guò)程中起關(guān)鍵作用的“動(dòng)力驅(qū)動(dòng)”蛋白Prp2及其激活因子Spp2,也以類似的方式結(jié)合到次要剪接體中,這是Prp2同時(shí)也在次要剪接體中起作用的第一個(gè)支持性證據(jù)。由此不難推斷,推動(dòng)主要剪接體進(jìn)行結(jié)構(gòu)重塑的數(shù)個(gè)ATPase也參與次要剪接體不同構(gòu)象之間的轉(zhuǎn)變與重塑中,即次要剪接體與主要剪接體之間共享結(jié)構(gòu)重塑蛋白因子(圖4)。該文作為第一篇揭示人源次要剪接體的結(jié)構(gòu)研究,文中建立的捕獲與純化次要剪接體的方法、鑒定的參與次要剪接體的組成的全新蛋白等,都將對(duì)U12依賴型的RNA剪接分子機(jī)理的研究產(chǎn)生重要影響。
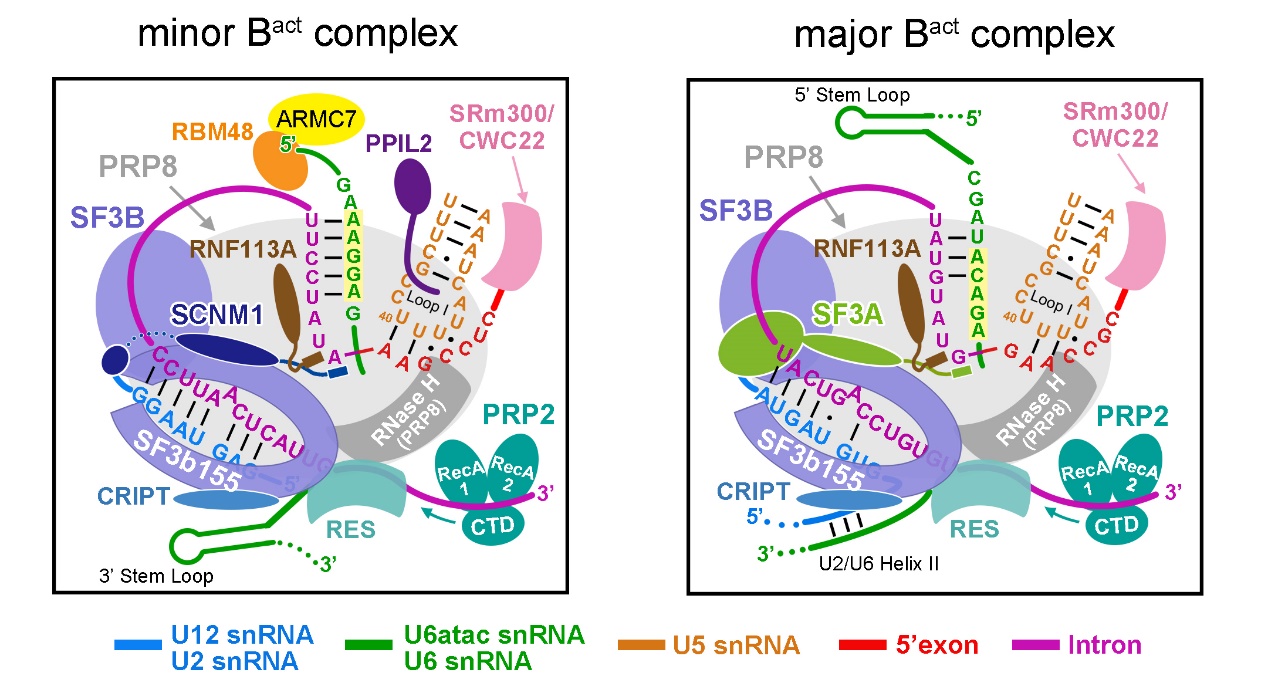
圖4次要剪接體與主要剪接體的結(jié)構(gòu)差異
西湖大學(xué)生命科學(xué)學(xué)院施一公教授、西湖大學(xué)生命科學(xué)學(xué)院西湖學(xué)者萬(wàn)蕊雪博士為本文的共同通訊作者;西湖大學(xué)生命科學(xué)學(xué)院博士后白蕊和西湖學(xué)者萬(wàn)蕊雪為本文的共同第一作者;清華大學(xué)生命學(xué)院博士后王琳參與了部分生化研究;清華大學(xué)生命學(xué)院博士生徐魁、清華大學(xué)生命學(xué)院張強(qiáng)鋒研究員為結(jié)構(gòu)模型的搭建提供了幫助;清華大學(xué)冷凍電鏡平臺(tái)主管雷建林博士為冷凍電鏡數(shù)據(jù)收集提供了幫助。電鏡數(shù)據(jù)采集于清華大學(xué)冷凍電鏡平臺(tái),計(jì)算工作得到清華大學(xué)高性能計(jì)算平臺(tái)、國(guó)家蛋白質(zhì)設(shè)施實(shí)驗(yàn)技術(shù)中心(北京)的支持。本項(xiàng)研究成果來(lái)自于西湖實(shí)驗(yàn)室,獲得了西湖教育基金會(huì)、北京結(jié)構(gòu)生物學(xué)高精尖創(chuàng)新中心(清華)及國(guó)家自然科學(xué)基金委的經(jīng)費(fèi)支持。
原文鏈接:https://science.sciencemag.org/content/early/2021/01/27/science.abg0879











