糖尿病目前影響全世界超過4.63億人,據估計到2045年將影響超過7億人。胰島素治療是1型和晚期2型糖尿病治療的核心組成部分;然而,其狹窄的治療窗口與嚴重低血糖的風險相關。在正常血糖狀態下表現出持續和緩慢的基礎胰島素釋放,并實時加速胰島素釋放以應對高血糖的葡萄糖反應載體,可以提供有效的血糖調節,降低低血糖風險。
鑒于此,浙江大學顧臻等人制備了一種聚(L-賴氨酸)衍生的可生物降解的葡萄糖響應性陽離子聚合物,用于構建聚合物-胰島素復合物以實現葡萄糖刺激胰島素釋放。
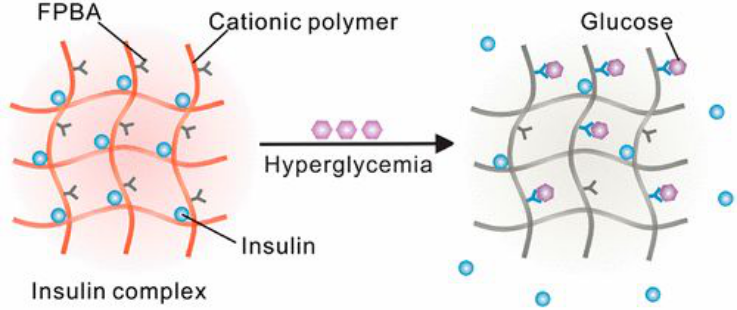
示意圖
研究人員通過使用4-羧基-3-氟苯基硼酸(FPBA)(一種廣泛使用的葡萄糖傳感組件)修飾可生物降解的聚賴氨酸(PLL)來合成陽離子聚合物。隨后,通過利用生理pH值上的靜電吸引,將這些聚合物應用于制備帶有負電胰島素的復合物,該胰島素的等電點為pH 5.3至5.35。由于形成聚離子復合物的驅動力也與由于釋放反離子而導致的熵增加有關,正電荷聚合物鏈與負電荷胰島素形成的復合物的穩定性受PLL分子量、FPBA修飾度、聚合物與胰島素的比例、葡萄糖濃度的影響。
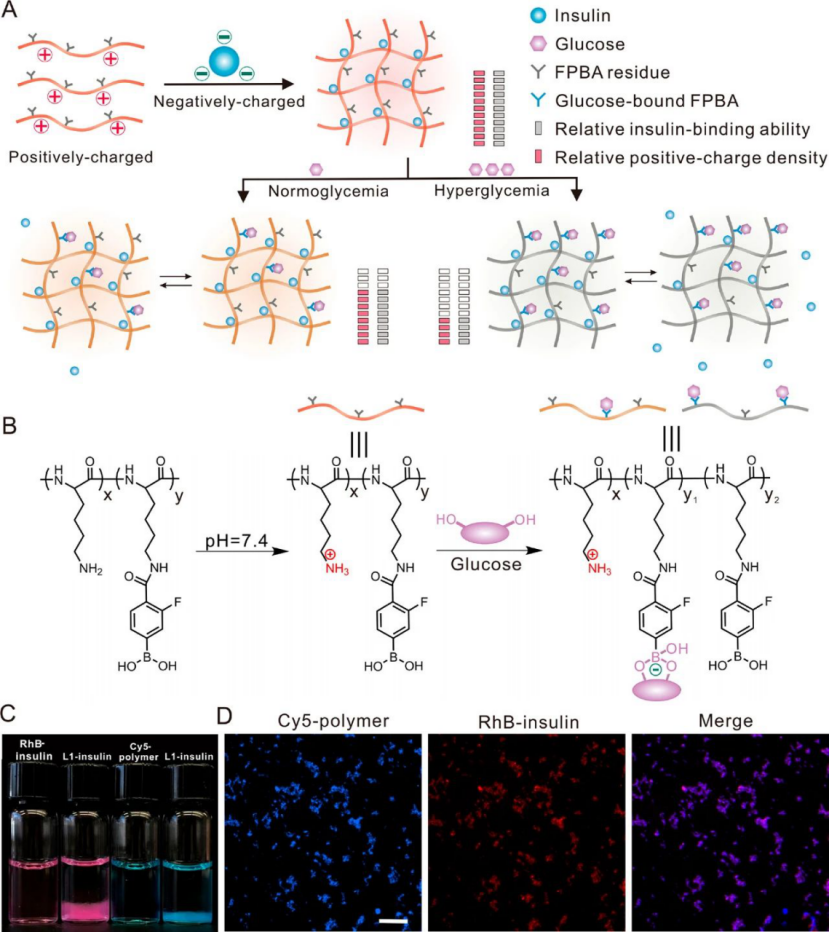
圖|葡萄糖反應復合物,用于胰島素輸送
在葡萄糖存在下,FPBA與葡萄糖的結合引起FPBA部分的表觀pKa的降低,從而將負電荷引入聚合物鏈并隨后降低了正電荷密度。這導致聚合物和胰島素之間的吸引力降低,這主要是由于復合物形成過程中熵的增加較小,從而導致聚合物和胰島素之間的結合力減弱并觸發了胰島素從復合物中的釋放。
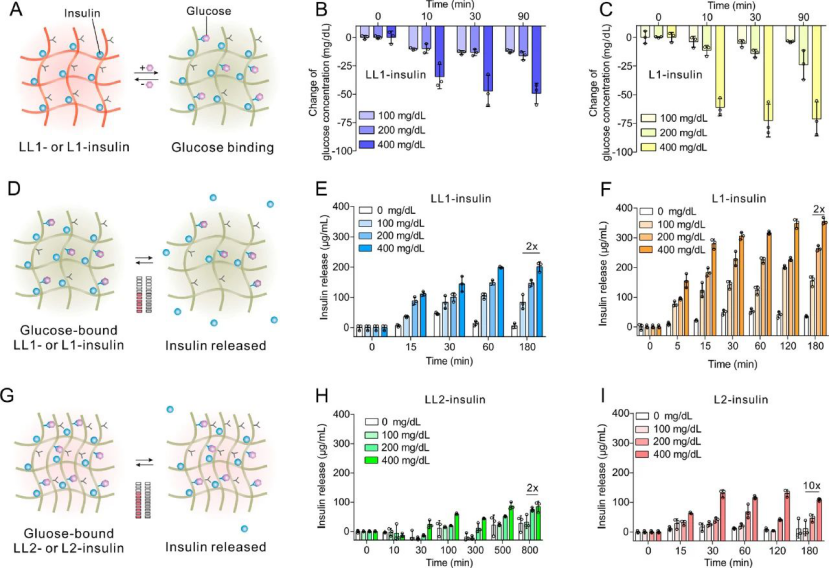
圖|體外釋放
在化學誘導的1型糖尿病小鼠中皮下注射時,復合物沉積在皮膚下,并在正常血糖情況下緩慢釋放胰島素,從而維持正常血糖水平。向經復合物治療的糖尿病小鼠腹腔注射葡萄糖后,升高的BGL觸發胰島素從皮下復合物釋放,導致血漿胰島素水平升高和高血糖的糾正。

圖|體內實驗
總的來說,研究了FPBA在聚合物中的修飾程度以及聚合物與胰島素的比例對正常血糖持續時間和體內葡萄糖反應性能的影響。
參考文獻:
Jinqiang Wang, et al. Injectable Biodegradable Polymeric Complex for Glucose-Responsive Insulin Delivery. ACS Nano, 2021.
DOI: 10.1021/acsnano.0c07291
https://doi.org/10.1021/acsnano.0c07291











