1953年,沃森和克里克發現了DNA分子的雙螺旋結構,開啟了分子生物學的大門,奠定了基因技術的基礎。如今,科學家不斷地構建各種各樣的DNA材料用于生命科學、材料學、機械學等等多個領域。近日Nature Chemistry上連續發表了一些關于DNA技術的研究論文,詳情如下:1. Nature Chemistry:立體定向和區域定向DNA編碼的化學文庫可以有效地用于腫瘤靶向治療

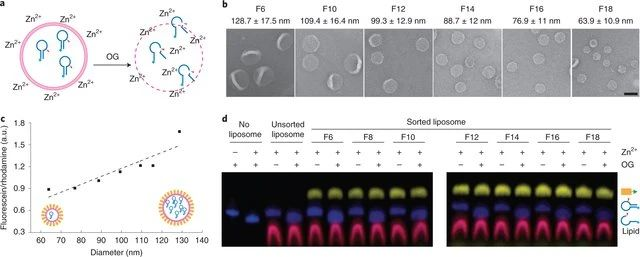
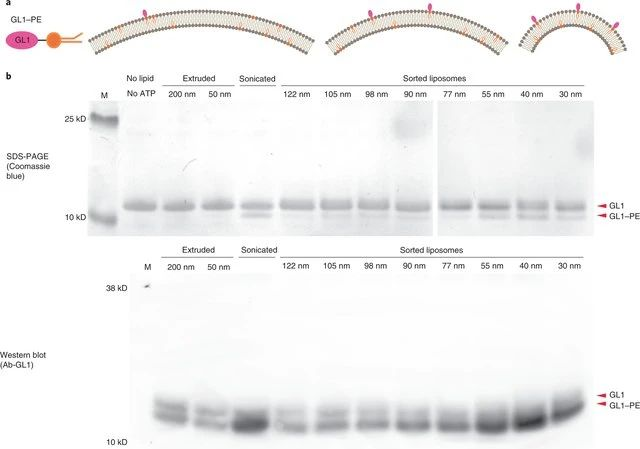
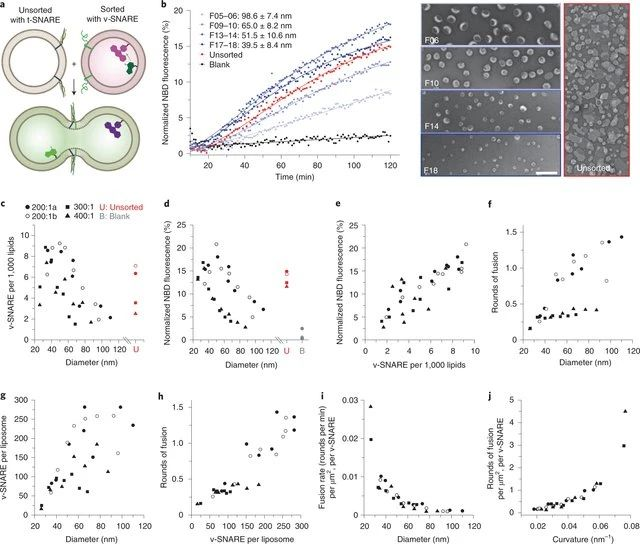
利用可擴增的DNA標記對化合物進行編碼,有利于蛋白質小分子配體的發現。有鑒于此,瑞士蘇黎士聯邦理工學院的Dario Neri等研究人員,提出立體定向和區域定向DNA編碼的化學文庫可以有效地用于腫瘤靶向治療。1)研究人員為了研究立體化學和區域化學對配體發現的影響,合成了670752個基于2-疊氮基-3-碘苯基丙酸的衍生物的DNA編碼文庫。該文庫針對多種蛋白質進行篩選,并獲得了特異性配體。2)對一組具有藥物相關性的蛋白質靶點所獲得的選擇指紋圖譜清楚地顯示了鄰位、間位或對位異構體的優先富集,在沒有DNA的情況下通過親和力測量得到了實驗驗證。3)所發現的配體包括新的選擇性酶抑制劑和腫瘤相關抗原的結合物,這使得條件嵌合抗原受體T細胞活化和腫瘤靶向成為可能。Nicholas Favalli, et al. Stereo- and regiodefined DNA-encoded chemical libraries enable efficient tumour-targeting applications. Nature Chemistry, 2021.DOI:10.1038/s41557-021-00660-yhttps://www.nature.com/articles/s41557-021-00660-y2. Nature Chemistry: 通過DNA磚輔助離心分離不同大小的亞150nm脂質體近日,耶魯大學ChenxiangLin和復旦大學顧宏周等人報告了一種通用且可擴展的分選技術,該技術使用膽固醇修飾的DNA“納米磚”通過其浮力密度來區分大小不一的脂質體,該策略可與多種脂質體制造方法結合使用。成果發表在Nature Chemistry上。雖然典型的脂質雙層比水溶液輕,但大小不同的脂質體但是膜相同的和內部成分相同的在浮力密度上只有輕微的差別,因為脂質體的水腔構成了它的大部分質量。但是,球形脂質體的表面積體積比(S/V)隨著尺寸的增加而迅速減小(也就是說,表面積體積比與半徑成反比),這就提供了一個機會,通過在脂質體中廣泛地涂覆一層致密材料(類似于將磚塊附著到氦氣球上)來擴大它們之間的浮力密度差。從理論上講,當被這種分子磚包裹時,較小的脂質體會比大脂質體獲得更大的密度,這就允許通過等密度離心分離脂質體。研究人員選擇DNA作為涂層材料是因為其具有高的浮力密度、出色的溶解性,可編程的自組裝行為以及易于與疏水性分子結合的特性。建立了兩個DNA結構,一個三尖星(?86kD)和一個六螺旋束棒(?189 kD),每個末端都有一個膽固醇DNA結構為膜錨。每個結構僅放置一個疏水分子可最大程度地減少磚在脂質體表面上的覆蓋面積,并限制聚集和膜變形。這種方法可以將毫克脂質體(不論其來源和化學組成)分為6至8個均質群,平均直徑為30-130nm。研究人員表明,這些均勻、耐泄漏的脂質體可作為理想的底物,以前所未有的分辨率研究膜曲率如何影響外周膜蛋白(ATG3)和整體膜蛋白(SNARE)活性。與傳統方法相比,該分選技術代表了簡化的過程,可實現卓越的脂質體大小均勻性,這有利于膜生物學研究和脂質體藥物遞送系統的開發。圖|使用大小均一的脂質體研究了ATG3催化的GL1脂質化反應圖|SNARE介導的膜融合研究使用大小均一的脂質體自組裝DNA納米結構以許多非傳統的方式與脂質雙層連接,以實現可編程膜工程的目標。本文的DNA磚輔助脂質體分選方法進一步提高了DNA納米技術的膜工程能力。具體而言,這項技術的簡單性和魯棒性,使得它可以很容易地適用于任何有研究級超速離心機的生化實驗室。未來的方法發展將受益于DNA納米結構的可編程性。除了在基礎研究中的實用性,還設想這種方法(以其當前或適應的形式)在生物技術中找到應用,例如在幫助開發藥物遞送脂質體以及分離疾病特異性細胞外囊泡方面。
Yang, Y., Wu, Z., Wang,L. et al. Sorting sub-150-nm liposomes of distinctsizes by DNA-brick-assisted centrifugation. Nat. Chem. (2021).
https://doi.org/10.1038/s41557-021-00667-5