在COVID-19大流行期間,基于mRNA的疫苗由于其高效性和前所未有的開發制造速度而占據了頭條新聞。如今,mRNA疫苗 “一戰成名”,這一進步更令全球生命科學工作者為之振奮,mRNA技術在傳染病、艾滋病、遺傳病、罕見病、腫瘤等疾病領域將提供各種機會。高福院士也呼吁:“大家要關注mRNA疫苗,它給人類提供了無限的思考。”
BioNTech創始人兼首席執行官Ugur Sahin領導了COVID-19 mRNA疫苗的開發。我們知道,疫苗一般而言是用來刺激免疫系統產生更強大的免疫來抵抗病毒或細菌入侵,那對于免疫性疾病能否通過疫苗來反過來控制呢?
成果簡介
近日,Ugur Sahin等人反其道而行之,他們利用mRNA疫苗技術來抑制而不是激發抗原特異性免疫反應。在多發性硬化的小鼠模型上,他們發現用編碼自身抗原的修飾mRNA進行免疫,并在非炎癥性脂質復合物載體中傳遞,通過激活抗原特異性調節性T細胞來抑制自身免疫。盡管需要進一步的研究來評估該策略的臨床潛力,但成功的耐受性疫苗接種方法可以改變自身免疫性疾病、過敏和異基因移植的治療。成果發表在Science上,Nature Biotechnology對其進行了報道。


mRNA疫苗由包裹在脂質納米顆粒中的編碼抗原的RNA組成。Sahin及其同事最初開發了mRNA疫苗,目的是刺激針對腫瘤的免疫力。在那些研究中,mRNA-脂質納米顆粒的凈負電荷導致脾臟樹突狀細胞巨噬細胞增多,Toll樣受體7(TLR7)活化,干擾素-α的產生以及抗原特異性免疫的觸發。那時,Kariko和同事們開發了一種基于mRNA的疫苗,其中加入了1-甲基假尿苷(m1Ψ),一種真核細胞18S核糖體RNA的天然成分,以代替尿苷,發現m1Ψ mRNA具有更高的翻譯能力和更低的天然免疫活化,因為它不刺激TLR7。
在新的研究中,Sahin和同事們認為一種抗炎型m1ψ mRNA疫苗可能有利于需要抑制免疫的疾病環境,因此他們研究了m1ψ mRNA疫苗是否能預防自身免疫。
值得注意的是,該疫苗在兩個主要方面與常規疫苗不同。
1)首先,它不是刺激人的免疫系統識別,記憶并容易對抗特定的微生物或分子,而是促進對特定分子的免疫耐受。
2)其次,它是通過傳遞信使RNA(mRNA)(而不是將蛋白片段傳遞到細胞)來實現的。這意味著進入細胞后,含有產生特定蛋白質指令的mRNA被細胞用于產生該蛋白質,然后該蛋白質被“顯示”給免疫細胞。
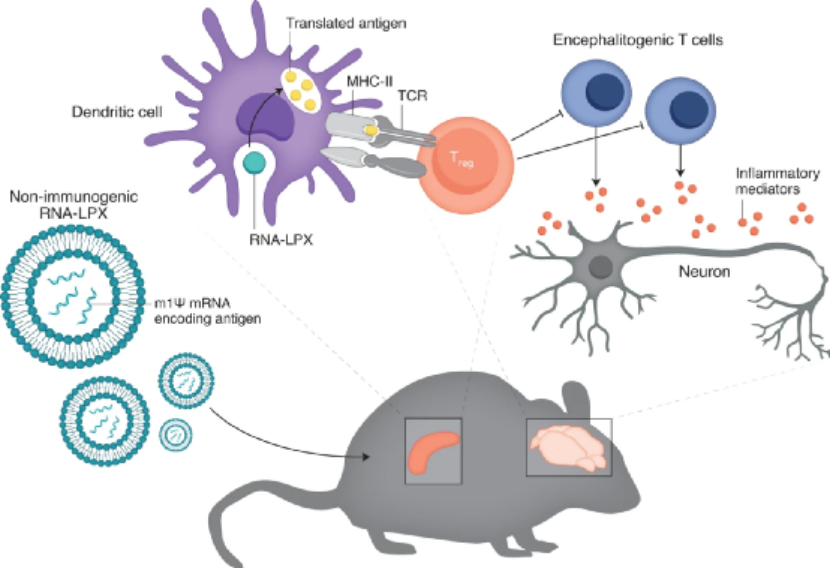
圖|用于抗炎的mRNA疫苗誘導免疫耐受
刺激了調節性T細胞增殖
作者重點研究了多發性硬化的小鼠模型,即實驗性自身免疫性腦脊髓炎(EAE),該病可由髓鞘少突膠質細胞糖蛋白肽(MOG35-55)和強佐劑免疫引起。MOG是一種與多發性硬化癥相關的自身抗原;在EAE中,MOG特異性T細胞驅動疾病,導致進行性神經損傷。在沒有佐劑的情況下,在健康小鼠中施用MOG m1Ψ mRNA比施用MOG尿苷mRNA誘導顯著更高的MOG特異性T細胞增殖,但是m1Ψ mRNA刺激的T細胞表達高水平的耗竭標記物和少量的炎性細胞因子。重要的是,m1Ψ mRNA配方也刺激了抑制性、MOG特異性FoxP3+調節性T(Treg)細胞的增殖。
不致EAE
在小鼠接種MOG肽和佐劑后,10-15天內出現臨床癥狀。為了檢測m1ψ mRNA是否能預防疾病,作者首先注射MOG肽和佐劑,然后在癥狀出現前7天和10天時候注射m1ψ mRNA編碼MOG或無關肽。接受MOG m1ψ mRNA的小鼠確實受到保護,不致出現EAE,而用編碼不相關肽的m1ψ mRNA治療的小鼠與鹽水處理的小鼠類似。
對MOG m1ψ mRNA處理小鼠細胞免疫反應的分析顯示,T細胞浸潤減少,腦脊髓脫髓鞘減少。此外,受保護的小鼠脾臟中含有MOG特異性T細胞,表達低水平的激活標記高水平的共抑制分子和更多的激活的Treg細胞。阻斷CTLA-4或PD-1的抗體可顯著降低MOG m1ψ mRNA治療的效果,可能是由于對Treg細胞作用機制的干擾或T細胞效應器功能的增強所致。
以上這些數據表明,盡管m1ψ mRNA疫苗可以促進Treg細胞的增殖,但它并沒有刪除預先存在的自體反應T細胞。值得注意的是,m1ψ mRNA的給藥并沒有誘導MOG特異性自身抗體,這是一種潛在的風險,涉及到給藥疾病相關的自身抗原。
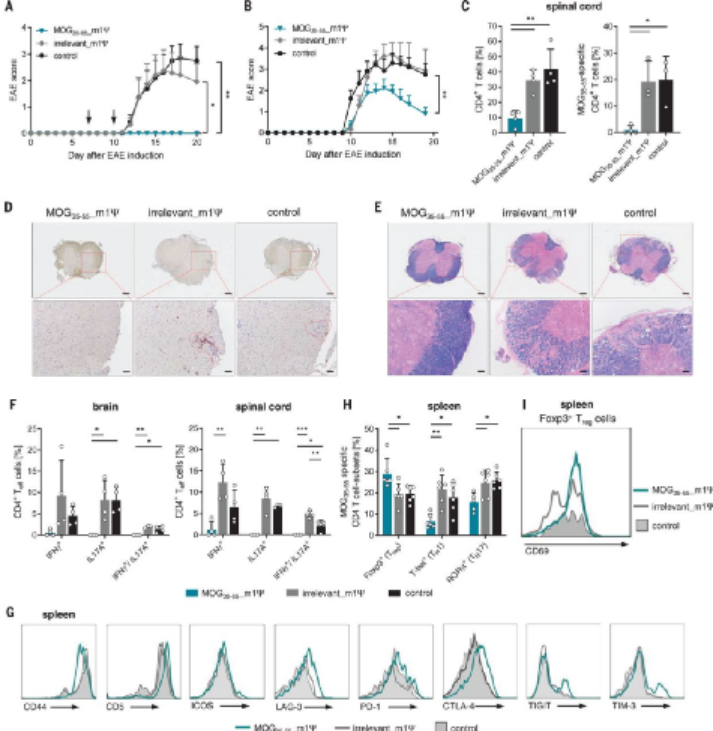
圖|編碼m1ΨmRNA的抗原治療可改善小鼠EAE
總結與展望
基于核酸的疫苗可以有效地重置多發性硬化癥中的免疫應答的觀念并不新鮮,這也不是首次探索以抗炎形式遞送自身抗原作為誘導耐受性的方法。先前的方法包括使用諸如口服,經鼻或皮下施用的方法以抗炎形式遞送肽或蛋白質,或在諸如細胞或主要組織相容性復合物分子的載體上進行遞送。但是,這些基于DNA和蛋白質的概念在臨床上的成功喜憂參半,到目前為止,效果普遍不佳。RNA脂質復合物抗原遞送系統的主要優點是它易于適應任何蛋白質抗原(或實際上是抗原的組合),并且大規模可行且具有成本效益。這意味著該方法將適用于大量人群,并且可能還包括重復給藥。
但是,在將m1Ψ mRNA疫苗用于治療自身免疫性疾病的疫苗轉化用于人類之前,必須回答與確定最佳疾病特異性自身抗原靶標以及效果的持久性和特異性有關的關鍵問題。當前的報告沒有通過隨后以非致耐受性形式的自身抗原再挑戰或通過將Treg細胞過繼轉移至幼稚小鼠來正式證明耐受性。人們認為人類自身免疫性疾病包括持續暴露于自身抗原,可能與炎性刺激同時發生。因此,確定免疫調節作用的持續時間以及重復接種是否安全或有利是很重要的。最后,類似方法可用于刺激免疫反應的事實強調需要充分了解控制mRNA疫苗的抗炎特性的機制,以消除有害的免疫刺激風險。盡管如此,Sahin及其同事證明了m1Ψ mRNA的簡單性和巨大潛力是鼓舞人心的。
參考文獻:
1. Christina Krienke, et al., A noninflammatory mRNA vaccine for treatment of experimental autoimmune encephalomyelitis. Science 2021.
DOI: 10.1126/science.aay3638
https://science.sciencemag.org/content/371/6525/145
2. Wardell, C.M., Levings, M.K. mRNA vaccines take on immune tolerance. Nat Biotechnol (2021).
https://doi.org/10.1038/s41587-021-00880-0











