在多細胞生物中,細胞響應其微環境的變化而相互通信。這種能力構成了生命的基本生物化學。越來越多的證據表明,這些細胞相互作用主要是通過膜蛋白的動態和特異性調節來協調的,且它們的表達和構象通過細胞內程序進行動態調控。
近年來,人們越來越熱衷于利用DNA納米結構來模仿膜蛋白。同時,活細胞膜的復雜和動態性質對細胞表面工程提出了巨大挑戰,促使后來發展為簡化模型的合成脂質膜的發展。盡管源自細胞的大囊泡保留了天然膜脂質,蛋白質和糖類的一部分,但缺乏細胞的自我適應性,因此無法與細胞的生理過程聯系起來。
成果簡介
有鑒于此,湖南大學的譚蔚泓和邱麗萍等研究人員直接在細胞表面工程化DNA納米結構,以研究其與細胞活性協同作用的動態行為。研究人員研究出基于DNA的膜蛋白動態模擬,用于編程自適應細胞相互作用。成果發表在 JACS 期刊上。

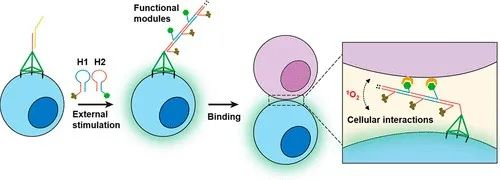
DNA四面體穩定錨定細胞膜
研究人員設計了一種細胞表面納米結構,該結構可實現分子識別引發的DNA組裝,以模仿膜蛋白的動態行為,從而能夠響應環境變化而操縱細胞相互作用。為了實現該目標,主要要求是在細胞膜上設計具有高錨定穩定性和最小的生物干擾的結構。利用出色的機械剛度和幾何穩定性,DNA四面體在表面工程中引起了廣泛的關注。該課題組先前在2019年時候,已經成功地合成了具有三個疏水性頂點(稱為T-cho3)的DNA四面體,并證明了它們在細胞表面工程中的出色表現。通過使用T-cho3作為支架,動態DNA納米結構可以有效,穩定地錨定在活細胞膜上。當時的成果同樣是發表在JACS上。奇物論對其進行了報道(詳情點擊:湖南大學譚蔚泓/邱麗萍JACS:DNA納米平臺用于編程細胞相互作用)

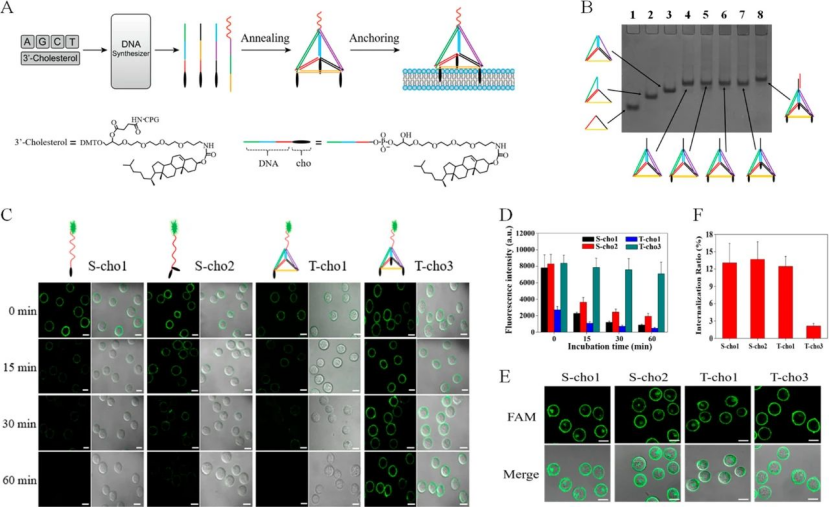
圖|T-cho3的形成和細胞膜修飾的示意圖
多種功能模塊組裝到細胞膜
暴露于外部刺激后,細胞將啟動一系列細胞內程序,以通過例如分泌特定信號分子來產生調節反饋。這些分泌的信號分子可以通過鏈置換反應激活膜錨定的納米結構,從而通過雜交鏈反應(HCR)導致功能核酸在細胞表面串聯自組裝。通過這種方式,可以合并多個功能模塊來調解單元與外部環境之間的交互。結果表明,這種膜錨定的DNA納米結構可以被細胞對外界刺激的響應信號特異性激活。多種功能模塊可以組裝到細胞膜上,使細胞具有細胞類型特異性結合和殺傷。
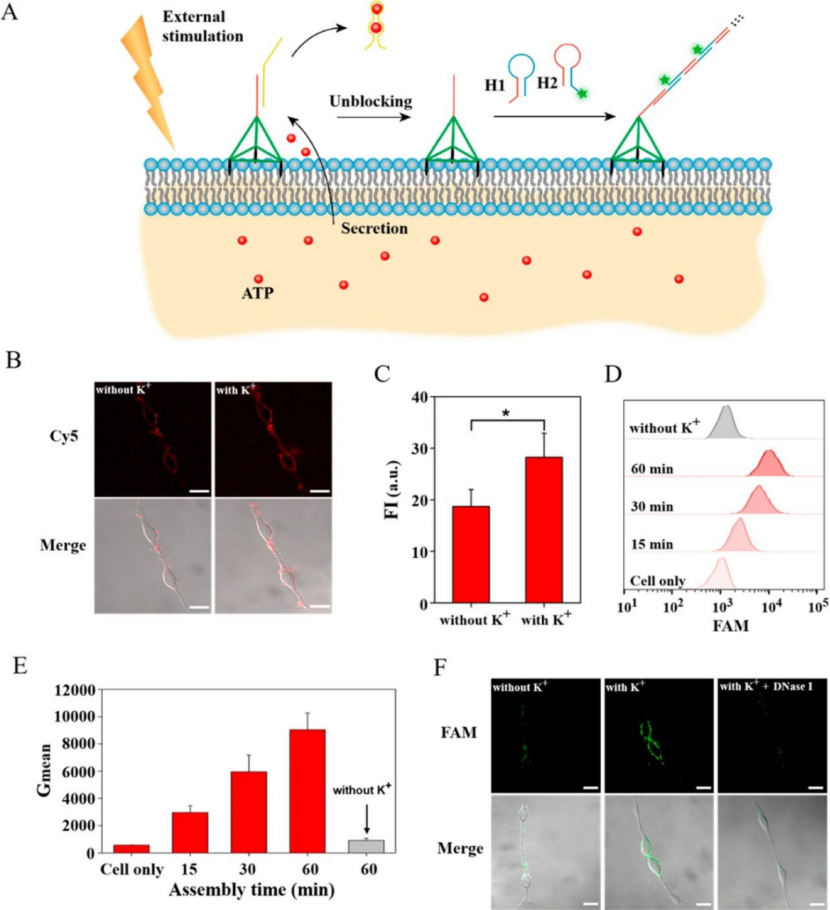
圖|細胞膜上DNA納米組件的細胞適應性構建示意圖
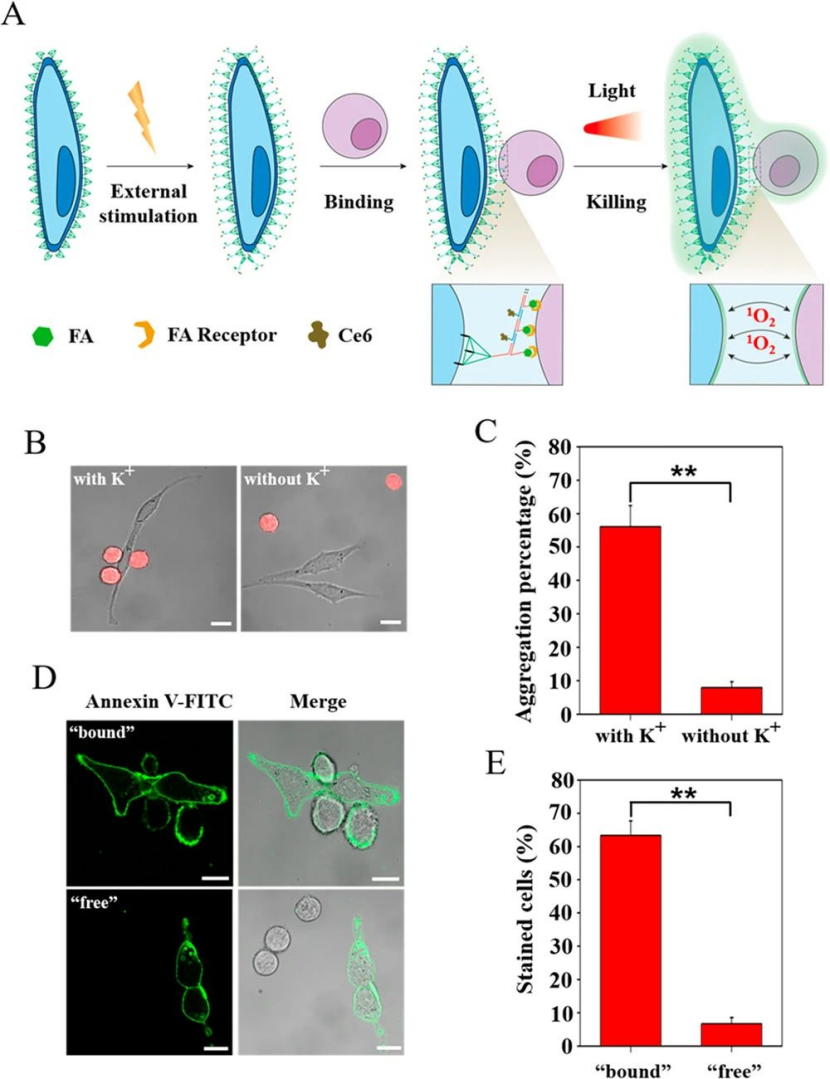
圖|動態納米結構介導的細胞間相互作用的示意圖
小結
本文首次構建了膜錨定的動態DNA納米結構,以模擬膜蛋白的功能行為并協調細胞活性,從而能夠響應環境提示而操縱細胞之間的相互作用。通過使用兩親性DNA四面體作為支架,該DNA納米結構可以有效且穩定地錨定在細胞膜上,且探針的脫落和內化頻率低,從而為在活細胞系統中的生物學應用提供了可靠的平臺。通過感知細胞對環境刺激的適應性反應,可以激活這種膜錨定的納米結構,然后通過串聯DNA雜交(即HCR反應)并入多個功能模塊。得益于模塊化設計和核酸化學的快速發展,該平臺可以擴展為模擬和操縱各種生物事件(例如,細胞適應和交流),為定制細胞工程和智能合成生物學提供了新的范例。
參考文獻:
Jin Li, et al. DNA-Based Dynamic Mimicry of Membrane Proteins for Programming Adaptive Cellular Interactions. JACS, 2021.
DOI:10.1021/jacs.0c11245
https://pubs.acs.org/doi/10.1021/jacs.0c11245











