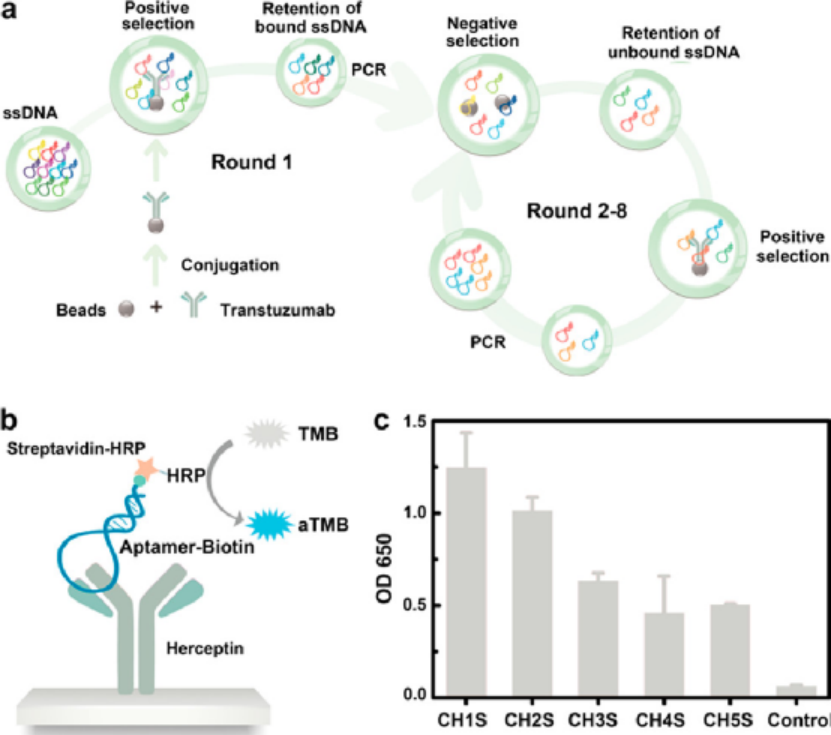
奇物論聯合納米人編輯部對2020年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是中國科學院院士,發展中國家科學院院士,歐洲科學院院士譚蔚泓教授的課題組。譚蔚泓院士長期致力于生物分析化學,化學生物學和分子醫學方面的研究,目前已在國際國內知名學術刊物上發表學術論文650余篇,H-index 137,引用近64,000多次。在核酸適體、分子識別、納米生物傳感等領域做了大量系統的原創性工作,主要包括:1)提出了核酸適體活細胞篩選的新方法,利用獲得的分子探針實現了癌癥等多種重大疾病細胞的特異性識別,為解決細胞研究缺乏分子探針的難題開辟了全新的途徑;2)探索了分子醫學,納米生物學和化學生物學的交叉研究新方向,開發了DNA膠束、DNA水凝膠等生物納米新材料;3)提出多種高靈敏、高時空分辨納米生物傳感方法,在國際生物分析化學領域有著重要的影響。下面對譚蔚泓院士課題組2020年的部分研究成果進行匯總,供大家學習交流。(文章以通訊作者為主,因學術水平有限,如有表述不當,敬請批評指正。)1. Nature Chemistry:打造更智能納米載體(點擊深度解讀)
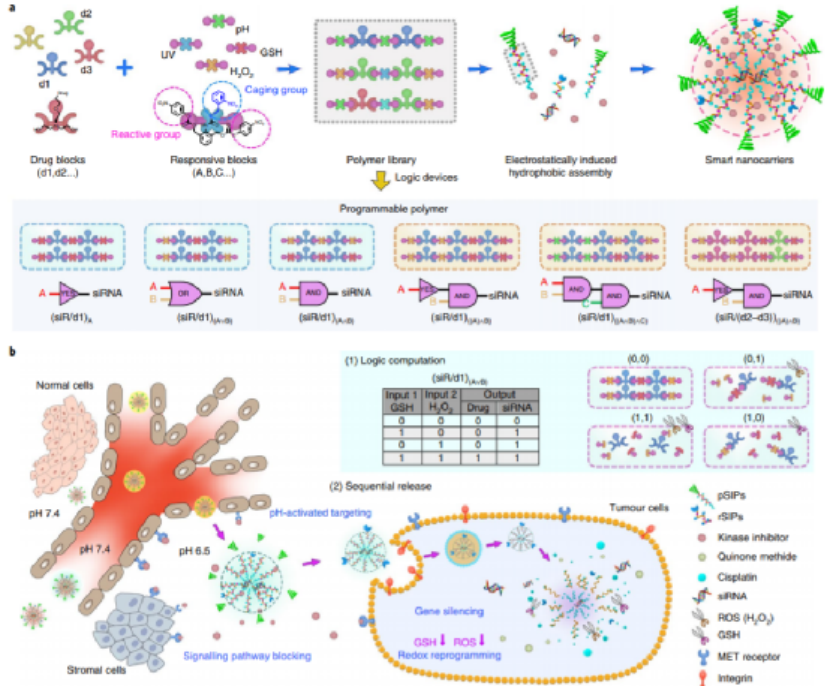
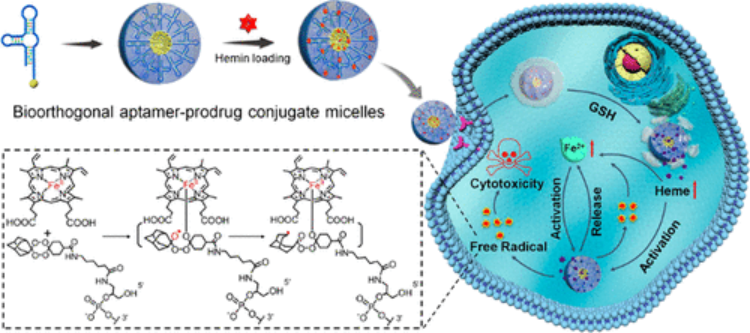
包含邏輯門的刺激響應性生物材料具有巨大的潛力,可作為臨床療法的一部分來檢測和響應病理標記。但到目前為止,沒有一個通用系統能像樂高積木一樣,將多個響應單元合理地組裝成具有邏輯門和層次結構的程序化設備,使系統能夠自由地接收信號并產生輸出,用于體內生物計算和多療法的特定部位遞送。有鑒于此,湖南大學譚蔚泓院士、西安交通大學徐峰教授和南京大學朱俊杰教授等人構建了具有標準化單體和藥物嵌段的可編程聚合物庫,以設計具有層次結構和邏輯門的智能納米載體(SNC),用于組合腫瘤治療。1)首先合成了一系列對紫外光、可見光、過氧化氫、谷胱甘肽(GSH)、酸性pH值(pH=5.0)、酯酶和磷酸酶有反應的單體。利用自降解(self-immolative)化學方法將單體設計成具有相似結構和反應活性的反應塊。2)制備了一個自降解聚合物(self-immolativepolymers, SIPs)庫,該庫由一個pH可切割的PEG頭、一個可編程的疏水體和一個帶正電的聚乙烯亞胺(PEI)尾組成,并通過靜電誘導疏水組裝(EIHA)將其組裝成具有邏輯門和層次結構的程序化SNCs,以期實現生物計算能力并順序釋放多種療法。3)通過合理的設計,研究人員利用腫瘤微環境中的病理線索,通過質子化、腫脹和降解來調控納米載體的體內行為,從而更精確地控制靶向性和藥物釋放。Zhang,P., et al. Aprogrammable polymer library that enables the construction ofstimuli-responsivenanocarriers containing logic gates. Nat. Chem. (2020).https://doi.org/10.1038/s41557-020-0426-32. JACS: 環型Tau-轉鐵蛋白受體雙功能適體對Tau病治療的促進作用血腦屏障(BBB)穿透能力的缺乏阻礙了許多治療tau病藥物的應用。于此,譚蔚泓等人報道了一種環狀雙功能適體的合成,以提高體內BBB的滲透性,從而更好地治療tau病。環狀適配體由一個已報道的轉鐵蛋白受體(TfR)適配體和一個Tau蛋白適配體組成,前者促進TfR適配子識別誘導的BBB內皮細胞跨細胞轉運,后者是該課題組最近選擇的抑制Tau磷酸化和腦內其他Tau病相關病理事件的適配體。Xiaowei Li, et al., Enhanced in Vivo Blood–Brain Barrier Penetration by Circular Tau–Transferrin Receptor Bifunctional Aptamer for Tauopathy Therapy. Journal of the American Chemical Society 2020 142 (8), 3862-3872DOI: 10.1021/jacs.9b114903. JACS:生物正交適配體-前藥共軛膠束分子自組裝—癌癥化學動力學治療新策略化學動力學療法(CDT)通過對失調的腫瘤自由基穩態的特異性調控,為選擇性和邏輯性癌癥干預提供了新的可能性。目前的CDT方法很大程度上依賴于經典的Fenton或Haber-Weiss化學反應將內源性過氧化氫(H2O2)轉化為劇毒的羥基自由基。然而,它們的抗癌效果卻受到極大限制,包括它們需要強酸性來進行高效的化學反應,同時腫瘤中H2O2不足以及增強抗氧化防御以對抗自由基引起的氧化損傷等。在此,湖南大學譚蔚泓、劉艷嵐等人提出了一種新的概念,將生物正交化學和前藥相結合創建了一種新型的適配體藥物結合物(ApDC):適配體-前藥共軛物(ApPdC)膠束,用于改善和癌癥靶向的CDT。1)疏水性前藥堿基不僅可以促進適配體的自組裝,而且還可以通過生物正交化學作為自由基生成劑。2)深入的機理研究表明,與傳統的CDT系統不同,ApPdC膠束能夠通過級聯生物正交反應在癌細胞中原位激活和自循環產生有毒的C-中心自由基,而不依賴于H2O2或pH,同時由于GSH的耗竭而降低了癌癥的抗氧化作用,從而實現了協同CDT效應。預計這項工作能為癌癥靶向治療的設計和自由基相關分子機制的研究提供新見解。WenjingXuan, Yinghao Xia, Ting Li, et al. Molecular Self-Assembly of BioorthogonalAptamer-Prodrug Conjugate Micelles for Hydrogen Peroxide and pH-IndependentCancer Chemodynamic Therapy. J. Am. Chem. Soc., 2019.https://doi.org/10.1021/jacs.9b107554. ACS Nano:分層制備DNA線框納米結構用于有效的腫瘤成像和靶向治療
雖然小分子藥物在癌癥治療中起著至關重要的作用,但其固有的問題如溶解度差和系統毒性,已大大降低了它們的抗癌功能,并產生了不必要的副作用。為了達到令人滿意的治療效果,必須開發新的靶向系統,以精確有效地輸送抗癌藥物。在此,湖南大學譚蔚泓院士、王雪強,埃默里大學Yonggang Ke等人應用一個分層自組裝策略,制造了一個由DNA八面體線框和Sgc8c適體功能化化學藥物組成的核-殼納米結構。 1)DNA納米結構整體增強滲透和滯留效應,以及Sgc8c適體的主動靶向能力使其具有高選擇性的化學藥物輸送,并可實現體內有效的成像和治療。2)該多功能納米結構的優勢進一步突出,其令人印象深刻的血清穩定性,優良的蓄積能力,深穿透能力,顯著提高治療效果和良好的生物安全性。這項研究顯示了這種核-殼DNA納米結構在精確的藥物載量控制、藥物輸送和個性化醫藥方面的潛在應用能力。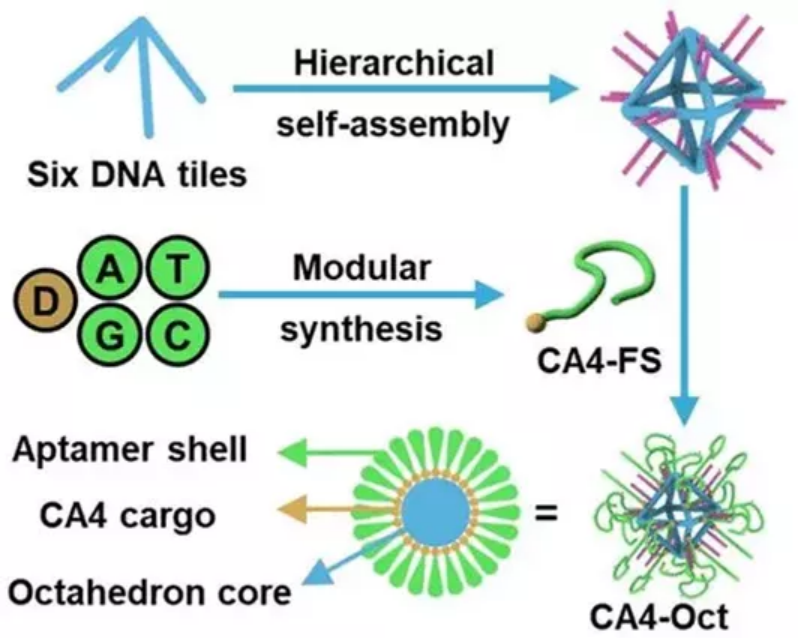
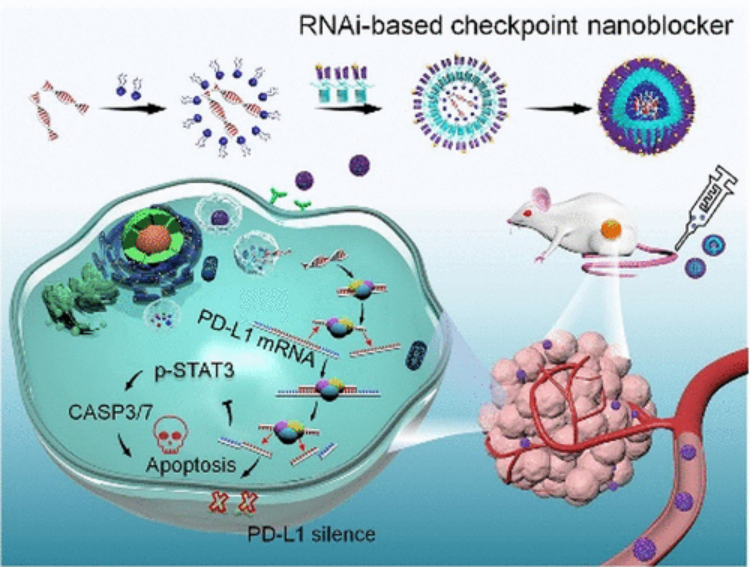
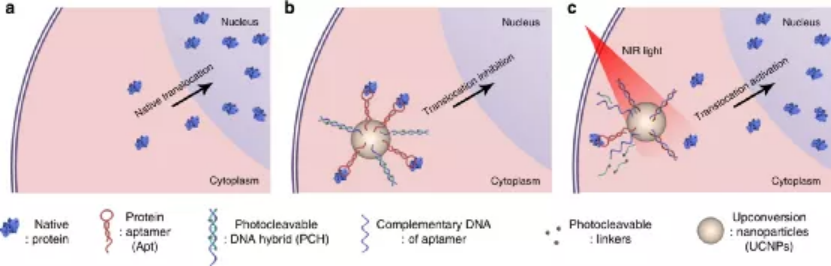
Dan Wang, et al. Hierarchical Fabrication of DNA Wireframe Nanoarchitectures for Efficient Cancer Imaging and Targeted Therapy, ACS Nano, 2020.DOI: 10.1021/acsnano.0c07495https://doi.org/10.1021/acsnano.0c074955. ACS Nano:超越阻斷:工程RNAi介導的靶向免疫檢查點納米阻斷劑使T細胞非依賴性癌癥治療成為可能過去十年來,免疫檢查點阻斷激活宿主T細胞攻擊腫瘤細胞的出現徹底改變了癌癥治療領域的前景。但是,僅少數患者實現了持續反應,這可歸因于生理障礙,如T細胞異質性和免疫抑制性腫瘤微環境。此外,傳統抗體驅動的阻斷方法還存在一些固有的障礙,包括無法抑制檢查點從細胞質中轉移,全身性免疫毒性以及對T細胞的“咬回”效應。有鑒于此,湖南大學譚蔚泓、劉艷嵐等人以非小細胞肺癌(NSCLC)作為癌癥模型,通過RNAi納米工程技術,為T細胞非依賴性腫瘤治療提供了一種非常規的、功能強大的腫瘤靶向檢查點阻斷策略。1)與抗體不同,這種納米阻滯劑可以沉默癌細胞膜和胞漿中的PD-L1,從而消除結合步驟。2)此外,納米阻斷劑沉默PD-L1會導致NSCLC H460細胞的直接程序性細胞死亡,而無需T細胞干預。3)異種移植腫瘤模型的體內結果進一步證明,與非靶向組相比,腫瘤歸巢肽修飾使納米阻斷劑能夠在腫瘤組織中蓄積,下調PD-L1表達并更有效地抑制腫瘤生長。綜上所述,這些發現可能為克服傳統檢查點封鎖的障礙提供有效手段,并為免疫療法的分子機制提供不同見解。Xiaoyan Han, et al. Beyond Blocking: Engineering RNAi-Mediated Targeted Immune Checkpoint Nanoblocker Enables T-Cell-Independent Cancer Treatment. ACS Nano, 2020.DOI: 10.1021/acsnano.0c08022https://doi.org/10.1021/acsnano.0c080226. Nature Commun.:基于適配體的光學操作用于亞細胞定位蛋白質隨著光遺傳學的發展,人們可以利用分子特異性對細胞蛋白質進行時空控制,然而,這些方法需要融合蛋白的重組表達,可能導致相互矛盾的結果。于此,譚蔚泓院士等人致力于設計一個可調的識別單元,并開發一個基于適體的近紅外(NIR)光響應納米平臺,用于操縱特定蛋白質在其自然狀態下的亞細胞定位。研究結果表明,這個納米平臺允許光控制靶RelA蛋白(NF-κβ家族的一員)的胞質-核穿梭行為,從而調控RelA相關的信號通路。通過模塊化設計,這種基于核酸適體的納米平臺可以很容易地擴展到不同蛋白質(如溶菌酶和p53)的操作,具有開發多種無標記蛋白質光調節策略研究復雜生物事件的巨大潛力。Xie, S., Du, Y., Zhang, Y. et al. Aptamer-based optical manipulation of protein subcellular localization in cells. Nat Commun 11, 1347 (2020).https://doi.org/10.1038/s41467-020-15113-27. JACS: 適體作為用于抗體生產監控和質量控制的多功能分子工具抗體藥物已被用于治療多種疾病,并且迄今為止,這已成為增長最快的藥物類別。然而,缺乏用于抗體生產和質量控制的實時和高通量監測的合適方法一直是抗體藥物或生物仿制藥進一步發展的障礙。因此,譚蔚泓等人報告了一種多功能工具,可通過使用通過體外SELEX方法選擇的適體探針對抗體產生進行一步熒光監測。在這種情況下,針對人源化IgG1抗體藥物曲妥珠單抗選擇具有高度特異性和親和力的DNA適體,其適體CH1S-3的Kd值為10.3 nM。更重要的是,獲得的適體能夠區分天然的和熱處理的,而抗體沒有通過這項測試。基于適體快速檢測的優勢,研究人員設計了適體分子信標,可直接和靈敏地檢測復雜樣品中的曲妥珠單抗。與傳統的基于抗體的ELISA不同,在與靶標相互作用后直接觀察到信號,而無需耗時的結合和多個洗滌步驟。為了進一步強調生物醫學應用,還證明了適體作為潛在的工具用于質量控制和抗體藥物的無痕純化。因此,適體被證明是抗體生產監測,質量控制和純化的有前途的替代品,為加速抗體藥物的開發提供了技術支持。Kaiming Chen, et al., Aptamers as Versatile Molecular Tools for Antibody Production Monitoring and Quality Control. Journal of the American Chemical Society 2020 142 (28), 12079-12086DOI: 10.1021/jacs.9b133708. Anal. Chem:pH響應型DNA納米傳感器用于對胞吐和突觸囊泡進行成像
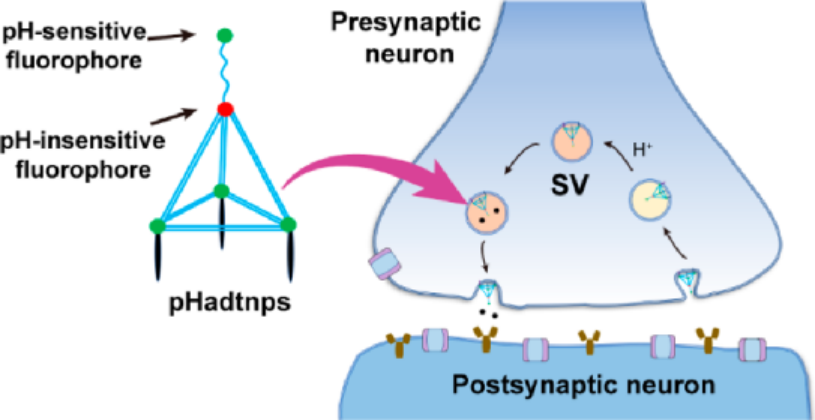
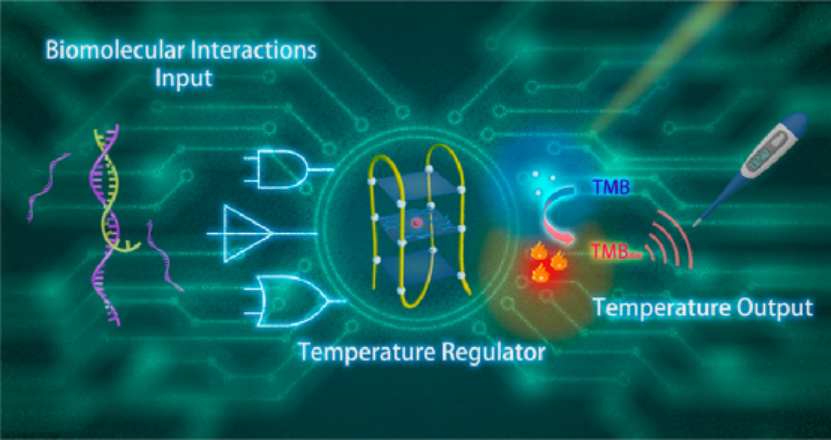
胞吐和突觸囊泡(SVs)的恢復是神經遞質在神經元間傳播的重要步驟。對SVs實現動態的可視化對于闡明突觸傳遞的機制來說具有重要意義。湖南大學邱麗萍教授和譚蔚泓院士合作開發了pH響應型比率DNA四面體納米探針(pHadtnps),它可以對循環工作的SVs進行標記,且具有很高的穩定性和有效的背景抑制作用。1) 基于SVs循環過程中腔內pH的變化,pHadtnps能夠實時顯示其胞吐和循環過程。2) 此外,由于DNA納米技術的可編程性,這些納米探針可以靈活地配備不同的功能部件,進而為開發研究神經網絡中的各種通用工具提供重要的幫助。Chao Liu. et al. Programmable pH-Responsive DNA Nanosensors for Imaging Exocytosis and Retrieval of Synaptic Vesicles. Analytical Chemistry. 2020DOI: 10.1021/acs.analchem.9b04493http://pubs.acs.org/doi/10.1021/acs.analchem.9b044939. JACS:溫度輸出人工DNA信號網絡轉導復雜的生物分子相互作用定量信息讀取需要昂貴的專用儀器,這嚴重限制了先進人工網絡從構思到執行的可持續發展。于此,湖南大學譚蔚泓、劉艷嵐向進化的信號網絡范例邁出了一步,該網絡能夠將復雜的信號信息轉換為易于閱讀的溫度輸出。將DNA分子工程學與基本光學機制相結合,建立了DNA / Hemin復合物衍生的通用溫度輸出傳感器,該傳感器可與其他功能模塊結合,通過對DNA化學反應的動態編程來制造各種便攜式DNA信號網絡。通過構建自擴增和基于邏輯電路的DNA信號網絡以使用溫度計監測痕量和多位核酸相互作用,已成功證明了其多功能性。這種價廉但功能強大的DNA信號網絡設計可能預示了即時護理的信號網絡方法的時代。Lei He, et al., Transducing Complex Biomolecular Interactions by Temperature-Output Artificial DNA Signaling Networks. Journal of the American Chemical Society 2020 142 (33), 14234-14239DOI: 10.1021/jacs.0c0545310. Nature Commun.: DNA人工分子信號系統模仿接收和響應的基本要素
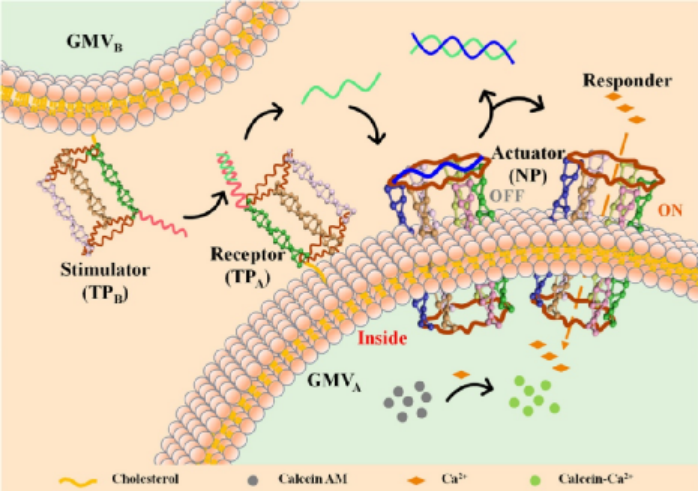
為了維持組織的動態平衡,細胞通過接收分子信號、傳遞信號并相應地響應信號傳導途徑來與外界環境進行通訊。因此,在工程分子信號系統中,一個關鍵的挑戰是將不同的模塊設計和構建形成一個合理集成的系統,以模擬分子事件的級聯。于此,湖南大學譚蔚泓院士、張曉兵和Qiaoling Liu等人合理地設計了一種基于DNA的人工分子信號系統,該系統使用了來自活細胞的巨大囊泡的受限微環境。1) 這個系統由兩個主要部分組成。首先,研究人員構建了由三磷酸腺苷(ATP)驅動的DNA nanogatekeeper。其次,研究人員在仿生囊泡中封裝了一個信號網絡,該網絡由不同的模塊組成,能夠依次啟動一系列的下游反應,起到接收、轉導和反應的作用。2) 操作上,在存在ATP的情況下,nanogatekeeper從關閉狀態切換到打開狀態。然后,打開狀態觸發受限下游信號模塊的順序激活。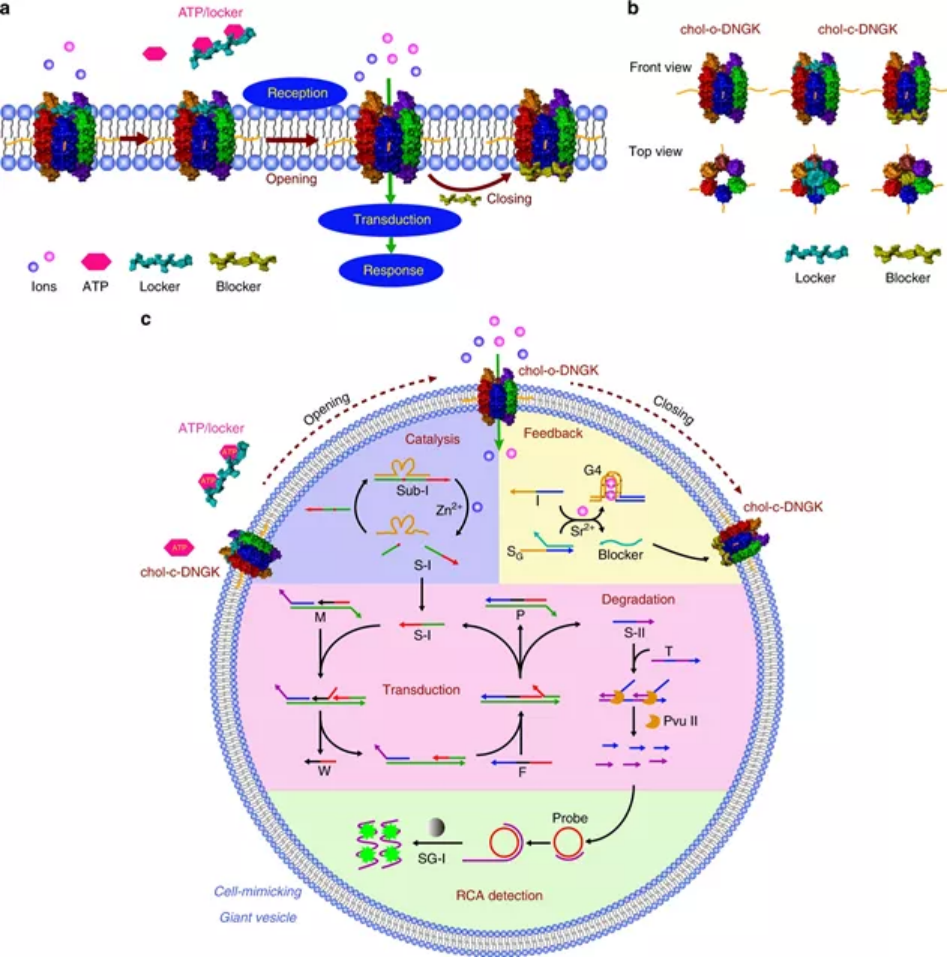
Peng, R., Xu, L., Wang, H. et al. DNA-based artificial molecular signaling system that mimics basic elements of reception and response. Nat Commun 11, 978 (2020).https://doi.org/10.1038/s41467-020-14739-611. JACS:人工細胞間合成級聯跨膜通道開關活性的級聯信號網絡細胞-細胞通訊在生物活動中起著至關重要的作用,尤其是膜-蛋白質的相互作用意義深遠。為了探索細胞間信號通路的潛在機制,人們探索了一整套人工系統。然而,其中許多是復雜和不可控的。鑒于此,湖南大學譚蔚泓院士、劉巧玲等人設計了一種人工信號轉導系統,通過激活固定在巨膜囊泡(GMV)上的合成跨膜通道來控制環境離子的流入。 來自一個GMV群體(GMVB)的膜蛋白樣刺激劑刺激另一個GMV群體(GMVA)上的受體釋放ssDNA信使,從而激活合成跨膜通道,使離子能夠流入。反過來,此事件會觸發封裝在GMVA原始細胞模型中的信號響應。通過模擬自然的信號轉導途徑,這個新的原型為研究細胞間的通訊提供了一個可行的工具,擴展了生物信號系統,并探索了解決涉及材料科學、化學和醫學的科學問題的有用平臺。Qiuxia Yang, et al., ACascade Signaling Network between Artificial Cells Switching Activity ofSynthetic Transmembrane Channels. Journal of the American Chemical SocietyArticle 2020.DOI: 10.1021/jacs.0c09558https://pubs.acs.org/doi/full/10.1021/jacs.0c0955812. Angew綜述:核酸適配體用于分子診斷和治療
湖南大學蔣健暉教授和譚蔚泓院士對用于分子診斷和治療的核酸適配體相關研究進展進行了綜述總結。1)SELEX(指數富集的配基系統進化技術)的出現使得人工配體可以具有親和力和特異性,進而能夠滿足日益增長的臨床需求。2)作為一種分子識別工具,抗體是許多研究和應用都會采用的常規選擇,而適配體因其具有體積小、成本低和易化學修飾等獨特優勢可以有效地對抗體的使用。作者也將綜述的重點集中于對核酸適配體和SELEX的應用進行介紹,并對它們在生物醫學領域進行臨床應用的前景進行了展望。Long Li. et al. Nucleic Acid Aptamers for Molecular Diagnostics and Therapeutics: Advances and Perspectives. Angewandte Chemie International Edition. 2020DOI: 10.1002/anie.202003563https://onlinelibrary.wiley.com/doi/10.1002/anie.20200356313. NSR:脂質寡核苷酸結合物的生物應用
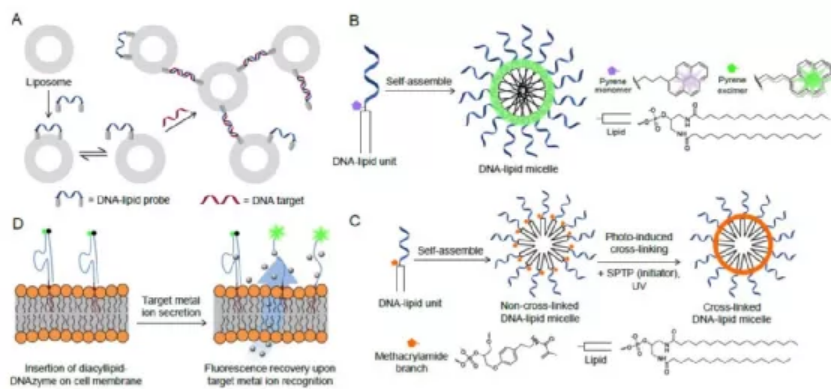
脂質-寡核苷酸綴合物(LONs)是功能強大的分子工程材料,可用于從生物傳感器到生物醫學的各種應用。它們獨特的兩親結構使自組裝和高保真信息傳遞成為可能。特別是,LON在測量細胞機械力和監測細胞行為方面具有巨大潛力。LON也是用于細胞內成像的必不可少的傳感工具,并已被用于開發用于仿生工程研究的細胞表面錨定的DNA納米結構。當摻入治療性寡核苷酸或小分子藥物時,LON有望用于靶向治療。此外,LONs基于DNA鏈位移來介導囊泡的可控組裝和融合,從而有助于納米反應器的構建和大分子的輸送。在這篇綜述中,湖南大學譚蔚泓院士總結了LON的一般合成策略,提供一些表征分析,并強調生物分析和生物醫學應用的最新進展。還將考慮相關挑戰,并為在納米技術和材料科學應用中構建更好的功能性LON提出未來的方向。Xiaowei Li, et al., Lipid-oligonucleotide conjugates for bioapplications. National Science Review, nwaa161, 2020.https://doi.org/10.1093/nsr/nwaa16114. Nanoscale綜述:多參數激活的納米器件用于癌癥成像和治療
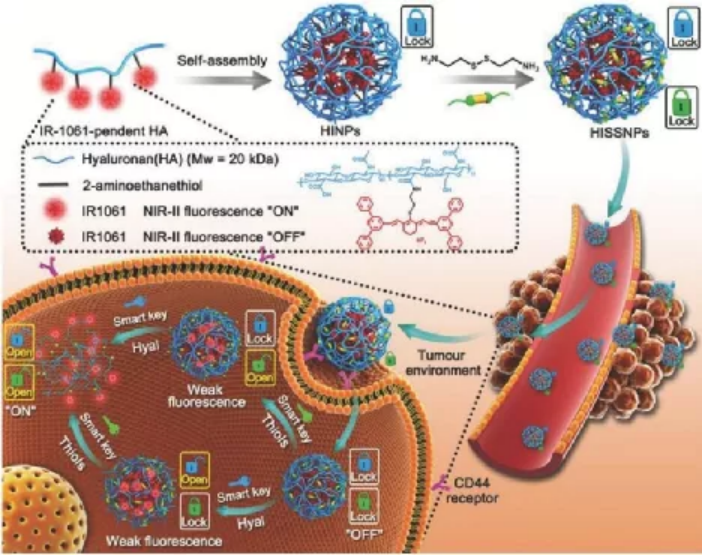
湖南大學Cheng Cui和譚蔚泓院士對可被多參數激活的納米器件及其在癌癥成像和治療領域中的應用相關研究進展進行了綜述。1)對腫瘤微環境響應的納米器件是一種用于腫瘤成像和治療的重要工具。近年來,得益于分子工程的發展,納米器件在生物醫學中的應用如雨后春筍般涌現。在靶向癌癥區域后,納米器件會首先對TME產生響應,然后作為傳感、成像和治療的致動器。目前,大多數納米設備都只依賴于單個參數作為下游激活的輸入信號,這往往會導致不準確的診斷結果和較差的治療結果。然而,在TME中的一些生物標記物是相互關聯的,而這些相關的生物標記物在癌癥成像和診療應用中也有重要的用處。基于這一現象,研究人員開發并構建一些可被多參數激活的納米器件(MANs)以提高診療的精確度。2)作者在文中綜述了近年來MANs在熒光成像、光聲成像、磁共振成像和計算機斷層掃描成像以及放射治療、化療、光學治療和免疫治療等癌癥治療方面的研究進展,重點強調了利用不同的方法來提高對腫瘤診療的特異性以及精確性。并對該領域的發展進行了展望。Huarong Bai. et al. A Minireview on Multiparameter-activated Nanodevices for Cancer Imaging and Therapy. Nanoscale. 2020https://pubs.rsc.org/en/content/articlelanding/2020/nr/d0nr04080k#!divAbstract脫氧核糖核酸(DNA)是一種有前途的合成器,可精確地構建二維和三維的幾乎任意幾何形狀。在各種基于DNA的軟材料中,DNA水凝膠由交聯的DNA鏈的親水性聚合物網絡組成。由于其生物相容性,孔隙率,序列可編程性和可調多功能性的特性,DNA水凝膠已在生物分析和生物醫學中得到了廣泛的研究。在這篇綜述中,湖南大學譚蔚泓院士和上海交通大學宋杰等人著重介紹了DNA水凝膠的最新發展及其在藥物遞送系統中的應用。首先,介紹了用于構建DNA水凝膠的物理和化學交聯方法。隨后,描述了DNA水凝膠對非生物和生物刺激的反應。最后,詳細介紹了基于DNA水凝膠的不同類型藥物的遞送平臺。隨著基因療法的出現,這篇綜述也為將DNA水凝膠與基因編輯工具箱結合在一起提供了未來的前景。Fangli Mo, et al. DNA hydrogel-based gene editing and drug delivery systems. Advanced Drug Delivery Reviews, 2020.由于篇幅有限,譚蔚泓院士2020年的研究成果較多,暫不在此一一展示,有興趣的讀者可自行前往學術網絡搜索閱讀。
譚蔚泓院士極注重為師育人之道,他認為:“教書育人是老師的天職,其他的事都應該放在這個之后”。此外,“快樂科研”是譚蔚泓教授科研團隊的口號,也是他個人的職業信條和人生理念,“做自己喜歡做的事,才會快樂。”
他相信:“我們的工作就是為學生們打造一個平臺,在這個平臺上,每一位學生的潛能都會得到最大程度的發揮”。同時,譚蔚泓教授秉持開放合作胸懷,在他眼里,每一位為科學研究執著努力的人,都是懷揣夢想的同路人。(摘自來自湖南大學官網)
最后以譚蔚泓教授實驗室標語共勉:
Work Hard,Work Smart,Work Together,Be Happy
譚蔚泓,現任教育部科技委員會委員,國家自然科學基金委化學部咨詢委員會委員,科技部納米研究計劃專家委員會委員,中國化學會副理事長等。曾任JACS 和Analytical Chemistry副主編。譚蔚泓教授2005年當選美國AAAS Fellow,2015年當選中國科學院院士,2016年當選發展中國家科學院院士,2019年被選為歐洲科學院院士。