納米人編輯部對2020年國內外重要科研團隊的代表性重要成果進行了梳理,今天,我們要介紹的是中國科學院院士,上海交通大學樊春海教授課題組。樊春海,上海交通大學化學化工學院王寬誠講席教授,中國科學院院士。主要研究方向為生物傳感與成像、DNA納米技術與DNA計算和生物光子學。以下對樊春海院士研究團隊2020年的部分研究工作進行歸納,供大家學習交流
Nature Chemistry:新型DNA折紙,改變DNA納米技術世界!
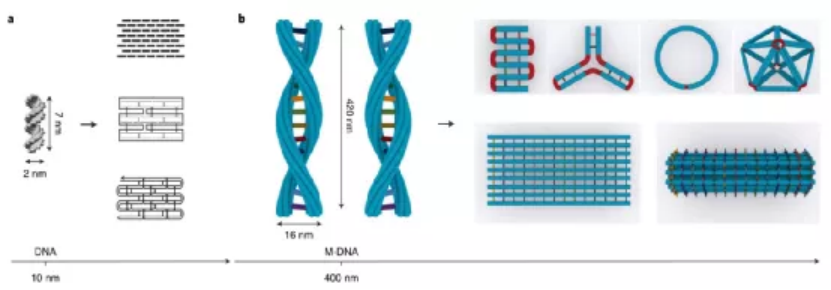
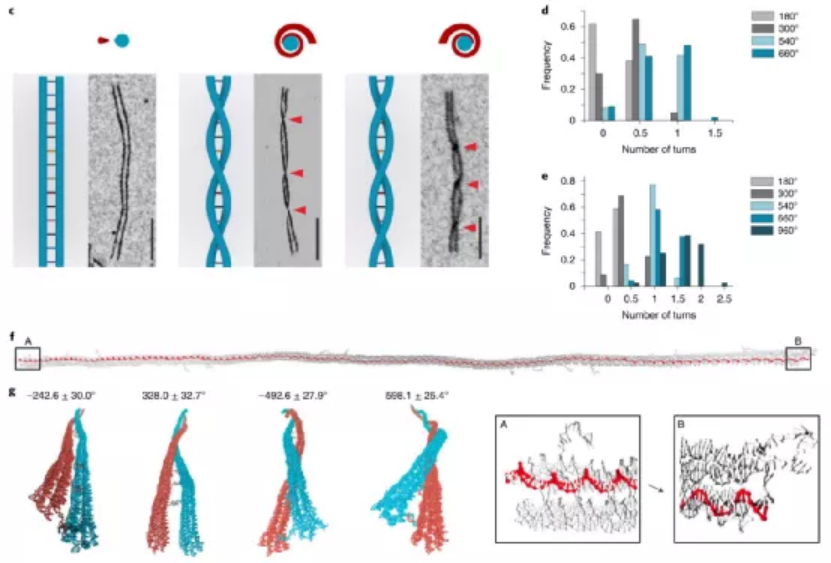
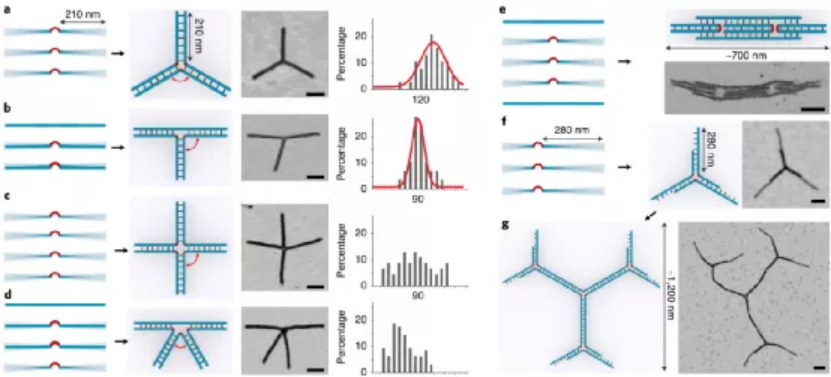
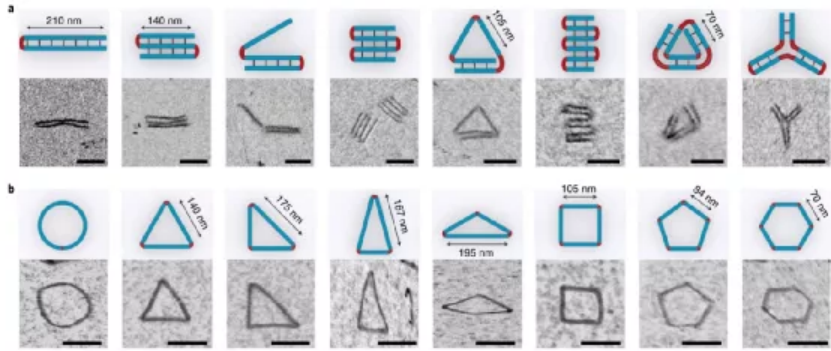
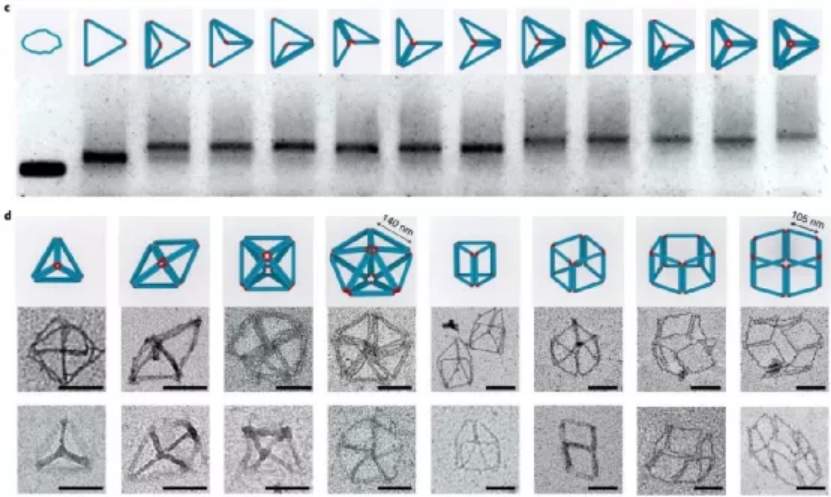
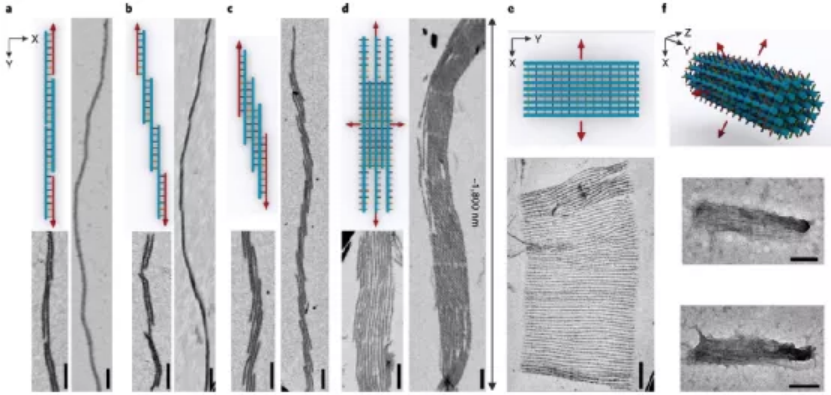
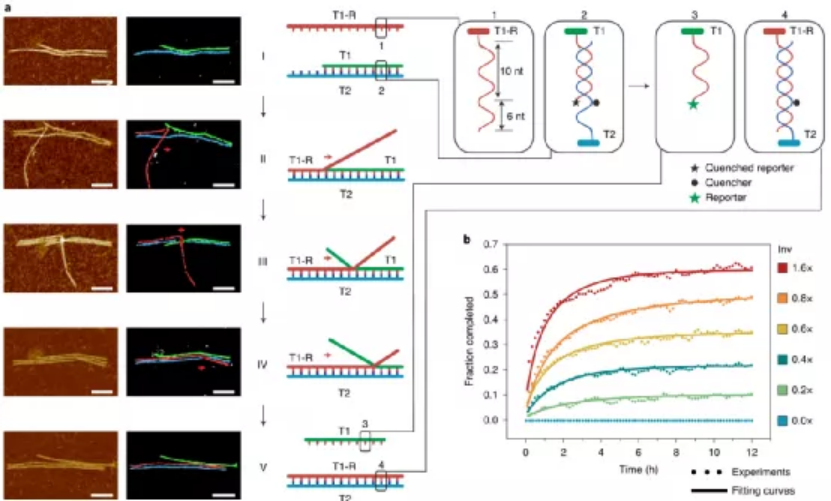
目前,據報道有兩種策略可以構建微米級的DNA結構。一種方法是以支架為原始材料繼續增大成更大的DNA折紙。另一種方法是使用粘性末端內聚或平末端堆疊將單個折紙結構連接在一起。每一個微米級的DNA結構通常需要一個或幾個不同大小、形狀和規定的匹配規則的獨特DNA折紙。那能否先構建一個多功能的亞微米的3D構建塊,從而進一步構建出微米尺度的DNA物件呢?鑒于此,美國亞利桑那州立大學顏灝教授、上海交通大學樊春海院士等人開發了一種通用的“元DNA”(M-DNA)策略,該策略允許各種亞微米到微米大小的DNA結構以類似于在納米級水平上簡單的短DNA鏈自組裝的方式進行自組裝。研究人員僅使用一種類型的DNA單元即可構建各種各樣的靜態和動態亞微米和微米尺度的DNA結構,這將打開光電子學(包括信息存儲和加密)以及合成生物學領域。成果以題為“Meta-DNA structures”發表于Nature Chemistry上。值得注意的是,顏灝教授和樊春海教授曾于2018年合作了關于以DNA折紙為模板制備復雜二氧化硅復合納米材料,發表在Nature期刊上。六螺旋DNA折紙束帶有幾個未配對的DNA探針作為其自身的“堿基”,被設計用作M-DNA單元。該結構具有三個與經典短ssDNA寡核苷酸相似的特性。1)首先,M-DNA可以與其互補的M-DNA形成具有特定“堿基對”的“鍵”。M-DNA的堿基(M-堿基)由一組十個核苷酸(nt)長的ssDNA突出端組成,該突出端設計為從M-DNA上的特定位置延伸。M-堿基可以用多達410個不同的序列進行編程,這使得該結構能夠在互補的M-堿基對之間提供足夠的正交相互作用。2)其次,M-DNA相對較硬,持續長度約為2μm。從選定的位置去除一些鏈可獲得可調的局部柔韌性。這種可編程的靈活性和剛性使M-DNA可以形成不同的幾何形狀。3)第三,M-DNA是3D物體(420 nm × 6 nm × 6nm),具有可用于雜交的M堿基的3D排列,這使得它們能夠組裝成1D、2D和3D結構。具有M堿基螺旋排列的兩個互補M-DNA將自組裝成雙螺旋結構,該結構模仿了雙螺旋DNA的構型。基于M-DNA,通過改變扭轉角和將M堿基的分布手性,研究人員構建了具有不同轉數和不同手性的雙鏈M-DNA(dsM-DNA)。并使用了DNA的粗粒度計算模型來模擬dsM-DNA結構,并了解所獲得的左手和右手結構的不同產量。此外,僅僅通過改變單個M-DNA的局部柔性及其相互作用,就能夠構建從1D到3D的一系列亞微米或微米尺度的DNA結構,具有各種幾何形狀,其中包括元連接(M-連接)、元雙交叉tiles(M-DX)、四面體、八面體、棱柱體以及六種緊密排列的晶格。組裝結構的尺寸范圍從幾百納米到幾微米,其尺寸與先前使用各種DNA折紙構件所建造的微米結構相當。圖|自折疊、自連接的M-DNA結構和自組裝的3D多面體圖|1D、2D和3D M-DNA微米級結構的自組裝除了靜態的自組裝DNA結構外,DNA納米結構的另一個吸引人的特性是它具有可編程的動態重排能力。研究人員初步展示了通過基于M-DNA的層次鏈置換產生的動態反應,這顯示了創建具有動態重新組合的微米級M-DNA結構以及編程M-DNA響應其環境變化的自組裝行為的可能性。在未來,可以使用M-DNA合理設計更復雜的電路、分子馬達和納米器件,并將其用于與生物傳感和分子計算有關的應用中。這項研究將使建立動態的微米級DNA結構變得更加可行。未來的一些發展可能會進一步改善M-DNA組裝方法。例如:1)目前,M-DNA的長度是420nm,則可以通過使用更長或更短的DNA支架分別產生更長或更短的M-DNA。2)現在的M-DNA的形狀是線性的,但也可以通過端到端的自連接將其制成圓形,三角形,矩形和其他多邊形,或用于構建各種多面體和棱柱體。3)此外,這里使用的M堿基是10nt ssDNA,這使最終結構變得多孔,則可以創建其他相互作用,例如較短的M堿基,形狀互補性,i-基序(pH敏感)或光敏分子修飾的寡核苷酸,以建立更剛性或刺激響應的結構。4)還可以使用M-DNA方法來模擬單鏈RNA或蛋白質折疊。通過改變M-DNA上的相互作用點,可以實現更復雜的折疊途徑和構型。綜上所述,該研究演示了一種通用方法,僅使用一種類型的DNA單元即可構建各種各樣的靜態和動態亞微米和微米尺度的DNA結構。M-DNA不僅是擴增的DNA,它還具有其自身的結構特征,并且可以自折疊成各種目標形狀。該方法可能潛在地用于在宏觀規模上創建更多的DNA結構,并以可編程配置來定位功能組件。期望引入M-DNA策略可以將DNA納米技術從納米級轉變為微觀級別。這將在亞微米和微米級別創建一系列復雜的靜態和動態結構,從而能夠在新的應用中使用它。例如,可以將其用作支架,以圖案化比以前更大、更復雜的功能組件。這也可能導致更巧妙的和復雜的行為,以通過結合不同的基于M-DNA的層級鏈置換反應來模擬細胞或細胞成分。M-DNA自組裝概念可能會完全改變結構DNA納米技術的微觀世界。Yao, G., et al. Meta-DNA structures. Nat. Chem. (2020). https://doi.org/10.1038/s41557-020-0539-8
Chem:DNA編碼磷酸鈣礦化
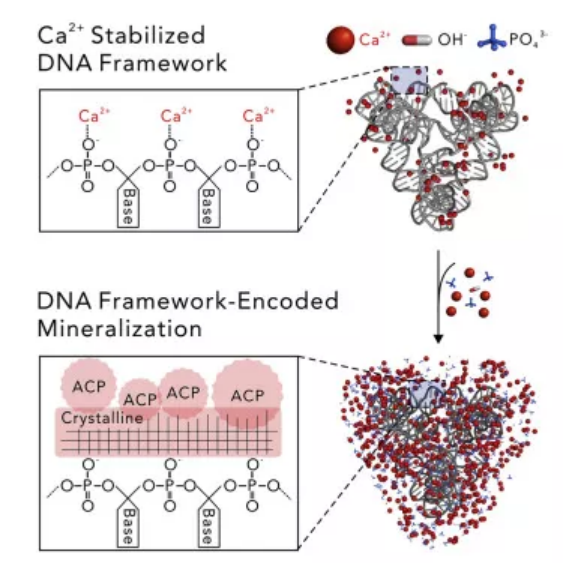
大自然已經進化出可以利用基因編碼的蛋白質支架在各種長度的尺度上生成精致的生物礦物質的獨特策略。然而,設計可編程仿生礦化納米結構的能力仍然有限。有鑒于此,上海交通大學樊春海院士等人報道了自組裝DNA框架可以精確地和多功能地進行編碼磷酸鈣(CaP)的納米礦化。研究人員確定DNA-CaP納米結構的大小和形狀是由DNA序列內編碼的結構信息以及DNA磷酸骨架和礦物對應物之間的靜電相互作用所編程的。該策略的普遍性通過使用二維和三維DNA框架(范圍從?10到?100 nm)得到驗證。研究人員進一步發現CaP礦化固化的DNA骨架可以作為一種可持續的納米藥物在活細胞中傳遞。這些發現為納米級礦化開辟了一條新途徑,其前所未有的復雜體系結構可用于多種用途。Liu X, Jing X, Liu P, Pan M, Liu Z, Dai X, et al. DNA Framework-Encoded Mineralization of Calcium Phosphate. Chem.https://doi.org/10.1016/j.chempr.2019.12.003
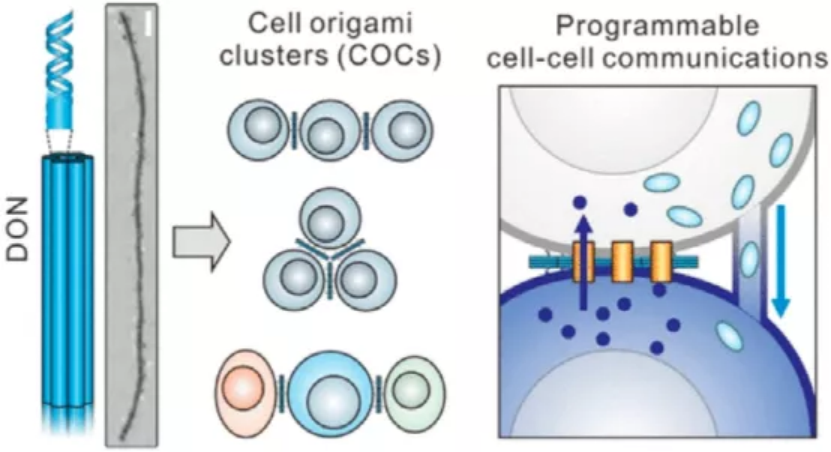
JACS: 工程細胞折紙團簇用于編程細胞間通信
以團簇形式存在的細胞往往表現出與單分散形式不同的生理功能,它們與組織器官發育、免疫反應和腫瘤轉移密切相關。然而,作為探測和操縱細胞間通訊的體外模型,構建人工細胞簇的能力仍然有限。于此,上海交通大學樊春海院士和上海高等研究院李江等人設計了基于DNA折紙納米結構(DON)的仿生膜通道來組織具有受控幾何構型和細胞間通訊的細胞折紙簇(COC)。1)研究證明,不同構型的同型和異型COCs的可編程模式可導致三種不同類型的細胞間通信:間隙連接、隧道納米管和免疫/腫瘤細胞相互作用。2)特別是T細胞和癌細胞按規定的比例和幾何結構組織,可以編程體外免疫應答,為理解和工程化癌癥免疫治療提供了新途徑。Zhilei Ge, et al. Programming Cell–Cell Communications with Engineered Cell Origami Clusters. Journal of the American Chemical Society 2020.DOI: 10.1021/jacs.0c01580https://pubs.acs.org/doi/10.1021/jacs.0c01580
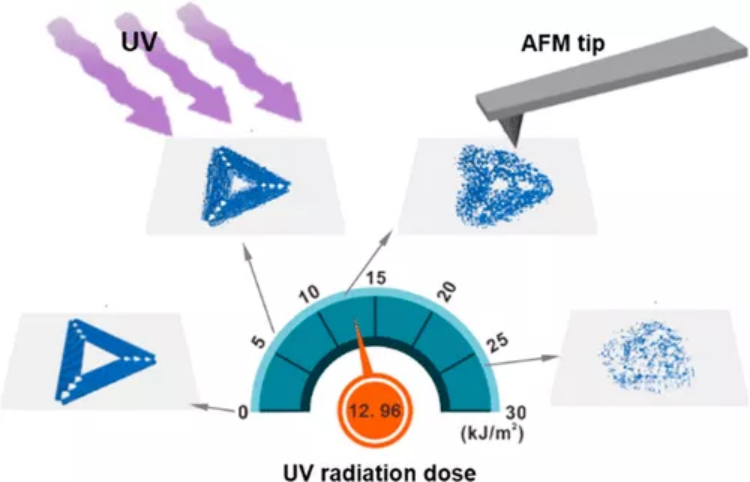
JACS:DNA折紙輻射計,用于測量紫外線暴露
紫外線(UV)長期以來被認為會損害核酸。在這項工作中,中國科學院上海應用物理研究所王麗華和同濟大學柳華杰等人,其中,樊春海院士為共同作者,開發了一個DNA折紙輻射計,通過監測DNA折紙納米結構的形態演變來測量紫外線照射。1)不同于線性DNA鏈在紫外線照射下往往會降解成小段,DNA折紙的結構復雜性和鏈間連接性顯著改變了UV誘導的DNA損傷的途徑。2)對于DNA折紙,無論其形狀和大小,都可以觀察到其膨脹、變形和最終分解的一般途徑;然而,變形動力學與納米結構中的刻痕數量正相關。這種依賴于結構連續性的變形可以轉化為基于DNA的輻射計,用于測量環境中的紫外線劑量。Weina Fang, et al. DNA Origami Radiometers for Measuring Ultraviolet Exposure. Journal of the American Chemical Society 2020.DOI: 10.1021/jacs.0c01254https://pubs.acs.org/doi/10.1021/jacs.0c01254
Nano. Today:血液接觸氧化石墨烯可能會導致非人靈長類動物的過敏性死亡
氧化石墨烯(GO)的毒理學評估一直在積極進行中。然而,氧化石墨烯的安全性在目前仍然存在著很大的爭議,特別是在高等哺乳動物中缺乏對其毒理學特性的研究。中科院上海高等研究院諸穎研究員和上海交通大學樊春海院士研究發現,當血液暴露在低于最大安全起始劑量的GO下,哺乳動物可能會發生意外死亡,包括非人類靈長類動物(1 / 5的獼猴和7 / 121只小鼠),而在其他動物中仍然普遍適用。
1)實驗在死亡動物中發現免疫球蛋白E水平升高以及嚴重的肺損傷,表明氧化石墨烯會引起急性的過敏反應。2)值得注意的是,實驗并沒有觀察到其他兩種碳納米材料(單壁碳納米管和納米金剛石)會引發過敏反應和死亡。這種差異可能是由于二維氧化石墨烯材料在體內的循環時間較長所致。因此,這一研究也充分凸顯了評估石墨烯和其他納米材料過敏性風險的緊迫性。Yunfeng Lin. et al. Blood exposure to graphene oxide may cause anaphylactic death in non-human primates. Nano Taday. 2020https://www.sciencedirect.com/science/article/pii/S1748013220300918
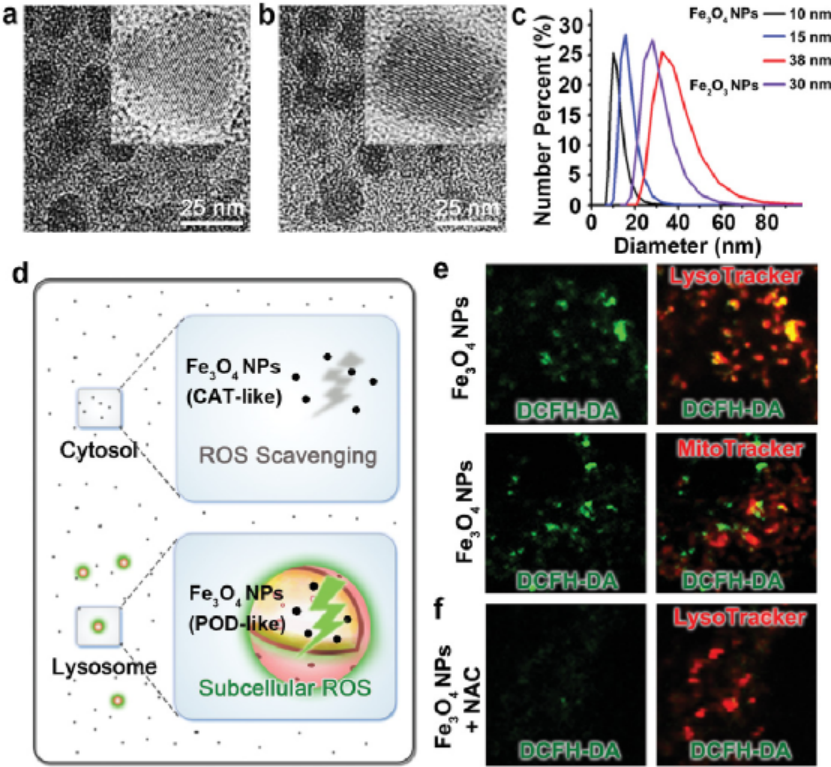
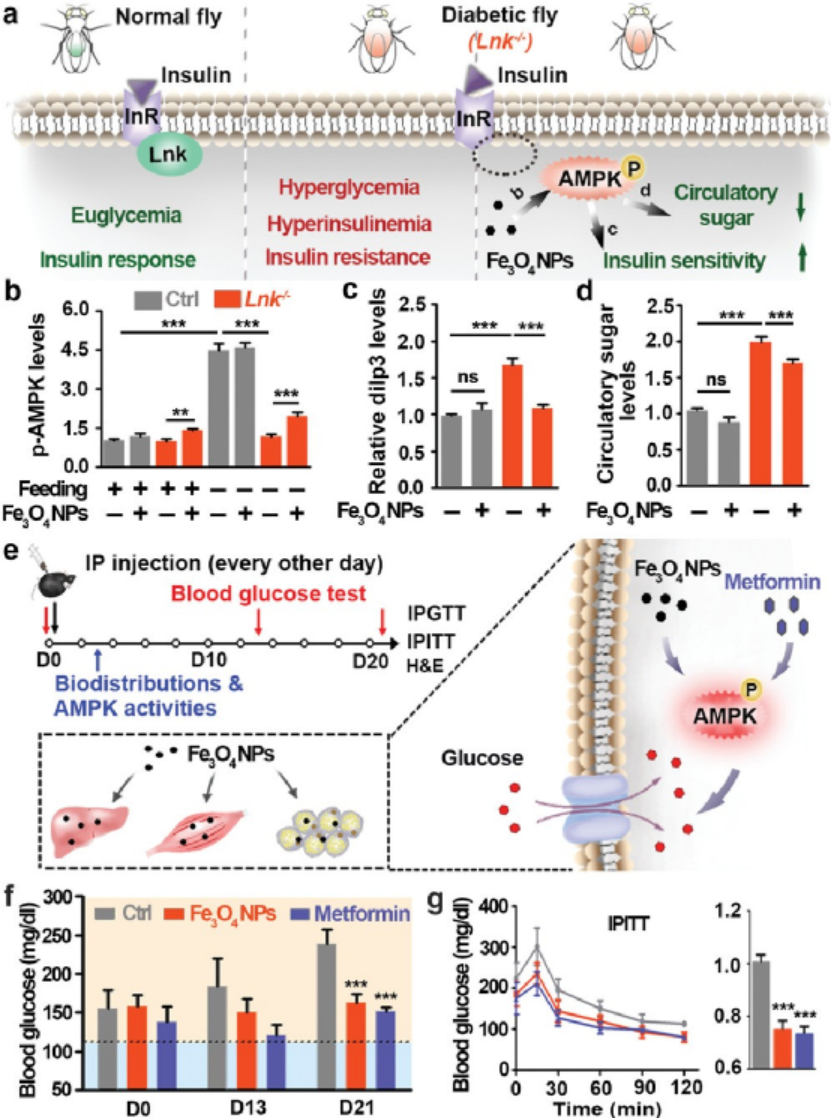
AM:細胞器特異性納米酶用于糖尿病護理
納米酶的發展已對診斷和治療產生積極影響。然而,了解這些納米酶對生化途徑和代謝穩態的全部作用仍然難以捉摸。于此,上海交通大學宋海云研究員、樊春海院士、王慧教授等人發現氧化鐵納米顆粒(Fe3O4 NPs)是一種公認的納米酶,可以通過它們在酸性溶酶體中的過氧化物酶樣活性來局部調節能量傳感器腺苷5'-單磷酸激活蛋白激酶(AMPK),從而促進葡萄糖代謝和胰島素反應。1)Fe3O4 NPs在多種代謝活躍細胞以及胰島素抵抗細胞模型中誘導AMPK活化并增強葡萄糖攝取。飲食中的Fe3O4 NPs對通過基因操作或高糖飲食誘導的糖尿病果蠅模型中的高血糖和高胰島素血癥具有治療作用。2)更重要的是,腹膜內施用Fe3O4 NPs可刺激糖尿病ob / ob小鼠體內代謝組織中的AMPK活性,降低血糖水平,并改善葡萄糖耐量和胰島素敏感性。這項研究揭示了Fe3O4 NP在AMPK激活、血糖控制和胰島素抵抗改善方面的內在細胞器特有特性,表明它們在糖尿病護理中的潛在功效。Zhou, Y., et al., An Organelle‐Specific Nanozyme for Diabetes Care in Genetically or Diet‐Induced Models. Adv. Mater. 2020, 2003708.https://doi.org/10.1002/adma.202003708
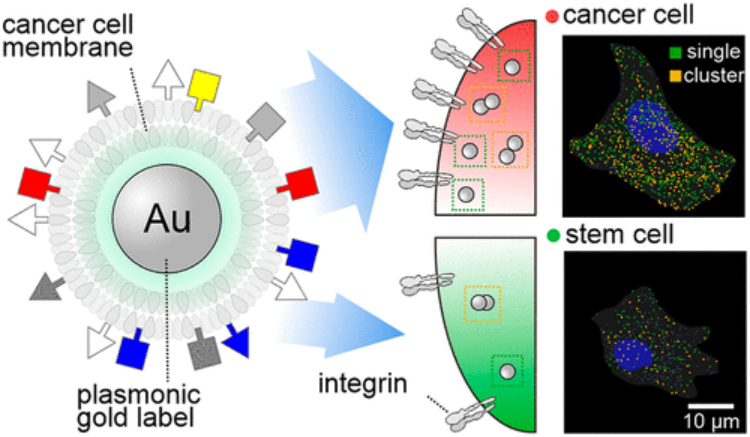
Nano Letters:細胞膜偽裝納米顆粒用于細胞類型特異性靶向遞送的等離激元成像
由于細胞膜偽裝納米顆粒(CMC-NPs)具有高生物相容性和細胞類型特異性腫瘤靶向性,因此越來越多地被用于開發各種治療手段。然而,CMC-NPs用于同型靶向的分子機制仍然難以捉摸。在此,上海師范大學陳楠、上海交通大學樊春海等人開發了一種用癌細胞膜包裹金納米粒子(AuNPs)的等離激元成像方法,并在單細胞水平上對CMC-NPs與活細胞之間的相互作用進行等離激元成像。1)對CMC-NPs在不同聚集狀態下的定量分析表明,CMC-NPs上細胞膜的存在使同型細胞的遞送增加了7倍,細胞內聚集過程增加了近2個數量級。2)重要的是,研究發現整合素αvβ3(一種在腫瘤細胞中大量表達的細胞表面受體),對于CMC-NPs的選擇性細胞識別至關重要。綜上所述,本研究中建立的用于探測納米粒子與細胞相互作用的單細胞等離激元成像平臺,為CMC-NPs的治療應用提供了新思路。Xiaodong Xi, et al. Unraveling Cell-Type-Specific Targeted Delivery of Membrane-Camouflaged Nanoparticles with Plasmonic Imaging. Nano Lett., 2020.DOI: 10.1021/acs.nanolett.0c01503https://doi.org/10.1021/acs.nanolett.0c01503除此之外,樊春海院士課題組還有一些生物傳感方向的研究以及與其他研究人員合作的相關研究,感興趣的可以參考課題組網站或者Publons上進行學習。課題組網站:http://physbio.sinap.ac.cn/zucheng/fch.htmPublons:https://publons.com/researcher/1747127/chunhai-fan/樊春海,上海交通大學化學化工學院王寬誠講席教授,中國科學院院士。1996年本科畢業于南京大學,2000年博士畢業于南京大學,后在圣芭芭拉加州大學從事博士后研究(導師:2000年諾貝爾化學獎得主Alan J. Heeger教授)。2012-2016年任科技部納米973首席科學家。入選美國科學促進會(AAAS)、國際電化學學會(ISE)和英國皇家化學會(RSC)會士,兼任ACS Applied Materials & Interfaces副主編,ChemPlusChem編委會共同主席。已在Nature,Nature和Science子刊等雜志發表論文500余篇,H-index>100,自2014年起連續入選“全球高被引科學家”。部分成果獲2016年國家自然科學二等獎(第一完成人),并獲2019年度何梁何利基金科學與技術創新獎、美國化學會“測量科學進展講座獎”和第十二屆“談家楨生命科學創新獎”。