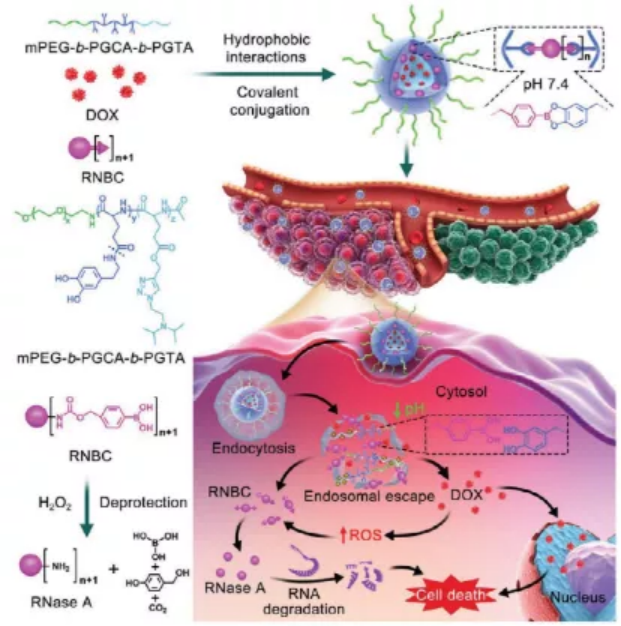
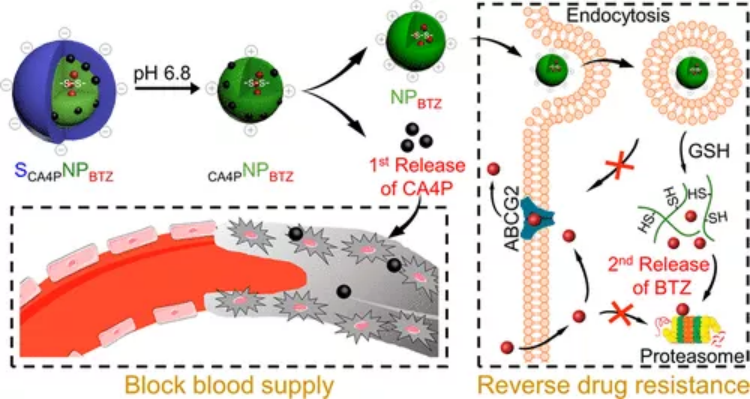
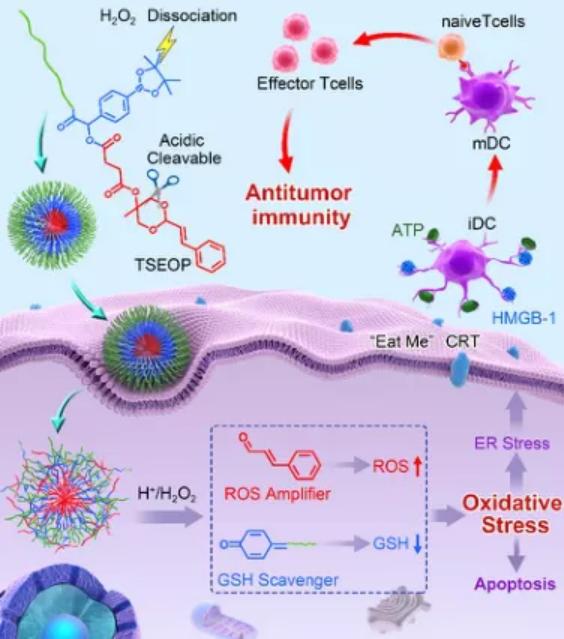
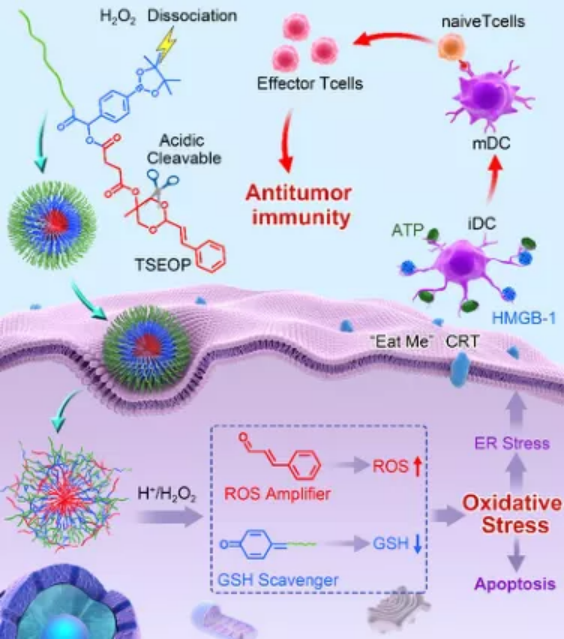
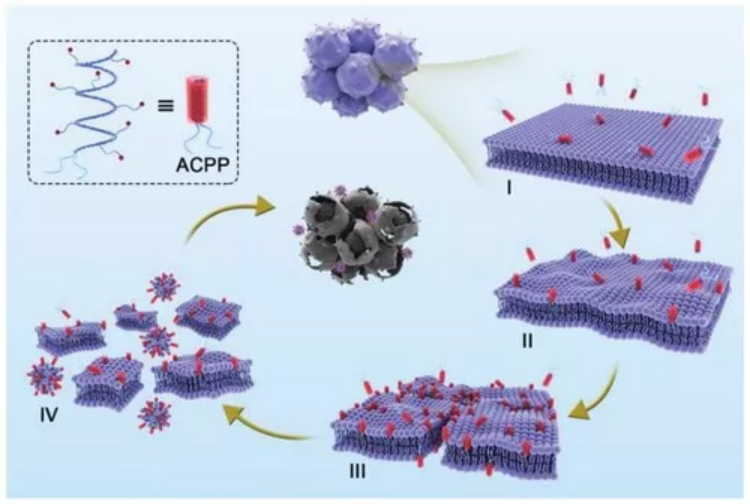
奇物論聯合納米人編輯部對2020年國內外重要科研團隊的代表性成果進行了梳理,今天,我們要介紹的是中國科學院長春應用化學研究所研究員陳學思教授課題組。陳學思,中國科學院院士、中國科學院長春應用化學研究所學術委員會常務副主任。主要從事生物降解醫用高分子材料與器件、組織工程支架和藥物緩釋載體、聚乳酸和聚e—己內酯綠色材料產業化等方向的研究與開發工作,開展了PEG-g-聚谷氨酸/順鉑抗腫瘤納米藥物的制備及其應用研究。已發表研究論文850余篇,SCI他引3萬余次,h-指數為90;授權專利260余項。任學術期刊《ACS Biomaterials Science and Engineering》副主編。2.生物可降解高分子材料與納米無機材料的復合與醫學應用探索3.具有功能性和智能性生物可降解高分子材料的設計與合成4.生物可降解材料在基因和抗腫瘤藥物緩釋上的應用研究以下按照四個部分對陳學思團隊2020年期間發表的部分成果進行歸納,供大家學習和交流。1. Adv. Mater:可在細胞內對蛋白質和化療藥物進行協同遞送的納米平臺用于癌癥治療在細胞內將活性蛋白與化療藥物相結合是一種很有前途的協同型癌癥治療策略。然而,由于缺乏合適的納米載體系統,如何將藥物遞送到癌細胞中以及控制其在細胞內的釋放仍然是一個很大的挑戰。中科院長春應化所陳學思院士和肖春生副研究員構建了一種三嵌段共聚物mPEG-b-PGCA-b-PGTA納米平臺,該平臺可以在細胞中實現對親水核糖核酸酶a (RNase a)和疏水藥物阿霉素(DOX)的協同遞送。1)實驗利用苯硼酸基團對RNase A進行修飾,并通過苯硼酸-鄰苯二酚鍵高效地將其結合到三嵌段共聚物納米顆粒中。RNase A與三嵌段共聚物之間的可逆共價結合使得該納米粒子在正常生理條件下具有很高的穩定性。2)在被細胞內化后,該三嵌段共聚物納米顆粒中的DOX和RNase A會被酸性環境和DOX增強的細胞內ROS觸發以實現在不同階段的釋放,進而產生協同增強的抗癌作用,體內和體外實驗也都證明了這一點。綜上所述,這項研究工作也為實現細胞內各種蛋白和化療藥物的聯合遞送提供了一個通用高效的新型平臺。Peng Zhang. et al. A Multistage Cooperative Nanoplatform Enables Intracellular Co-Delivery of Proteins and Chemotherapeutics for Cancer Therapy. Advanced Materials. 2020DOI: 10.1002/adma.202000013https://onlinelibrary.wiley.com/doi/10.1002/adma.2020000132. Adv. Mater.:用于癌癥治療的多級協同納米平臺將細胞內活性蛋白與化療藥物相結合是一種很有前途的癌癥協同治療策略。然而,由于缺乏納米載體系統,無法將這兩種物理化學性質截然不同的物質遞送至癌細胞并在細胞內受控釋放,從而嚴重阻礙了這一組合策略在癌癥治療中的生物醫學轉化。在此,中科院長春應用化學研究所陳學思、肖春生等人報道了一種精心設計的三嵌段共聚物--mPEG-b-PGCA-b-PGTA,用于多級協同給藥納米平臺,實現了親水性核糖核酸酶A(RNaseA)和疏水性阿霉素(DOX)的有效胞內共遞送。1)RNaseA通過ROS可裂解的氨基甲酸酯連接劑用苯硼酸基團進行生物可逆修飾,并通過pH可逆苯硼酸-鄰苯二酚鍵,高效地與三嵌段共聚物納米顆粒結合。RNaseA與三嵌段共聚物之間的可逆共價結合使納米粒子在正常生理條件下具有較高的穩定性。2)在細胞內吞后,DOX和RNaseA從三嵌段共聚物納米顆粒中的協同釋放是由內體酸性環境和隨后DOX增強的細胞內ROS環境在多個階段觸發的。這導致增強的協同抗癌效應,在體外和體內實驗都證明了這一點。綜上所述,鑒于動態共價結合物的多功能性,這項工作為各種蛋白質和化療藥物的細胞內共遞送提供了一個通用和穩定的平臺。Peng Zhang, et al. A Multistage Cooperative Nanoplatform Enables Intracellular Co‐Delivery of Proteins and Chemotherapeutics for Cancer Therapy. Adv. Mater., 2020.DOI: 10.1002/adma.202000013https://doi.org/10.1002/adma.2020000133. Nano Letters:時空靶向納米藥物在阻斷新生血管后克服缺氧誘導的腫瘤細胞耐藥性血管阻斷劑(VDAs)是一種新興的抗腫瘤藥物,由于單獨應用對腫瘤的抑制作用不足,因此將其與細胞增值抑制藥(CSD)聯合應用的需求日益增加。然而,由于VDAs和CSD的工作位點不同,以及VDAs破壞新生血管后缺氧誘導的耐藥性,這種聯合仍然是一個挑戰。有鑒于此,中科院長春應用化學研究所陳學思、丁建勛等人開發了一種殼堆積納米顆粒(SNP),用于VDA康普瑞汀A-4磷酸(CA4P)和蛋白酶體抑制劑硼替佐米(BTZ)的共包裹。1)SNP可通過位點特異性刺激激活藥物釋放,在時空將CA4P遞送至腫瘤新生血管,將BTZ介導遞送到腫瘤細胞。2)此外,SNP還逆轉了CA4P誘導的缺氧條件下ABCG2過表達引起的耐藥性。3)時空靶向聯合治療顯著抑制了人A549肺腺癌異種移植模型和人源腫瘤異種移植(PDX)模型的生長,為晚期癌癥的治療提供了一種有前景的策略。Jinjin Chen, et al. Spatiotemporally Targeted Nanomedicine Overcomes Hypoxia-Induced Drug Resistance of Tumor Cells after Disrupting Neovasculature. Nnao Lett., 2020.DOI: 10.1021/acs.nanolett.0c02515https://doi.org/10.1021/acs.nanolett.0c025154. Nano Lett.:一種合理設計的聚合物結合物用于增強抗腫瘤免疫腫瘤和基質細胞之間的串擾是腫瘤微環境(TME)的中心場景。雖然腫瘤細胞對免疫細胞的主要作用是建立一種免疫抑制環境,但在一定條件下腫瘤細胞死亡會增強抗腫瘤免疫。在此,中國科學院長春應用化學研究所陳學思、宋萬通等人報道了一種合理設計的腫瘤特異性增強的氧化應激聚合物結合物(TSEOP),用于增強抗腫瘤免疫。1)以肉桂醛(CA)、4-甲酰基苯硼酸頻那醇酯和5-異氰戊烯-1-炔為原料,經Passerini反應,再與聚(L-谷氨酸)-接枝-聚(乙二醇)單甲醚(PLG-g-mPEG)進行疊氮基-炔基點擊反應,制得TSEOP。2)在腫瘤刺激條件下,CA和醌甲基化物(QM)迅速生成,協同誘導強氧化應激、免疫原性腫瘤細胞死亡(ICD)和抗原遞呈細胞活化。體內研究表明,TSEOP治療提高了腫瘤特異性抗腫瘤免疫,并根除了小鼠結直腸和乳腺腫瘤。本研究對設計聚合物作為腫瘤免疫治療藥物具有一定的啟發意義。Sheng Ma, et al. Rationally Designed Polymer Conjugate for Tumor-Specific Amplification of Oxidative Stress and Boosting Antitumor Immunity, Nano Lett., 2020.DOI: 10.1021/acs.nanolett.9b05265https://doi.org/10.1021/acs.nanolett.9b052655. Biomaterials:納米疫苗與基因介導的細胞外基質清除劑相聯合以實現腫瘤免疫腫瘤疫苗的抗腫瘤效果往往受到T細胞響應弱和活化的T細胞浸潤差等問題的限制。中科院長春應化所田華雨研究員和陳學思院士設計了一種新的協同策略,以同時克服這兩個障礙,進而實現增強腫瘤消除。1)為了誘導T細胞的強烈反應,實驗設計了一種基于逐步靜電相互作用的腫瘤納米疫苗。該雙功能遞送系統PEI/CaCO3不僅可以作為疫苗載體以吸附抗原卵白蛋白(OVA)和佐劑 (CpG),也可輔助激活骨髓來源的樹突狀細胞(BMDCs)。因此,該PEI/CaCO3/OVA/CpG疫苗(NVs)可在體內同時實現BMDCs的活化和T細胞特異性反應的顯著增強。2)此外,為了增強活化的T細胞在腫瘤部位的浸潤,實驗構建了PEG/PEI/pSpam1 NPs, Spam1是一種能夠表達透明質酸酶(HAase)的基因。研究發現,PEG/PEI/pSpam1 NPs可在腫瘤部位實現HAase的高表達,進一步降解腫瘤細胞外基質以促進免疫細胞的浸潤。同時,細胞外基質的降解也會增加血液灌注,緩解腫瘤乏氧和調節免疫抑制微環境。實驗結果表明,NVs與pSpam1@NPs的聯合應用可顯著提高抗腫瘤效率,并有效預防腫瘤復發。Yingying Hu. et al. Synergistic tumor immunological strategy by combining tumor nanovaccine with genemediated extracellular matrix scavenger. Biomaterials. 2020https://www.sciencedirect.com/science/article/pii/S01429612203036046. AM:模擬宿主防御肽的合成多肽實現抗腫瘤無藥物抗癌策略化療是惡性腫瘤治療中最重要和不可缺少的方法之一。然而,目前使用的抗腫瘤藥物大多存在靶點不足、由于廣泛的生物分布而產生嚴重的毒副作用、以及通過多種機制產生耐藥性等不可避免的弊端。有鑒于此,中國科學院長春應用化學研究所的陳學思院士、肖春生等研究人員,報道了一種由模擬宿主防御肽(HDPs)的合成多肽實現的抗腫瘤無藥物抗癌策略。1)該多肽在12個癌細胞系中顯示出廣泛的抗癌活性,包括耐藥和高轉移的腫瘤細胞。2)詳細的機制研究表明,陽離子抗癌多肽(ACPP)可以通過溶膜機制在幾分鐘內直接誘導癌細胞快速壞死。3)此外,還制備了pH敏感的ACPP兩性離子衍生物(DA-ACPP),用于體內應用。4)DA-ACPP在中性生理條件下溶血作用可忽略不計,在弱酸性腫瘤環境中可轉化回ACPP,從而選擇性殺傷癌細胞。5)因此,DA-ACPP在4T1原位乳腺腫瘤模型和B16-F10黑色素瘤肺轉移模型中均顯示出有效的抑制腫瘤生長的作用。總體而言,該研究結果表明,合成的HDPs模擬多肽是安全有效的抗腫瘤藥物,這為開發用于癌癥治療的無藥物合成聚合物提供了新的曙光。Wei Shen, et al. Antineoplastic Drug‐Free Anticancer Strategy Enabled by Host‐Defense‐Peptides‐Mimicking Synthetic Polypeptides. Advanced Materials, 2020.DOI:10.1002/adma.202001108https://onlinelibrary.wiley.com/doi/full/10.1002/adma.2020011087. Science Advances:納米顆粒清除劑治療嚴重膿毒癥嚴重膿毒癥是一個常見的,昂貴的,致命的醫療保健問題,治療方案有限。深入了解引起膿毒癥的炎癥失調將有助于開發針對嚴重膿毒癥的新治療策略。在這項研究中,吉林大學陳立、哥倫比亞大學Kam W. Leong和華南理工大學邵丹研究員等人,其中陳學思院士為本文共同作者之一,確定了嚴重膿毒癥進展中無細胞DNA(cfDNA)在Toll樣受體9介導的促炎途徑調控中的關鍵作用。1)首先,研究人員假設去除cfDNA對膿毒癥治療有益,利用聚乙烯亞胺(PEI)合成了不同電荷密度的PEI功能化、可生物降解的介孔二氧化硅納米粒子作為cfDNA清除劑。這些核酸結合納米顆粒(nucleic acid–binding nanoparticles,NABN)在抑制cfDNA誘導的炎癥以及隨后由嚴重膿毒癥引起的多器官損傷方面表現出優于其核酸結合聚合物的同類產品。2)此外,NABNs在發炎的盲腸中表現出增強的積累和保留,以及更理想的體內安全性。總之,本文結果揭示了cfDNA在嚴重膿毒癥中的關鍵作用,并為膿毒癥治療(目前仍難解決)基于NABN的療法的發展提供了啟示。Jianati Dawulieti,et al. Treatment of severe sepsis with nanoparticulate cell-free DNA scavengers. Science Advances,2020.DOI: 10.1126/sciadv.aay7148https://advances.sciencemag.org/content/6/22/eaay7148此外,陳學思團隊2020年還發表了其他相關的高水平研究論文,由于篇幅關系就不在此一一展示,感興趣的讀者可前往該課題組網站進行學習。課題組網站:http://biopolymer.ciac.jl.cn/score/陳學思,生于吉林長春。中國科學院長春應用化學研究所研究員,博士生導師。1982年8月畢業于吉林大學,獲學士學位;1988年9月畢業于中科院長春應化所,獲碩士學位;1997年3月,畢業于日本早稻田大學,獲博士學位。1999年12月,回到中科院長春應化所工作,任課題組組長。主要從事生物降解醫用高分子材料、組織工程和藥物緩釋、聚乳酸產業化等方向的研發工作。發表SCI學術論文850余篇,SCI他引3萬余次,h-指數為90;授權專利260余項。陳學思教授任學術期刊《ACS Biomaterials Science and Engineering》副主編。中國科學院科技促進發展獎科技貢獻獎,中國石油和化學工業聯合會技術發明獎,吉林省科技進步獎一等獎2項。作為項目負責人承擔國家科技部“十三五”重點研發計劃項目,國家自然科學基金基礎研究中心項目等。同浙江海正集團合作實現了1.5萬噸聚乳酸產業化,技術水平達到了國際領先。組建了長春圣博瑪生物材料有限公司,獲得了可吸收骨折內固定釘和板CFDA兩個注冊證(III類),3個產品已提交注冊申請或在臨床評價(III類)。2004年獲得國家自然科學杰出青年基金。2019年獲評中國科學院院士。