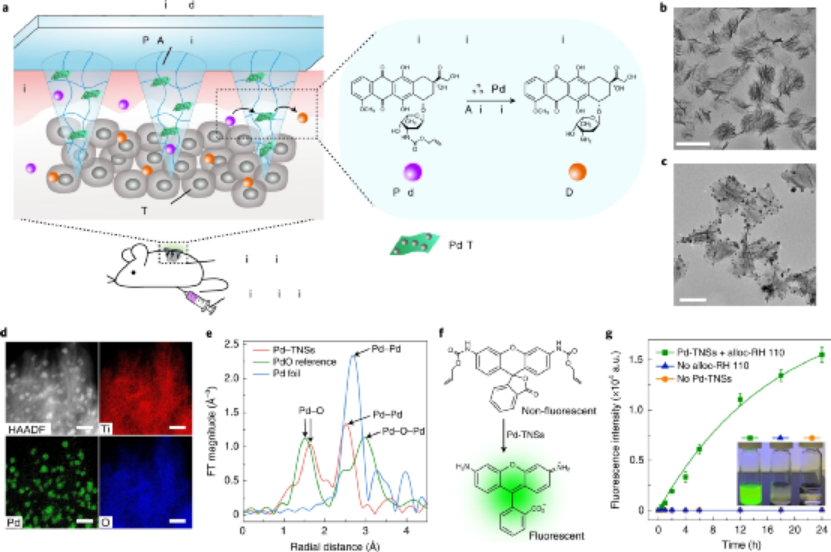
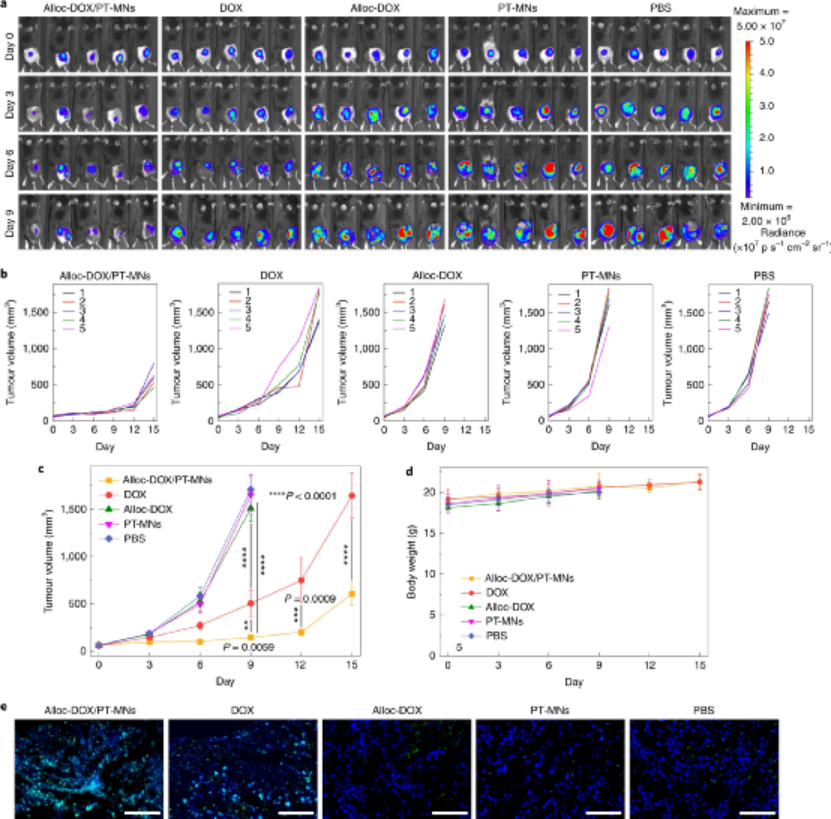
生物正交催化在復(fù)雜的生物環(huán)境中實(shí)現(xiàn)了大量的非天然化學(xué)轉(zhuǎn)化�����,如用于生物分子標(biāo)記和前藥活化的交叉偶聯(lián)和保護(hù)基團(tuán)裂解反應(yīng),這拓寬了我們對(duì)生物過程的理解���。實(shí)現(xiàn)這類化學(xué)過程主要依賴于非生物過渡金屬(TMs),包括Pd、Au���、Ru���、Ir和Cu���,這通常分為金屬配合物和金屬納米粒子兩類�����。由于金屬配合物具有不可預(yù)測(cè)的毒性����,缺乏靶向性和穩(wěn)定性��,其應(yīng)用局限于細(xì)菌和細(xì)胞研究��。目前,研究人在通過樹脂等材料來負(fù)載TMs方面取得一定的進(jìn)展�����,但該應(yīng)用仍存在一系列的問題����,如:治療后如何提取TMs、潛在的金屬毒性�、免疫原性以及非特異性沉積引起的意外催化等方面�����,更不用說對(duì)TMs和底物分子的不同劑量?jī)?yōu)化的要求了。按照這種推理方式���,一個(gè)能夠以微創(chuàng)和空間控制的方式工作的生物正交催化裝置將為在更高層次的生命實(shí)體中操縱非生物化學(xué)提供巨大的多功能性。鑒于此���,浙江大學(xué)顧臻教授等人開發(fā)了一種簡(jiǎn)單而強(qiáng)大的生物正交催化貼片�����,用于在體外和體內(nèi)催化生物正交化學(xué)����,從而直接在腫瘤內(nèi)部產(chǎn)生抗癌治療劑。成果發(fā)表在Nature Nanotechnology上��。研究人員以聚乙烯醇(PVA)為基質(zhì)�����,并以TiO2納米片支撐鈀納米顆粒(Pd-TNSs)作為納米填料���,制備了具有催化活性的微針貼片裝置���。Pd-TNSs的加入增強(qiáng)了微針在干玻璃狀態(tài)下的機(jī)械性能����,從而賦予它們足夠的強(qiáng)度�,以微創(chuàng)方式穿透皮膚。一旦置于水環(huán)境中��,微針就會(huì)變成膨脹的水凝膠狀態(tài)���,形成多孔結(jié)構(gòu)���。因此�����,該三層次的結(jié)構(gòu)層次(即:三維(3D)針陣列、每個(gè)針基質(zhì)中的微孔和網(wǎng)絡(luò)中高度暴露的Pd-TNSs表面)促進(jìn)了前藥分子的擴(kuò)散以與Pd納米顆粒接觸,進(jìn)而促進(jìn)了前藥的活化�����。圖|微針貼片的設(shè)計(jì)以及納米填料表征體外細(xì)胞實(shí)驗(yàn)表明����,PT-MNs可以生物正交催化細(xì)胞外培養(yǎng)基中alloc-RH 110熒光的釋放,然后釋放的熒光團(tuán)擴(kuò)散到整個(gè)細(xì)胞群中。同樣,Pd-TNSs還催化溶液中alloc-DOX的降解�,進(jìn)而激活 DOX的療效�。在動(dòng)物實(shí)驗(yàn)中���,通過將貼片輕柔地壓在黑素瘤腫瘤部位上的皮膚上��,微針可以完全穿透皮膚并插入其中���,貼片組可以明顯地抑制腫瘤的生長(zhǎng)����,而且避免了直接注射藥物的高毒副作用�����。圖|PT-MN介導(dǎo)的前藥體內(nèi)激活作用�,用于抗癌研究在給藥之后�,PT-MNs貼片可以以水合狀態(tài)抽出而沒有明顯的損害。這是因?yàn)椋琍d-TNS和PVA之間的界面相互作用以及由PVA鏈形成的氫鍵在微針上具有足夠的機(jī)械韌性(在水合物狀態(tài)下)���,從而易于去除整個(gè)貼片,而不會(huì)留下有害的TM或引起炎癥。綜上所述,該課題組發(fā)明了一種基于微針的催化裝置�����,并展示了其在體內(nèi)外介導(dǎo)生物無毒物質(zhì)向活性物質(zhì)的生物正交轉(zhuǎn)化中的應(yīng)用�����,實(shí)現(xiàn)腫瘤部位激活抗癌前藥,并以時(shí)空控制的方式恢復(fù)其藥理學(xué)特性���,從而減輕對(duì)遠(yuǎn)處器官或組織的非靶向激活或劑量依賴性副作用。這為用生物正交化學(xué)方法在高水平生物中局部地作用某一特定區(qū)域的生物過程鋪平了道路��。Chen, Z., Li, H., Bian, Y. et al. Bioorthogonal catalytic patch. Nat. Nanotechnol. (2021).https://doi.org/10.1038/s41565-021-00910-7