銀納米顆粒(AgNPs)由于其抗菌活性已在許多消費品中商業化,在食品包裝、生物醫藥和環境工業中具有潛在的應用前景。盡管AgNPs在消費品中越來越普遍,但AgNPs的生物學作用機制尚不清楚。這種了解的缺乏不僅阻礙了新的治療性銀納米制劑的開發,而且也妨礙了對非靶細胞和或生物體毒性的準確預測。AgNPs的毒性機制通常歸因于離子顆粒表面離子Ag+的釋放,暴露于AgNPs的細胞已表現出炎癥、氧化、遺傳毒性和細胞毒性反應。相反,一些研究提出由AgNPs的物理化學性質驅動的顆粒特異性不良反應是主要機制。這種粒子特異性的作用在很大程度上仍有待研究;諸如NP與細胞表面的相互作用、NP的攝取和細胞內的化學轉化等動力學過程尚不清楚。在文獻中提出的毒性途徑的機制解釋中,有一種叫做“特洛伊木馬機制”。據推測,NPs起著Ag+載體的作用,因為在細胞外環境中,離子很難避開絡合而進入細胞內空間。一旦內化,NPs經歷溶酶體增強溶解和釋放Ag+,這對細胞功能產生負面影響。因此,確定AgNPs毒性作用的罪魁禍首的關鍵是:在細胞間和細胞內環境中檢測上述離子和粒子。然而,AgNPs的原位鑒定及其表征和定量仍然是一個方法學上的挑戰,這不僅是AgNPs的共同挑戰,也是NPs的共同挑戰。因此,很明顯,目前害沒有任何一種技術能夠提供有關NPs的細胞相互作用和細胞內命運的足夠詳細的信息。鑒于此,澳大利亞南澳大學Enzo Lombi等人采用一種結合了多種分析技術的方法來闡明AgNPs暴露于人類細胞后的命運,并研究其攝取行為。相關成果發表在Nature Nanotechnology上。

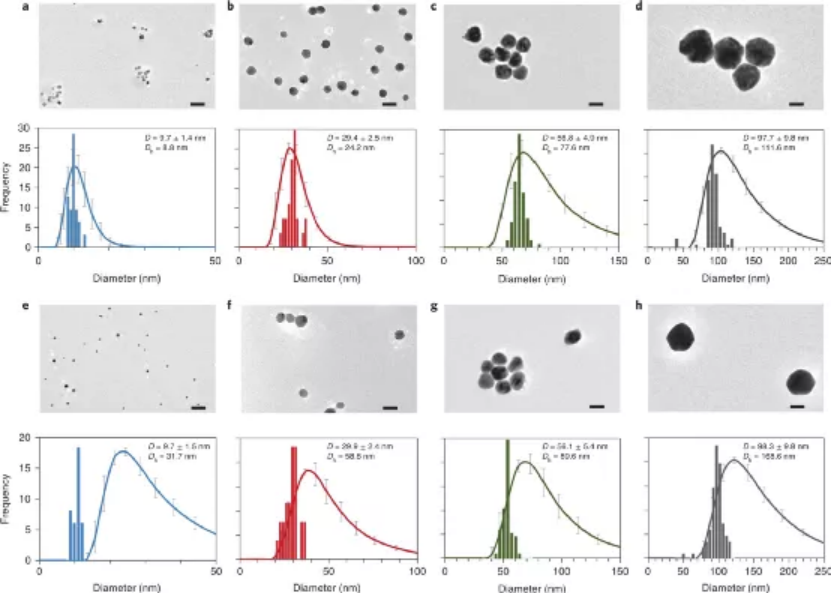
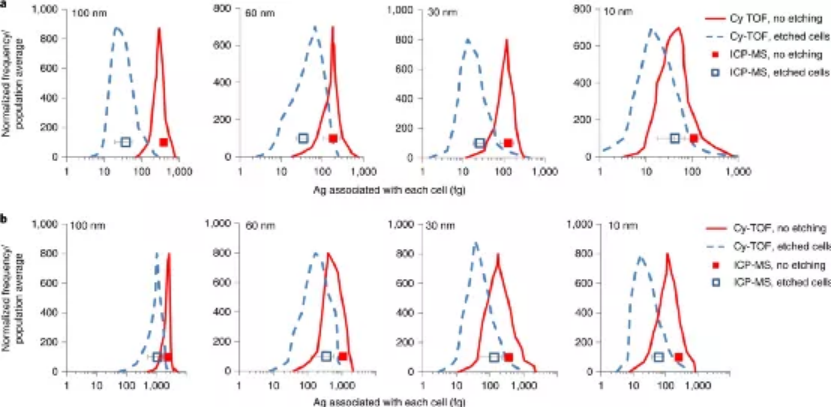
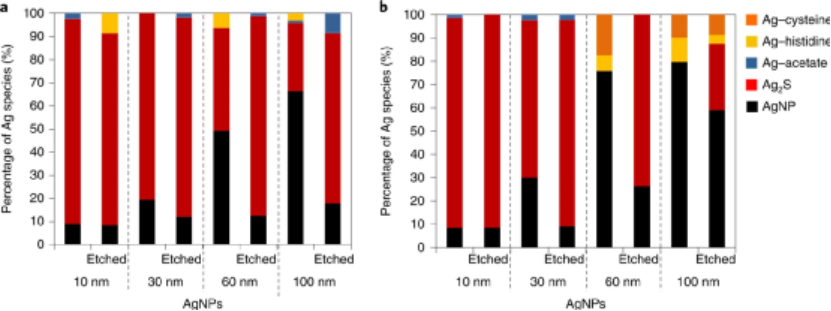
(1)ICP-MS化學分析和質譜流式細胞技術(Cy-TOF)在單個細胞水平上測量與細胞相關的Ag;(2)使用ICP-MS單顆粒檢測(sp-ICP-MS)鑒定和表征與細胞相黏附并被細胞內在化的含銀NP;(3)同步輻射X射線吸收光譜(XAS)鑒定細胞相關銀的化學形態;(4)化學蝕刻以區分與細胞表面結合的Ag與細胞內的Ag。研究人員選擇了8種AgNPs配方來研究不同表面電荷和主要NP尺寸(10、30、60、100 nm)引起的不同的NP-細胞相互作用。而且由于人類T淋巴細胞細胞系的豐富性和適應性免疫的相關性,因此選擇其作為細胞模型。研究發現,帶有陽離子表面電荷(即bPEI包被)的AgNP比具有相同主要尺寸的陰離子(即檸檬酸鹽包被的)AgNP具有明顯更高的細胞毒性,對于具有相同表面涂層的AgNP,基于質量的毒性隨著粒徑的減小而增加。而且陽離子納米顆粒更容易被細胞黏附,而且還表明內在化的Ag在驅動AgNP毒性中起主要作用。為了研究細胞相關和細胞內AgNPs的潛在轉化并研究細胞外環境中Ag的形態,通過XANES光譜分析了對AgNP暴露的細胞和暴露介質進行了分析。暴露于AgNPs 24小時后,金屬Ag和硫化Ag(Ag2S)是與淋巴細胞相關的Ag的兩種主要形式。細胞樣品中金屬銀的含量明顯依賴于AgNPs的原始大小。值得注意的是,在未蝕刻的樣品中發現了更多的金屬Ag,這表明大多數AgNP黏附在細胞膜的外部。而在蝕刻的樣品中,與細胞黏附的總Ag含量較低,并且檢測到的金屬Ag含量較小。這些結果表明,硫化部分顯然發生在細胞內。也就是說,AgNPs的生物轉化主要受硫化作用的影響,這可以看作是Ag的細胞解毒途徑之一。圖|AgNP暴露的人T淋巴細胞表面和細胞內Ag的形態總而言之,這項研究提供了一個框架,可通過使用互補的分析方法全面了解NP與哺乳動物細胞之間的相互作用。這項工作強調了聯合方法的重要性,如單細胞,單粒子和原位物種形成技術,以解開未知的NP-細胞相互作用。Malysheva, A., Ivask, A., Doolette, C.L. et al. Cellular binding, uptake and biotransformation of silver nanoparticles in human T lymphocytes. Nat. Nanotechnol. (2021).https://doi.org/10.1038/s41565-021-00914-3