盡管在過去的幾十年里癌癥研究取得了迅速的進展,但膠質母細胞瘤(glioblastoma,GBM)仍然是成人中最具侵襲性的腦瘤,僅在美國每年就有15000人死亡,5年生存率不到10%。雖然化療藥物替莫唑胺(TMZ)通過甲基化DNA和誘導腫瘤細胞毒性來提高GBM患者的生存率,但其治療效果受到耐藥性的限制。耐藥性是通過多種機制產生的,包括獲得錯配修復缺陷和重新表達O6-甲基鳥嘌呤-DNA-甲基轉移酶(MGMT)。因此,治療對TMZ耐藥的GBM患者需要具有替代作用機制的抗癌藥物。
鉑類化合物(例如第三代鉑類抗癌藥奧沙利鉑和陽離子鉑DNA嵌入劑(56MESS)已顯示出具有強大的抗癌特性,并且對DNA-烷基化劑的交叉耐藥性可忽略不計。與TMZ不同的是,奧沙利鉑與DNA形成鏈間和鏈內交聯,且MGMT不能逆轉這種交聯。奧沙利鉑也能誘導核糖體的生物合成,并以p53依賴的方式導致細胞死亡。相比之下,56MESS插入DNA,擾亂細胞內鐵和銅的代謝,抑制含硫氨基酸的生物合成,抑制腫瘤細胞增殖。盡管奧沙利鉑和56MESS具有顯著的抗腫瘤作用,但其治療應用仍受到毒性的阻礙。
成果簡介
鑒于此,中科院化學研究所肖海華和耶魯大學W. Mark Saltzman等人通過將這些試劑封裝在還原反應性納米顆粒(NPs)中來解決此問題,并通過一種先進的對流增強遞送策略避免化療藥物的耐藥性。成果發表在Nature Biomedical Engineering上。

構建還原型納米載體
作為新興的一類納米載體,還原反應型聚合物具有針對腫瘤特異性遞送生物活性分子的巨大潛力。還原反應性聚合物通常摻入二硫鍵,該二硫鍵在細胞外空間中足夠穩定,但在還原性腫瘤環境中會迅速裂解。腫瘤組織中的谷胱甘肽(GSH)濃度是非腫瘤組織中的四倍。而且,耐TMZ的神經膠質瘤細胞系比對TMZ敏感的細胞系顯示更高的GSH水平。這種差異使得還原反應型NP對GBM化療特別有吸引力。
于此,為了封裝奧沙利鉑前藥OxaPt(iv)和56MESS,研究人員合成并表征了還原反應性聚合物聚(1,2,4,5-環己烷四羧酸二酐-co-羥乙基二硫化物)-聚乙二醇(poly(CHTA-co-HD)-PEG),其中包含二硫鍵和側鏈成對的羧酸。通過納米沉淀,這種聚合物形成:(1)通過疏水作用包裹OxaPt(iv)和(2)NPs通過靜電絡合摻入帶正電荷的56MESS。
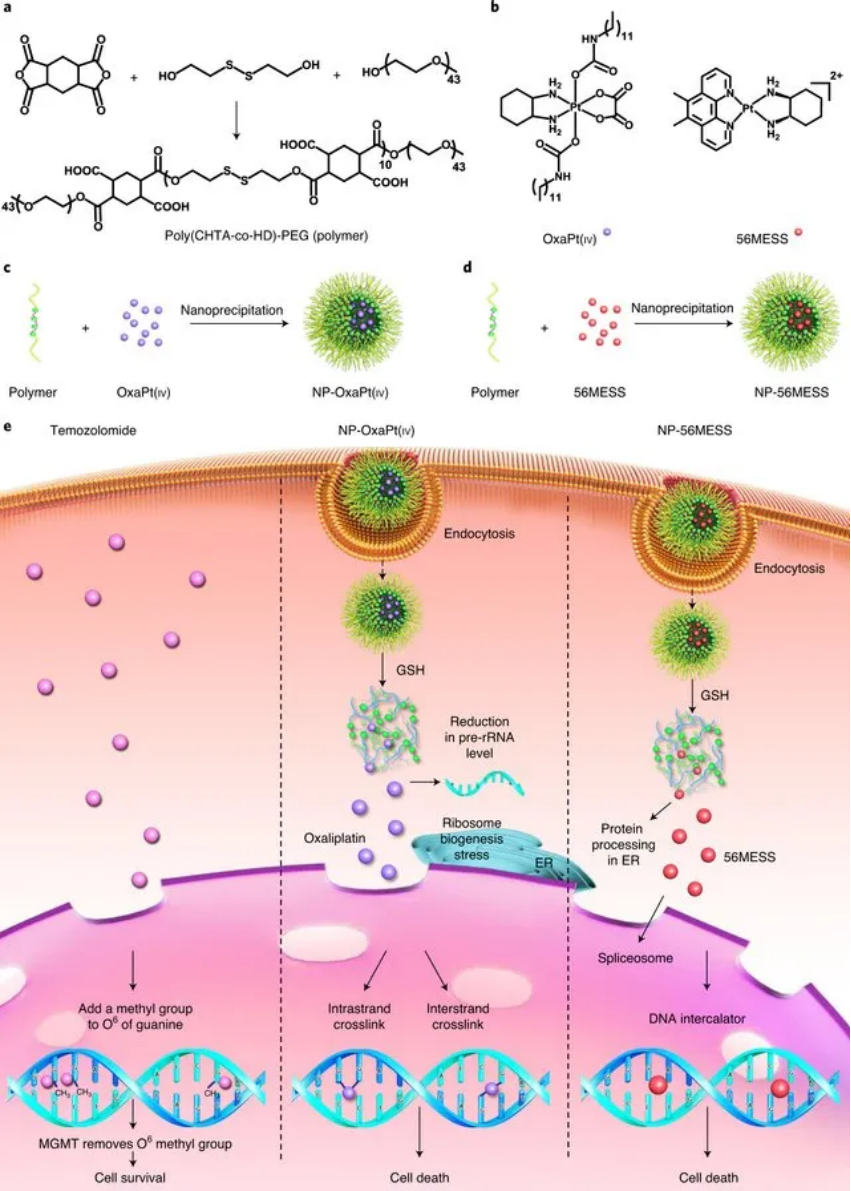
圖|還原反應性聚合物的合成和NP的形成
對流增強遞送新策略
值得注意的是,大多數藥物不可透過的血腦屏障,這也是GBM治療的另一個障礙。最近的臨床試驗表明,對流增強遞送(convection-enhanced delivery, CED)安全地繞過了血腦屏障,并直接將藥物遞送至靶點腦區域。與彈丸式注射或植入相比,使用CED,藥物可以擴散到更寬的區域,而且在這種情況下,擴散僅由濃度梯度驅動。結合這些技術的優勢,研究人員在此處證明了含有高效鉑試劑的還原反應性NP的CED可以作為耐TMZ的GBM的有前途的治療策略。

圖|NP-OxaPt(IV)和NP-56MESS抑制GBM細胞的生長
有效抑制耐藥性細胞
體內外研究證明,該還原型納米藥物有效抑制了TMZ耐藥細胞的生長,并阻止了TMZ耐藥的人膠質母細胞瘤在小鼠中的進展,而且沒有引起任何可檢測到的毒性。此外,用陽離子嵌入劑或TMZ處理的神經膠質瘤細胞系的全基因組RNA分析和代謝組學分析顯示,每種藥物改變的信號傳導和代謝途徑均存在實質性差異,證實了其作用機理與TMZ不同。

圖|轉錄分析
小結
綜上所述,該研究解決了治療GBM的多重挑戰。因此,將具有獨特作用機制的抗癌藥物與選擇性藥物釋放和對流增強遞送相結合,可能代表了一種治療TMZ耐藥神經膠質瘤的轉化策略。
參考文獻:
Wang,Y., Jiang, Y., Wei, D. et al. Nanoparticle-mediated convection-enhanceddelivery of a DNA intercalator to gliomas circumvents temozolomide resistance.Nat Biomed Eng (2021).
https://doi.org/10.1038/s41551-021-00728-7











