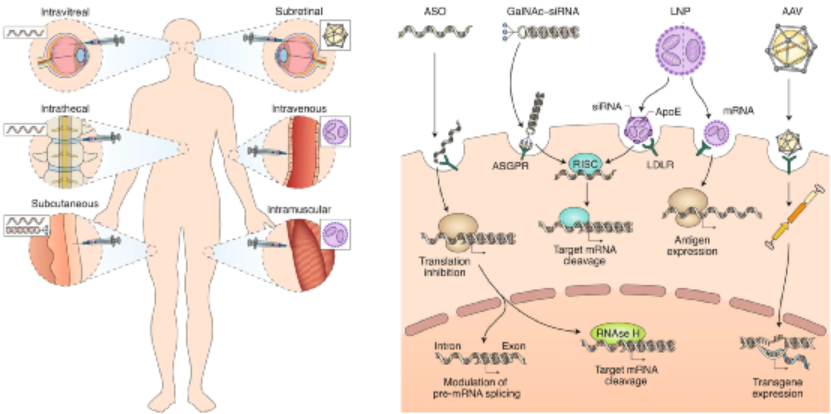
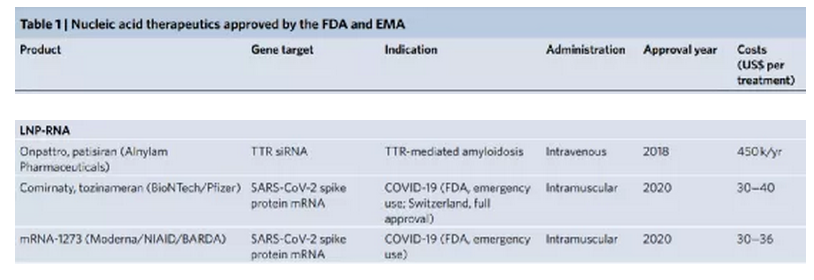
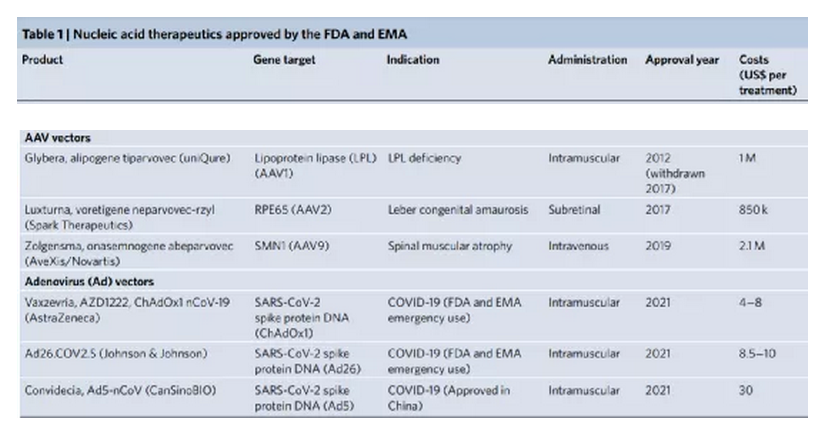
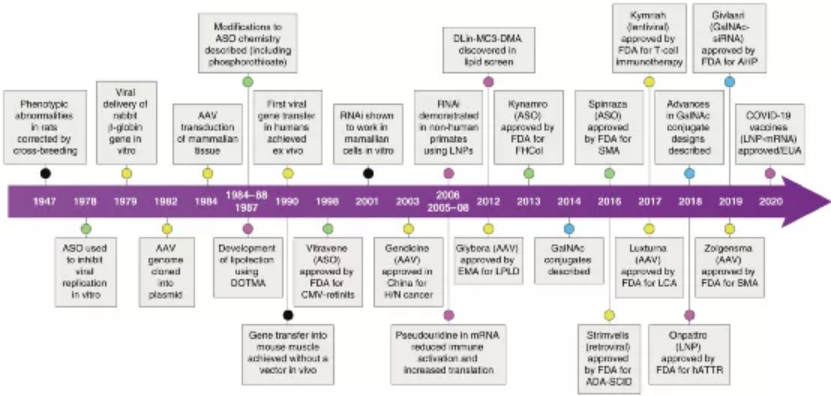
近半個世紀前,1972年,Friedmann和Roblin在Science期刊上就曾提出一個概念,可以通過引入功能性基因拷貝來治療導致基因產物功能障礙的遺傳性遺傳疾病。如今,實現核酸遞送的技術處于全球的前沿以抗擊COVID-19大流行。同時,美國食品和藥物管理局 (FDA) 和歐洲藥品管理局 (EMA) 最近紛紛批準了各種基于核酸的療法,這證明了針對許多其他疾病的遺傳基礎正在迅速成為現實。與通常靶向蛋白質的常規藥物相比,遺傳藥物調節基因表達以誘導治療效果。將外源核酸引入細胞以抵消缺陷基因是一種有吸引力的方式,可以在遺傳性和獲得性疾病中實現高度特異性、持久和可能的治療效果。然而,利用核酸作為治療手段是具有挑戰性的,因為它們容易被核酸酶降解,有助于免疫活化,并且具有不利的物理化學特性,阻止其輕易地傳遞到細胞中。因此,安全有效的核酸治療需要先進的遞送平臺技術。鑒于此,荷蘭埃因霍芬理工大學Roy van der Meel等人在Nature Nanotechnology上概述了促進體內核酸療法臨床轉化的病毒和非病毒技術,回顧了目前已經獲得批準或處于后期臨床評估的核酸療法的四種平臺技術:化學修飾的反義寡核苷酸 (ASO)、N-乙酰半乳糖胺 (GalNAc) 配體修飾的siRNA偶聯物、脂質納米顆粒 (LNP) 和腺相關病毒 (AAV) 載體。該四種平臺技術有助于開創可以在基因水平上治療疾病的醫學新時代。

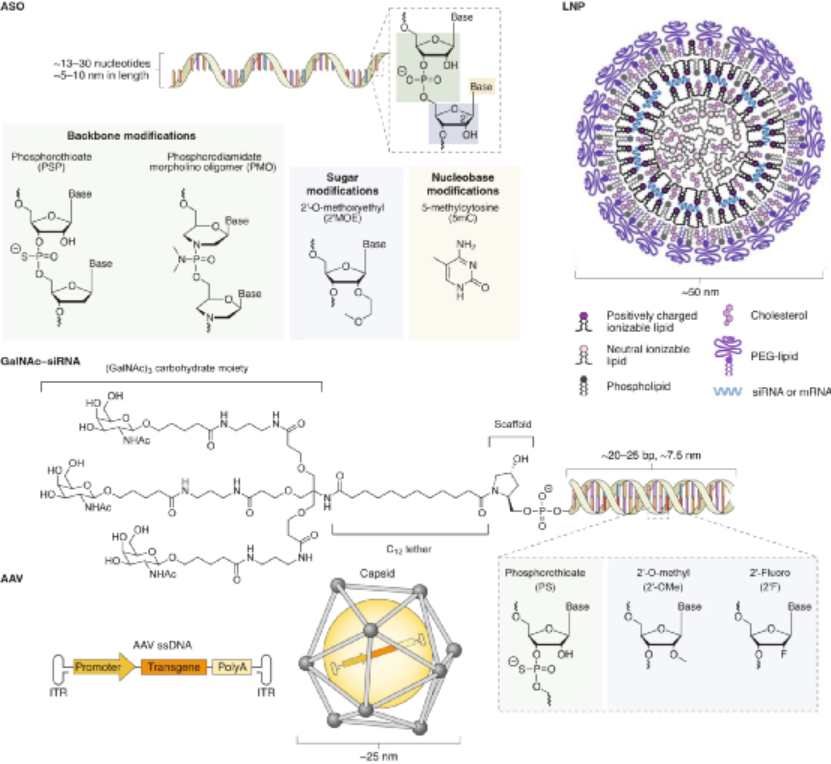
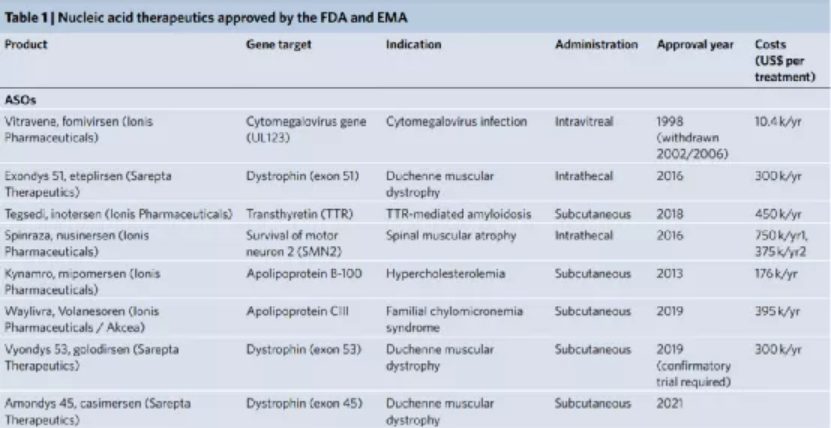
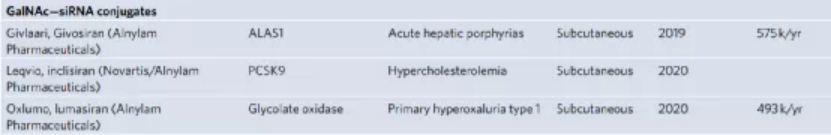
對于每種平臺技術,研究人員解釋了作用模式,提供了其開發背后的基本原理,突出了促進其臨床轉化的關鍵技術方面,并討論了使用臨床相關藥物產品的治療效果和不良反應。下面對四種平臺進行展開對比敘述。ASO 是短的合成核酸,使用經典的 Watson-Crick 堿基配對與細胞 RNA 雜交以調節基因表達。通過結合pre-mRNA或mRNA,ASO可以通過包括修飾pre-mRNA加工和剪接,競爭性抑制,翻譯機制的空間阻斷和結合的靶RNA降解的機制在轉錄后調節蛋白質合成。潛在的脫靶結合毒性是任何基于核酸的治療策略的重要考慮因素。與其他核酸藥物相比,分子大小和精確的序列設計使 ASO 具有特別強大的治療潛力。這種嚴格的結合特異性與 ASO 功效直接相關,但如果脫靶結合確實發生,則會加劇毒性。ASO 的中等大小也意味著可以通過多種給藥途徑實現對靶組織的分布。此外,ASO 核苷、核堿基和核苷間主鏈的化學修飾對于改善藥代動力學和藥效學同時保持目標親和力和功效至關重要。治療有效的 ASO 被大量修改,因此它們不需要遞送載體。制造過程中這種有限的下游加工降低了與生產相關的成本。Spinraza是一種完全硫代磷酸酯和 2'-MOE 修飾的核糖核苷酸 ASO,旨在改變SMN2基因的剪接,以增加全功能性SMN蛋白的生產;在臨床研究中,Spinraza治療顯著提高了脊髓性肌萎縮癥患者的運動機能。GalNAc 偶聯代表了一種增加 siRNA 靶器官積累和促進其細胞攝取的有效方式。在沒有保護性遞送載體的情況下,必須對 siRNA 進行化學修飾,以確保腸胃外給藥后循環中的穩定性。為了沉默肝細胞中的致病基因,這些治療劑由與靶向脫唾液酸糖蛋白受體(ASGPR)的三觸角GalNAc部分綴合的siRNA組成。該受體主要在肝細胞上表達,因此可以進入肝臟內確定的細胞類型。ASGPR特異性地將碳水化合物與末端半乳糖或GalNAc殘基結合。配體結合后,受體?配體復合物被網格蛋白依賴性受體介導的內吞作用內化。此外,其高內化率和再循環率(在幾分鐘內)允許持續攝取 siRNA 分子,從而增加靶細胞濃度。不同物種表現出相同的碳水化合物識別模式,這是臨床前和轉化研究設計中的一個重要考慮因素。Alnylam Pharmaceuticals公司的Givlaari(givosiran),是 FDA 批準的基于 GalNAc-siRNA 技術的RNAi 治療劑,適用于急性肝卟啉癥,這是由與血紅素生物合成途徑相關的基因突變引起的。Givlaari 利用 RNAi 機制來減少和防止氨基乙酰丙酸合成酶表達升高。LNP 通常由四種成分組成:可電離的陽離子脂質、磷脂、膽固醇和聚乙二醇 (PEG)-脂質。脂質多態相行為可以暫時破壞滲透屏障并允許核酸進入細胞。Felgner 等人在陽離子脂質方面的里程碑式工作,為一類新的脂質介導的遞送系統鋪平了道路。LNP 提供了一個受保護的隔室,與血清核酸酶活性和免疫成分隔離,以及由載體決定的藥物生物分布特征。可電離陽離子脂質的發現對于基于 LNP 的 RNA 療法的臨床轉化至關重要。這些脂質可確保有效的 siRNA 封裝 (>85%),在生理 pH 值下保持中性 LNP 表面電荷,并在內體逃逸中起主要作用。全身給藥后,載脂蛋白 E (ApoE) 吸附到 LNP 表面并通過低密度脂蛋白受體促進肝細胞內化,導致肝臟累積劑量超過 80%。Alnylam公司的Onpattro是一種 RNAi 治療劑,它依賴 LNP 遞送技術來治療遺傳性轉甲狀腺素蛋白淀粉樣變性 (hATTR)。自從幾十年前最初提出基因治療以來,安全有效的哺乳動物逆轉錄病毒、腺病毒和腺相關病毒的開發已有助于臨床轉化。盡管早期研究提供了明確的證據表明病毒載體可以成功傳遞治療性轉基因,但僅在少數研究中觀察到臨床益處,并且發生了顯著的免疫毒性(在某些情況下會導致患者死亡)。此外,還觀察到使用能夠進行基因組整合的病毒載體引起的嚴重遺傳毒性。盡管這些結果對這些病毒策略是否可行提出了相當大的懷疑,但它們也發起了重大努力,以提高我們對載體生物學及其與靶細胞和組織相互作用的理解。這最終導致了重組病毒載體的開發和臨床轉化,它們更有效且風險更低。病毒載體是有效的 DNA 傳遞載體,因為它們已經進化為對特定細胞類型顯示出趨向性,并且與上述方法相比,它是唯一能夠將其有效載荷主動傳遞到細胞核的系統。幾種基于重組病毒載體介導的轉基因遞送的藥物產品已獲得 FDA 和 EMA 的批準。這些治療包括離體或體內方法,在腸胃外給藥后,轉基因直接遞送至細胞,主要由 AAV 載體介導。LUXTURNA(voretigene neparvovec-rzyl) 是一種 AAV 血清型 2 (AAV2) 載體,包含編碼人 RPE65 基因的 cDNA,用于治療遺傳性視網膜營養不良 LCA 2 型。自半個世紀前首次提出使用基因療法治療疾病以來,重大的生物學和技術突破催生了多項安全、有效的平臺技術。本綜述中描述的四種平臺技術有助于將核酸療法從有趣的理論轉變為臨床現實。盡管目前大多數批準的核酸療法旨在治療孤兒疾病,但它們的遞送技術現在正被用于更廣泛適用的基因藥物,并在大流行時期實現了快速疫苗開發。此外,這些平臺正在促進新方法的臨床轉化,例如基因編輯療法。盡管它們的廣泛實施仍面臨著若干挑戰,包括制造、毒性和社會經濟問題,但很明顯,核酸療法有望對許多以前只有有限或沒有治療選擇的疾病產生革命性的影響。Kulkarni, J.A., Witzigmann, D., Thomson, S.B. et al. The current landscape of nucleic acid therapeutics. Nat. Nanotechnol. (2021).https://doi.org/10.1038/s41565-021-00898-0