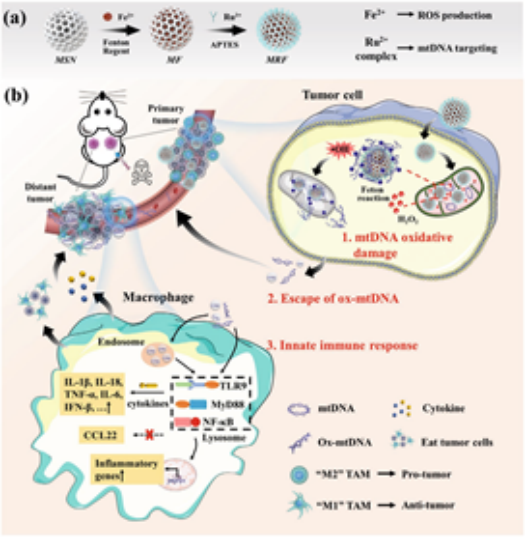
介孔二氧化硅材料具有優(yōu)異吸附材料的特性:孔道結(jié)構(gòu)有序性;孔徑分布單一性和可調(diào)控性,介孔形狀多樣性。使其在吸附分離,工業(yè)催化、生物醫(yī)學(xué)、環(huán)境保護(hù)等領(lǐng)域具有極為重要的作用。下面,奇物論收集了近期發(fā)表在頂刊上的關(guān)于介孔硅材料生物醫(yī)學(xué)應(yīng)用的論文,供大家學(xué)習(xí)和交流。1. Adv. Mater:納米催化劑可通過線粒體DNA氧化損傷激活先天免疫以治療腫瘤先天免疫系統(tǒng)在保護(hù)人體免受腫瘤侵襲方面起著關(guān)鍵作用。然而,這種保護(hù)會(huì)在很大程度上被腫瘤的免疫抑制功能所抵消。研究表明,這種免疫抑制是由免疫抑制微的環(huán)境所誘導(dǎo)產(chǎn)生的,包括耗盡的細(xì)胞毒性T淋巴細(xì)胞(CTLs)和促腫瘤的M2極化巨噬細(xì)胞。中科院上海硅酸鹽研究所施劍林院士和胡萍副研究員提出了一種利用納米催化劑誘導(dǎo)腫瘤特異性線粒體DNA(mtDNA)氧化損傷而激活先天免疫以用于腫瘤免疫治療的策略。(1)實(shí)驗(yàn)構(gòu)建了一種納米催化劑藥物,即負(fù)載Fe2+-Ru2+的介孔二氧化硅納米顆粒MSN-Ru2+/Fe2+(MRF),它可以誘導(dǎo)腫瘤細(xì)胞mtDNA發(fā)生氧化損傷。這種氧化的mtDNA能夠從腫瘤細(xì)胞中逃逸,并作為一種免疫原性損傷相關(guān)的分子模式使腫瘤相關(guān)巨噬細(xì)胞(TAMs) 發(fā)生M1極化,導(dǎo)致巨噬細(xì)胞對(duì)癌細(xì)胞的免疫響應(yīng)被重新激活,隨后產(chǎn)生先天免疫的炎癥響應(yīng)。(2)研究表明,這種基于調(diào)節(jié)TAMs先天免疫響應(yīng)的治療策略不僅能夠阻止原發(fā)腫瘤的乏展,而且在治療期間也能完全抑制遠(yuǎn)端腫瘤的生長。
Han Jiang. et al. Nanocatalytic Innate Immunity Activation by Mitochondrial DNA Oxidative Damage for Tumor-Specific Therapy. Advanced Materials. 2021DOI: 10.1002/adma.202008065https://onlinelibrary.wiley.com/doi/10.1002/adma.2020080652. JACS:磁,超聲波和光刺激的介孔二氧化硅納米載體的診療應(yīng)用加州大學(xué)洛杉磯分校Jeffrey I. Zink對(duì)磁,超聲波和光刺激的介孔二氧化硅納米載體的診療應(yīng)用進(jìn)行了綜述。(1)刺激響應(yīng)型多功能介孔二氧化硅納米顆粒(MSNs)是近十年來研究的熱點(diǎn)。研究者們?cè)O(shè)計(jì)了各種各樣的介孔系統(tǒng),并將它們用于藥物遞送和成像等生物醫(yī)學(xué)領(lǐng)域。在各種刺激下,貨物分子(如藥物)等可以從介孔中實(shí)現(xiàn)按需釋放。(2)作者在文中主要討論了三種非侵入性、生物可用的外部刺激:磁、超聲和光,介紹了目前已有的各種單分散二氧化硅微球,并評(píng)估了這些納米平臺(tái)對(duì)各種刺激響應(yīng)的優(yōu)缺點(diǎn);隨后,作者介紹了這些平臺(tái)機(jī)制以及它們對(duì)刺激的要求;最后,作者也討論了該領(lǐng)域面臨挑戰(zhàn)和未來的研究方向,以進(jìn)一步推動(dòng)其臨床應(yīng)用。
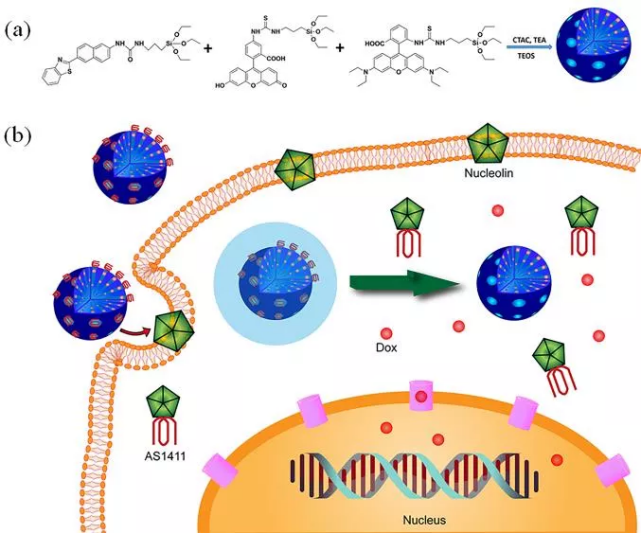
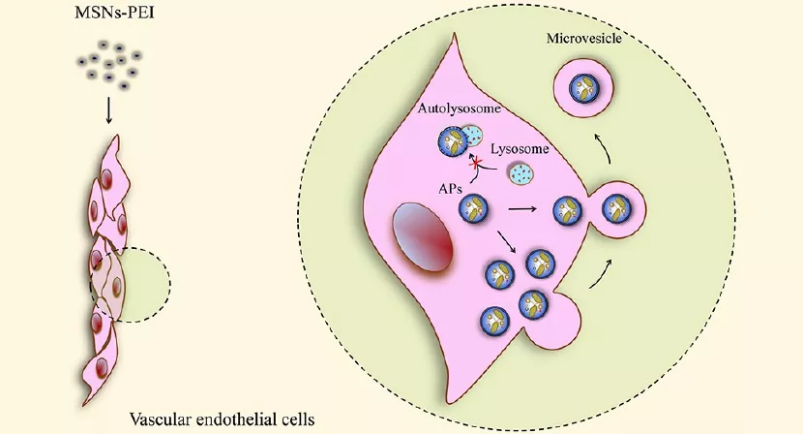
Fang-Chu Lin. et al. Magnetism, Ultrasound, and Light-Stimulated Mesoporous Silica Nanocarriers for Theranostics and Beyond. Journal of the American Chemical Society. 2021DOI: 10.1021/jacs.0c10098https://pubs.acs.org/doi/10.1021/jacs.0c100983. Angew:多色雙光子納米系統(tǒng)用于細(xì)胞內(nèi)多路成像和靶向癌癥治療基于雙光子熒光的新型治療納米系統(tǒng)可以在對(duì)深度組織進(jìn)行成像時(shí)實(shí)現(xiàn)更高的空間分辨率,進(jìn)而用于對(duì)多種癌癥進(jìn)行診斷和治療。湖南大學(xué)譚蔚泓院士和張曉兵教授首次設(shè)計(jì)和制備了一種基于FRET的雙光子介孔二氧化硅納米顆粒(MTP-MSNs),并將其用于單光激發(fā)的多路細(xì)胞內(nèi)成像和靶向癌癥治療。(1)該納米系統(tǒng)包括兩種成分:(1)多色雙光子介孔二氧化硅納米顆粒和(2)作為MTP-MSNs“門衛(wèi)”的癌細(xì)胞靶向適配體。與癌細(xì)胞共孵育后,負(fù)載有DOX并蓋有適配體的MTP-MSNs可以被細(xì)胞內(nèi)化進(jìn)而打開孔以釋放藥物。(2)實(shí)驗(yàn)也利用多色雙光子熒光成像證明了MTP-MSNs可以作為一種良好的細(xì)胞內(nèi)成像對(duì)比劑,其能夠增加成像的組織深度和改善組織的空間定位。綜上所述,這種多色MTP-MSNs為實(shí)現(xiàn)可示蹤的靶向癌癥治療提供了一種新型系統(tǒng),并有望進(jìn)一步應(yīng)用于細(xì)胞內(nèi)的多路成像和藥物篩選。Yong-Xiang Wu. et al. Multicolor Two-photon Nanosystem for Multiplexed Intracellular Imaging and Targeted Cancer Therapy. Angewandte Chemie International Edition. 2021DOI: 10.1002/anie.202103027https://onlinelibrary.wiley.com/doi/10.1002/anie.2021030274. ACS Nano:聚乙烯亞胺修飾的介孔二氧化硅納米顆粒在血管內(nèi)皮細(xì)胞中誘導(dǎo)的生存機(jī)制介孔二氧化硅納米顆粒作為一種具有廣闊應(yīng)用前景的生物分子遞送材料而受到了研究者的廣泛關(guān)注。然而,目前人們對(duì)這些單分散二氧化硅微球的潛在細(xì)胞毒性仍然不夠了解。與裸露的單分散二氧化硅和氨基修飾或脂質(zhì)體修飾的單分散二氧化硅所不同的是,聚乙烯亞胺修飾的單分散二氧化硅(MSNs-PEI)在濃度高達(dá)100 μg/mL時(shí)對(duì)人臍靜脈內(nèi)皮細(xì)胞(HUVECs)無明顯毒性。然而,MSNs-PEI會(huì)通過阻斷自噬體與溶酶體的融合而誘導(dǎo)自噬體積累,這是許多納米顆粒(NPs)產(chǎn)生細(xì)胞毒性的重要機(jī)制之一。因此,河南工業(yè)大學(xué)張璐教授提出在HUVECs中存在另一種自噬體清除途徑,進(jìn)而能夠緩解MSNs-PEI誘導(dǎo)的自噬應(yīng)激。(1)實(shí)驗(yàn)發(fā)現(xiàn),MSNs-PEI能夠阻止STX17負(fù)載到自噬小體上,而不會(huì)影響溶酶體的pH值或蛋白水解活性。與此同時(shí),MSNs-PEI可誘導(dǎo)細(xì)胞骨架結(jié)構(gòu)發(fā)生改變,但不會(huì)引起內(nèi)質(zhì)網(wǎng)應(yīng)激。當(dāng)自噬降解被MSNs-PEI所阻斷時(shí),積累的自噬體可通過微囊泡(MVs)被釋放到細(xì)胞外空間。(2)研究表明,無論是阻斷自噬體的形成還是釋放,都會(huì)使得被MSNs-PEI處理的HUVECs中產(chǎn)生過量的ROS,進(jìn)而導(dǎo)致細(xì)胞死亡。因此研究者認(rèn)為,當(dāng)自噬體降解被MSNs-PEI阻斷時(shí),MVs介導(dǎo)的自噬體釋放可作為一種代償機(jī)制以使得血管內(nèi)皮細(xì)胞能夠存活。由此表明,促進(jìn)積累的自噬體的釋放是一種對(duì)抗NPs內(nèi)皮毒性有效保護(hù)策略。Lu Zhang. et al. Polyethylenimine-Modified Mesoporous Silica Nanoparticles Induce a Survival Mechanism in Vascular Endothelial Cells via MicrovesicleMediated Autophagosome Release. ACS Nano. 2021DOI: 10.1021/acsnano.1c03456https://pubs.acs.org/doi/10.1021/acsnano.1c03456
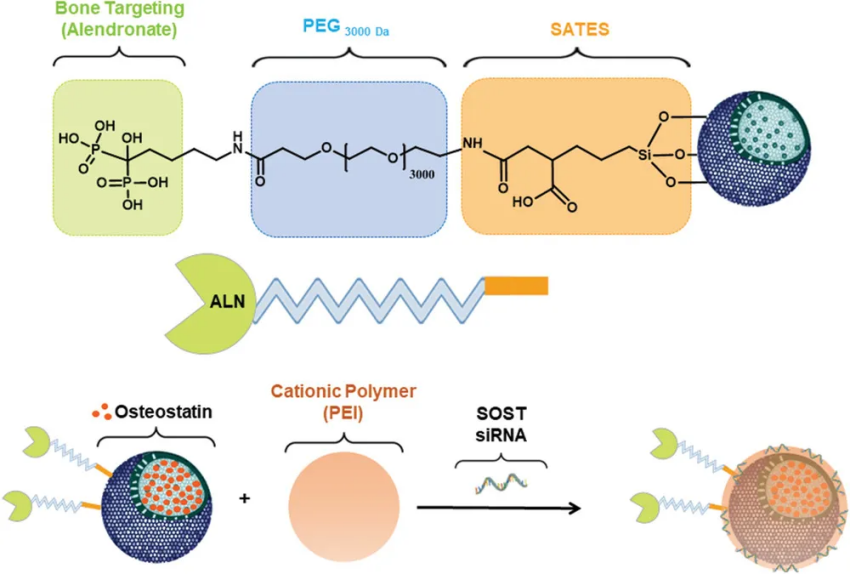
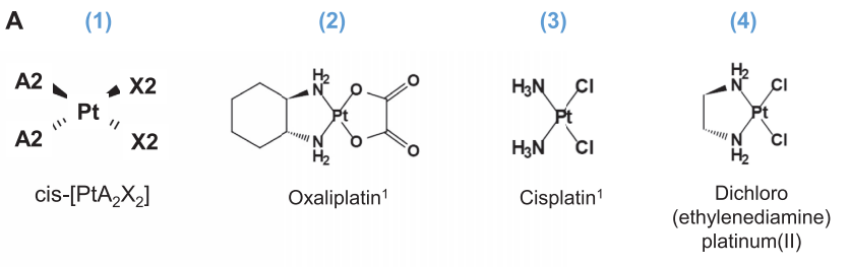
5. Adv. Sci.:介孔二氧化硅納米顆粒緩解骨質(zhì)疏松和新骨形成納米技術(shù)改變了多種疾病的治療理念,在藥物和基因傳遞方面產(chǎn)生了巨大的影響。在不同的目標(biāo)疾病中,骨質(zhì)疏松癥具有破壞性的臨床和經(jīng)濟(jì)后果。由于目前的骨質(zhì)疏松治療存在一些副作用,需要新的治療方法。近年來,小干擾RNA(siRNA)的應(yīng)用已成為一種很有前途的替代方法。Wnt/β-cateni信號(hào)通路控制骨發(fā)育和形成。該途徑受到硬化蛋白的負(fù)調(diào)控,通過應(yīng)用siRNA來抑制硬化蛋白可能會(huì)促進(jìn)骨形成。然而,基于siRNA治療的主要瓶頸是遞送載體的必要性,這使納米技術(shù)成為一種潛在的解決方案。在可用的納米載體中,介孔二氧化硅納米粒子(MSNs)在siRNAs的細(xì)胞內(nèi)傳遞方面引起了極大的關(guān)注。有鑒于此,馬德里康普頓斯大學(xué)Miguel Manzano、María Vallet-Regí等人評(píng)估了基于MSN的新的潛在骨質(zhì)疏松癥治療的有效性。1)提出了一種基于介孔二氧化硅納米顆粒的修飾系統(tǒng),能夠通過皮下注射轉(zhuǎn)運(yùn)和傳遞SOST siRNA和骨生成抑制素。單分散二氧化硅納米粒子經(jīng)過PEG和ALN修飾,具有良好的膠體穩(wěn)定性和骨靶向能力,從而可以更有效地將生物分子傳遞到目標(biāo)組織。2)驗(yàn)證了優(yōu)化系統(tǒng)的靶向能力和膠體穩(wěn)定性。該系統(tǒng)能夠保護(hù)siRNA免受RNases的影響,保持單分散性和懸浮穩(wěn)定性,并且在合成HA周圍累積。3)納米顆粒裝載有骨抑制素和SOST siRNA,并皮下注射到切除卵巢的小鼠體內(nèi)。納米顆粒給藥后基因表達(dá)被修飾,SOST被有效敲除,重要的成骨標(biāo)記物和血管化相關(guān)基因增加,是新骨形成的第一個(gè)跡象。這一體內(nèi)基因表達(dá)分析證明了該系統(tǒng)對(duì)潛在骨質(zhì)疏松治療的效率。4)骨骼的微結(jié)構(gòu)也通過μCT、組織學(xué)和免疫組織化學(xué)分析進(jìn)行了測(cè)量。結(jié)果表明,經(jīng)過3周的系統(tǒng)治療,骨的微結(jié)構(gòu)由于負(fù)載的納米載體而得到改善。此外,將所設(shè)計(jì)的納米粒子的應(yīng)用效果與常規(guī)處理方法PTH的效果進(jìn)行了比較。與PTH治療相比,納米顆粒共同遞送兩種治療藥物不僅實(shí)現(xiàn)了更大的成骨標(biāo)志物刺激,而且與激素治療相比,基因表達(dá)修飾導(dǎo)致了更好的骨結(jié)構(gòu)。經(jīng)治療的去卵巢小鼠幾乎恢復(fù)了健康小鼠的值,這意味著這里提出的系統(tǒng)可以被認(rèn)為是骨質(zhì)疏松癥全身治療的有希望替代方案。Patricia Mora-Raimundo et al. Osteoporosis Remission and New Bone Formation with Mesoporous Silica Nanoparticles. Adv. Sci. 2021, 2101107.DOI: 10.1002/advs.202101107.https://doi.org/10.1002/advs.2021011076. ACS Nano:超快定向Janus Pt-介孔二氧化硅納米馬達(dá)用于智能藥物遞送
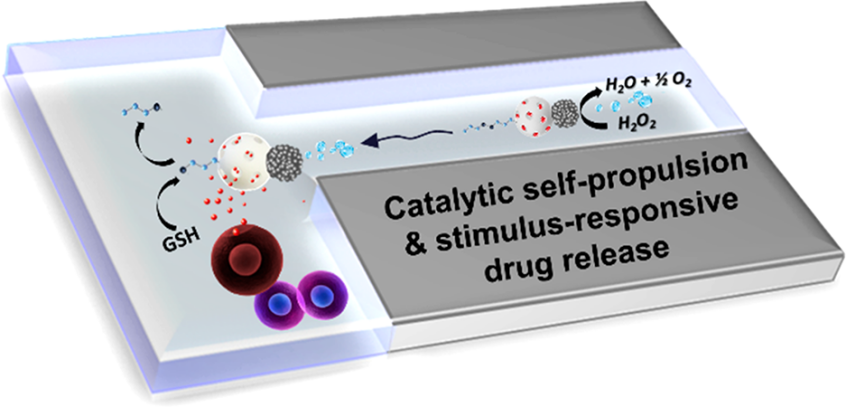
具有高效推進(jìn)和貨物牽引功能的生物納米馬達(dá)因其在生物傳感、診斷和治療方面的應(yīng)用潛力而備受關(guān)注。其中,自推進(jìn)型納米馬達(dá)可以智能地對(duì)治療有效載荷進(jìn)行控制釋放,然而這一技術(shù)在實(shí)際生物醫(yī)學(xué)應(yīng)用中仍然面臨著諸多挑戰(zhàn)。西班牙瓦倫西亞大學(xué)Ramón Martínez-Mán?ez設(shè)計(jì)合成了一種新型多功能JanusPt-介孔二氧化硅納米馬達(dá),它由推動(dòng)元素 (Pt)、藥物載體(介孔二氧化硅納米顆粒的),和含有二硫鍵的低聚乙二醇鏈(S?S?PEG)所組成。(1)由于可以催化分解低濃度的過氧化氫,該Janus型納米馬達(dá)具有超快的自推進(jìn)運(yùn)動(dòng)性能。同時(shí),該納米馬達(dá)也可以進(jìn)行方向性運(yùn)動(dòng),驅(qū)動(dòng)發(fā)動(dòng)機(jī)朝著生物靶標(biāo)THP-1癌細(xì)胞運(yùn)動(dòng)。隨后,由于細(xì)胞內(nèi)谷胱甘肽會(huì)還原斷開該系統(tǒng)中的二硫鍵,這種快速定向的運(yùn)動(dòng)也能有助于實(shí)現(xiàn)該系統(tǒng)被細(xì)胞快速內(nèi)化和按需特異性的細(xì)胞毒性藥物釋放。(2)在沒有燃料(過氧化氫)的情況下,該納米馬達(dá)既不能定向移動(dòng),也不能到達(dá)癌細(xì)胞并釋放運(yùn)送的貨物,這表明燃料是該馬達(dá)系統(tǒng)需要進(jìn)入特定區(qū)域并其細(xì)胞內(nèi)化和藥物釋放的重要因素。綜上所述,這一納米系統(tǒng)能夠進(jìn)行快速自主運(yùn)動(dòng),具有多功能性和刺激響應(yīng)控制藥物釋放等功能,有望用于多種生物醫(yī)學(xué)領(lǐng)域。Paula Díez. et al. Ultrafast Directional Janus Pt?Mesoporous Silica Nanomotors for Smart Drug Delivery. ACS Nano. 2021DOI: 10.1021/acsnano.0c08404https://pubs.acs.org/doi/10.1021/acsnano.0c084047. Small:負(fù)載鉑藥物的硅質(zhì)體納米載體用于對(duì)胰腺癌進(jìn)行化學(xué)-免疫治療加州大學(xué)Huan Meng和Andre E. Nel開發(fā)了一種基于介孔二氧化硅納米顆粒(MSNP)的平臺(tái),它可用于對(duì)一系列活化的鉑(Pt)化學(xué)藥物進(jìn)行高劑量負(fù)載,這些藥物可以在弱堿性pH條件下通過靜電和配位化學(xué)作用附著在多孔載體的內(nèi)部。(1)除了具有改善藥物遞送的設(shè)計(jì)特點(diǎn)外,MSNP還可以被包覆在脂質(zhì)雙分子層(硅小體)中以提高其被靜脈注射后的膠體穩(wěn)定性。在原位kras衍生的胰腺癌(PDAC)模型中,被封裝的奧沙利鉑(1,2-環(huán)己烷二胺鉑(II) (DACHPt))與游離藥物相比具有更好的藥代動(dòng)力學(xué)和腫瘤內(nèi)遞送效率。注射負(fù)載有DACHPt的硅小體不僅能更有效的殺傷腫瘤細(xì)胞,而且也證明了化療誘導(dǎo)的細(xì)胞死亡會(huì)伴有免疫原性細(xì)胞死亡(ICD)的產(chǎn)生,同時(shí)可以顯著降低骨髓毒性。(2)實(shí)驗(yàn)通過多種手段對(duì)伴隨產(chǎn)生的ICD進(jìn)行了驗(yàn)證。生存實(shí)驗(yàn)結(jié)果表明,負(fù)載有DACHPt的硅小體對(duì)荷瘤小鼠的生存結(jié)果有顯著改善,并且通過延遲使用抗PD-1抗體可以使得生存時(shí)間進(jìn)一步延長。Xiangsheng Liu. et al. Development of Facile and Versatile Platinum Drug Delivering Silicasome Nanocarriers for Efficient Pancreatic Cancer Chemo-Immunotherapy. Small. 2021DOI: 10.1002/smll.202005993https://onlinelibrary.wiley.com/doi/10.1002/smll.202005993