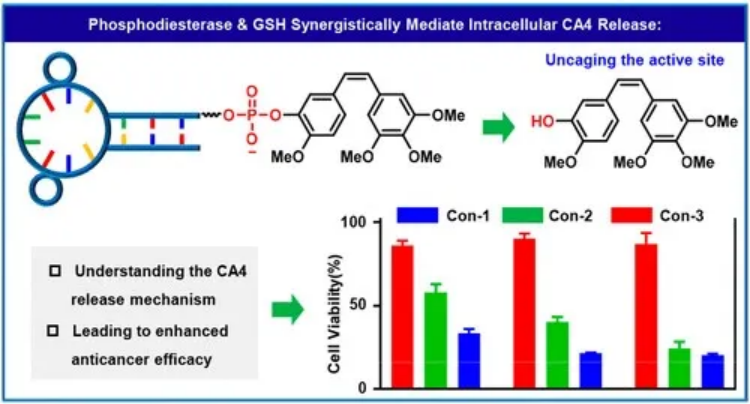
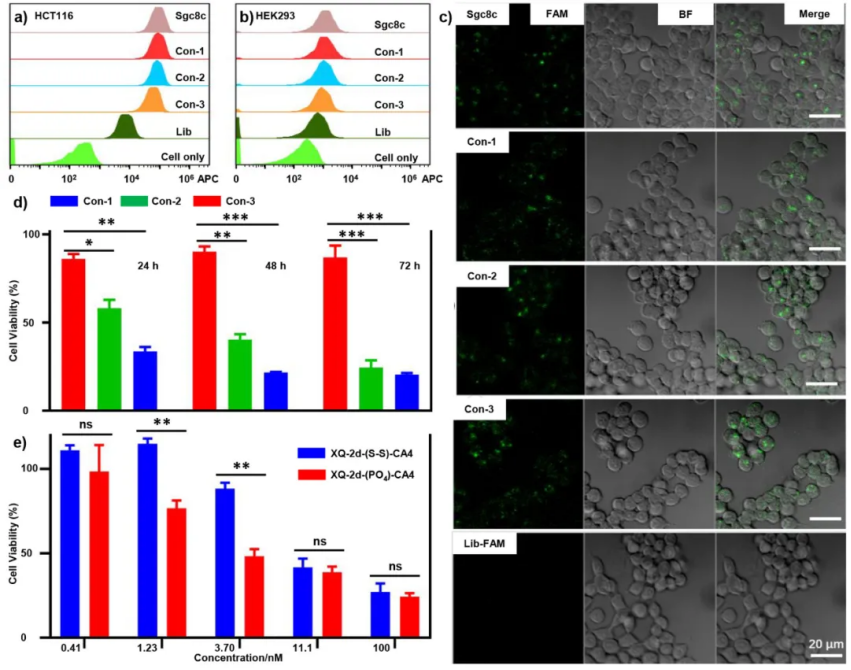
JACS: 調節 Sgc8-Combretastatin A4 偶聯物的抗癌功效核酸適體獨特的優點,包括特異性、高結合親和力、易于細胞內化和快速組織積累能力,使得核酸適體-藥物結合物成為靶向給藥最具吸引力的策略之一。然而,連接體在調節這些結合物的抗癌功效中的關鍵作用,特別是那些通過自動化模塊化合成技術設計的結合物,卻很少被探索。有鑒于此,湖南大學的譚蔚泓、王雪強等研究人員,報道了調控Sgc8-Combretastatin A4偶聯物的抗癌效果:一個認識到連接體化學對設計基于適體的靶向藥物遞送策略的重要性的案例。1)研究人員利用Sgc8c適體和combretastatin A4開發了三種具有磷酸二酯鍵連接體、二硫鍵連接體或氨基甲酸酯連接體的共軛物來研究它們的有效載荷釋放機制以及對抗癌療效的影響。
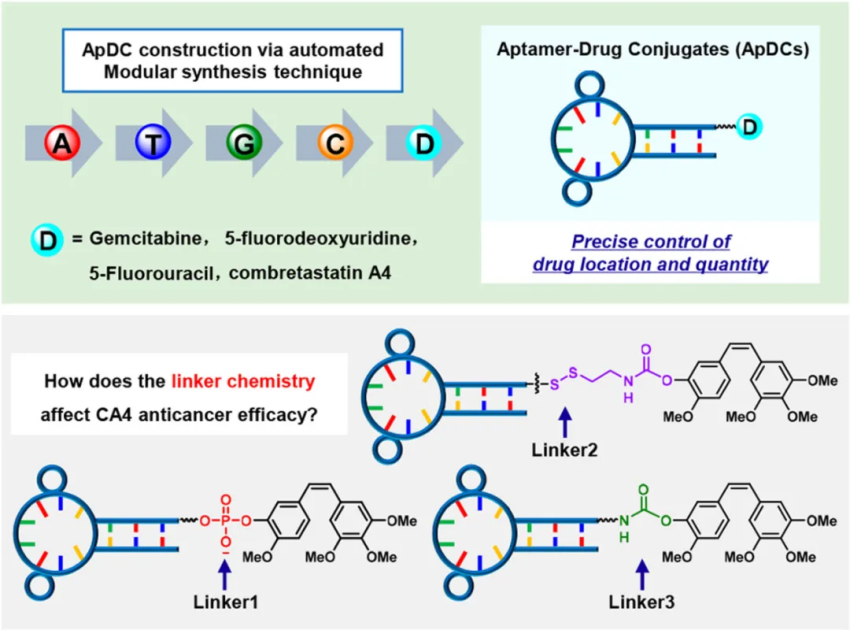
2)這些研究使研究人員能夠確定由谷胱甘肽的親核攻擊和由磷酸二酯酶引起的降解激活的磷酸二酯酶鍵連接子的與共軛物的較高細胞毒性高度相關的獨特激活途徑。對磷酸二酯鍵連接子活化化學的理解使人們能夠進一步設計另一種XQ-2d-CA4偶聯物,以更有效的方式誘導胰腺癌細胞凋亡。
值得注意的是,譚蔚泓院士、劉莊、楊宇等人于上個月在JACS上發表了另一重要成果!
免疫檢查點阻斷療法(ICB)是通過阻斷T細胞上PD1與癌細胞或抗原呈遞細胞PD-L1結合,進而增強腫瘤臨床免疫治療效果的一種有效方法。目前,已有包括納武單抗等在內的多種PD1或PD-L1抑制劑被批準用于臨床治療。盡管如此,ICB治療仍然存在一些不足,比如脫靶效應和臨床響應率偏低等。
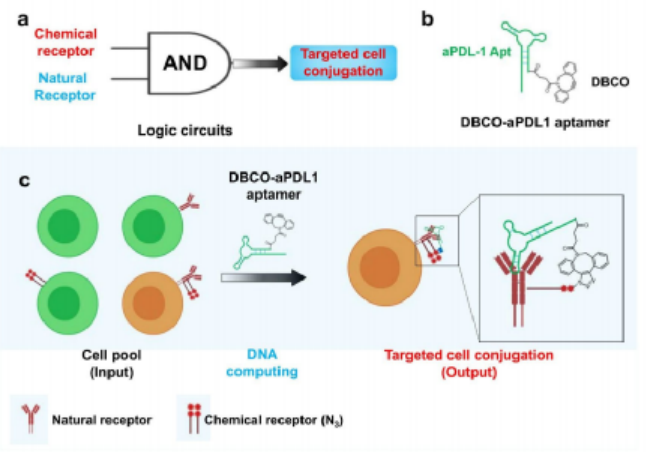
于此,上海交通大學譚蔚泓院士、楊宇研究員和蘇州大學劉莊教授提出了一種DNA邏輯計算介導的生物正交反應策略,實現了精準且長久的免疫檢查點阻斷治療。只有當靶標細胞表面存在大量受體且通過代謝工程表達有疊氮糖修飾,符合“AND”邏輯門時,細胞表面受體才能與DBCO修飾的核酸適體發生生物正交反應,實現對靶標細胞的精準標記以及對免疫檢查點的穩定阻斷,達到精確和持續的抗腫瘤免疫治療的目的。這種DNA邏輯計算介導的生物正交反應可以提高免疫檢查點阻斷(ICB)治療的精確性和穩健性,同時,該方法也能夠進一步拓展應用到光動力治療和放射療法等。
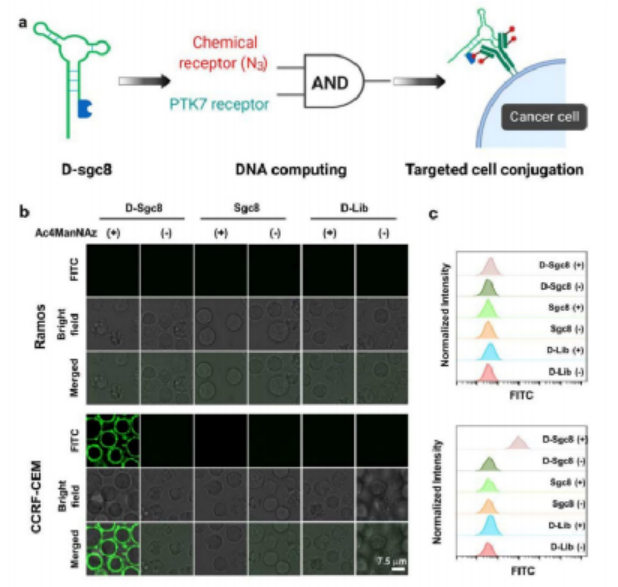
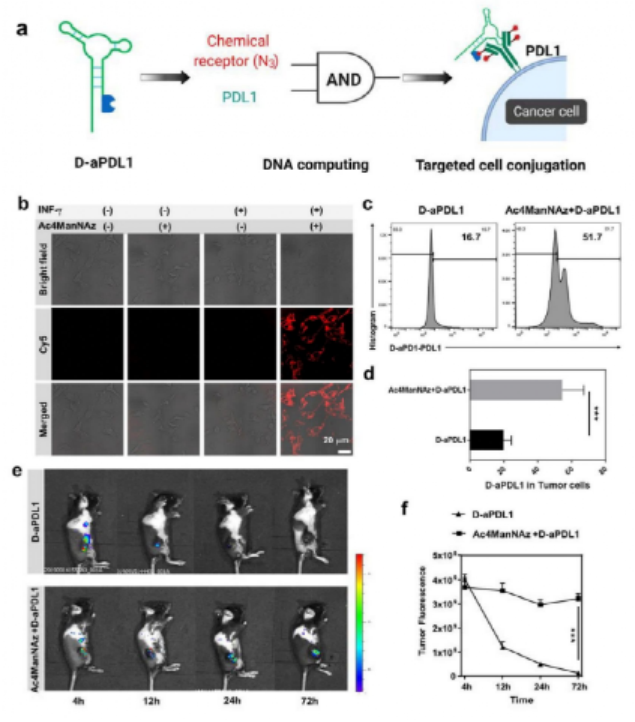
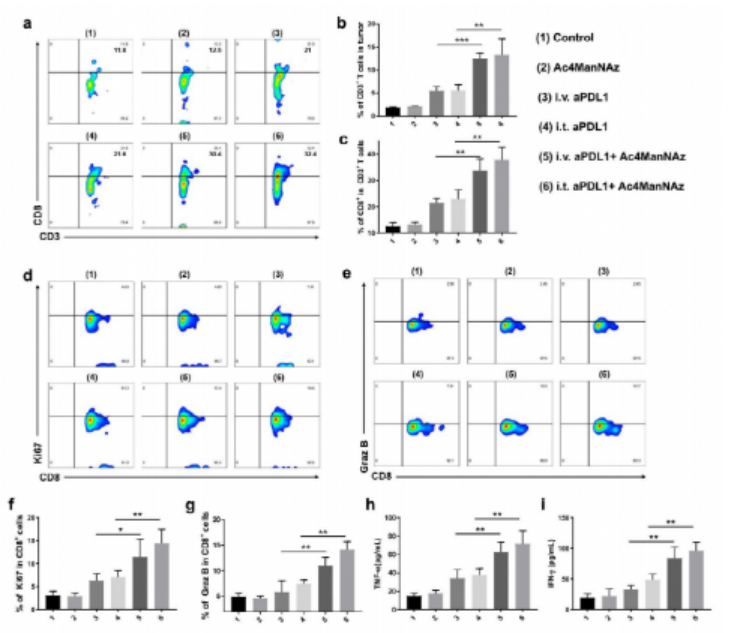
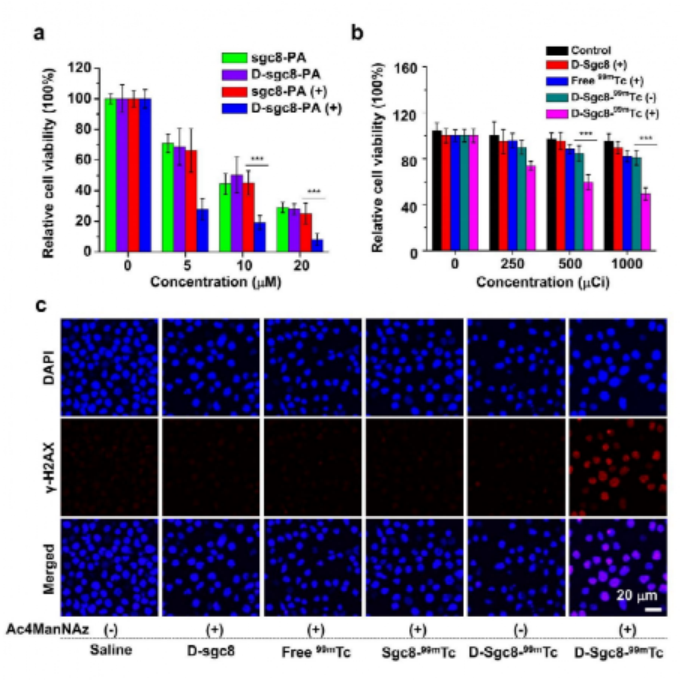
如圖1所示,靶標細胞表面高豐度的受體蛋白PD-L1作為“天然受體”,通過糖代謝工程標記在受體蛋白上的疊氮糖作為“化學受體”。基于此,作者提出了一種基于DNA邏輯計算的生物正交反應,只有當細胞表面同時存在“天然受體”和“化學受體”時,DBCO修飾的抗PD-L1適體(DBCO-aPDL1 aptamer)才能夠在識別PD-L1的前提下介導DBCO與疊氮的點擊化學反應,從而將DBCO-aPDL1 aptamer共價交聯到PD-L1上,實現有效和持續的免疫檢查點阻斷,提高免疫檢查點阻斷治療效果。為了驗證DNA邏輯計算介導的DBCO-適體核酸/疊氮糖-靶標蛋白之間的生物正交反應的特異性,研究人員選擇了特異性高表達蛋白酪氨酸激酶7(PTK7)的CCRF-CEM細胞作為靶標細胞,低表達PTK7的Ramos細胞作為對照細胞,并選擇DBCO修飾的抗PTK7適體(D-sgc8)進行生物正交反應。結果如圖2所示,對D-sgc8進行FITC熒光標記后,激光共聚焦成像(圖2b)與流式細胞術(圖2c)結果顯示,僅D-sgc8和CCRF-CEM細胞共培養時才會出現明顯的熒光信號,表明生物正交反應能夠順利進行。圖2 用D-sgc8在活細胞表面構建生物正交邏輯回路受D-sgc8在靶細胞上高度精確表面工程的啟發,作者進一步設計了DBCO修飾的抗PD-L1適體(D-aPDL1),用于提供有效和精確的免疫檢查點阻斷治療(圖3a)。具體來說,作者選用小鼠黑色素瘤細胞系B16F10作為靶標細胞,將Cy5標記的D-aPDL1與不同處理的靶標細胞孵育后,僅有INF-γ誘導、糖代謝工程化,表達有大量帶有疊氮糖標記的PD-L1受體蛋白,的靶標細胞被穩定標記上了D-aPDL1(圖3b-3d)。動物實驗表明,Ac4ManNAz治療組中,Cy5標記的D-aPDL1能在腫瘤中穩定保留72小時以上(圖3e),遠高于未經Ac4ManNAz處理的對照組(圖3f)。因此,這種“AND”邏輯計算生物正交反應可介導D-aPDL1與腫瘤細胞表面疊氮糖標記的PD-L1受體的共價結合,實現核酸適體在腫瘤內的長期保留,從而提供精確和長期的免疫檢查點阻斷治療。為了驗證治療效果,作者將B16F10腫瘤小鼠分為六組進行實驗(圖4a),對比不同實驗組的腫瘤大小(圖4b, 4c),存活率(圖4d)、體重(圖4e)變化。結果表明,Ac4ManNAz治療對腫瘤生長的影響不大,但同時靜脈注射或肌肉注射D-aPDL1的實驗組小鼠均表現出有效的腫瘤生長抑制作用,并能夠顯著提高了小鼠的存活率。對主要器官的組織學檢查進一步證實了D-aPDL1適體具有良好的生物相容性(圖4f)。因此,DNA邏輯計算介導的生物正交反應可以實現精確、長期的檢查點阻斷免疫治療。圖4 基于D-aPDL1的體內精確檢查點阻斷免疫治療的邏輯回路為評價T細胞介導的免疫應答效果,作者采用流式細胞術分析了不同實驗組的腫瘤浸潤淋巴細胞。結果顯示,與D-aPDL1治療組相比,無論肌肉注射或靜脈注射D-aPDL1,Ac4ManNAz處理組腫瘤中T細胞顯著增加(圖5a-5c),與效應T細胞增殖和生長密切相關的細胞周期相關蛋白(Ki67)表達也在治療后顯著升高(圖5d, 5f),CD8+ T細胞內Graz B的表達顯著增強(圖5e, 5g),小鼠腫瘤中細胞因子水平顯著增強(5h, 5i)。這些結果共同證實了該策略誘導產生了的有效的適應性免疫應答。通過“AND”邏輯反應將D-aPDL1共價結合在腫瘤細胞上,可以使其長期保留在腫瘤部位,從而觸發持續而強大的T細胞介導的抗腫瘤免疫治療。在光動力治療上,利用光敏劑PA(焦磷酸葉綠素-A)在近紅外光照射下產生單線態氧的特點,將PA與適體結合得到DBCO-sgc8-PA(D-sgc8-PA)。在證明其對細胞毒性和靶向功能后,作者進一步研究了D-sgc8-PA的靶向治療效果,如圖6a所示,與對照組相比,只有當PTK7和偶氮標記同時存在時,D-sgc8-PA才能在細胞表面共價修飾,顯示出最高的癌細胞殺傷效率。在放射治療領域,將放射性同位素99mTc4+用螯合劑DOTA與適體相連得到D-sgc8-DOTA適體,由于99mTc4+與DOTA之間有很強的配位作用,孵育60分鐘后得到高放射性標記穩定的D-sgc8-DOTA-99mTc4+(D-sgc8-99mTc)。如圖6b所示,通過邏輯計算將D-sgc8-99mTc共價標記在靶標細胞上時顯示出最高的殺傷效果。用γ-H2AX評估DNA損傷(圖6c),結果表明D-sgc8-99mTc共孵育的疊氮標記的CCRF-CEM細胞中檢測到顯著增強的DNA損傷。因此,該策略可介導的長期治療,并顯示出強烈的增強療效。圖6 DNA邏輯運算介導的精準光動力治療和放射治療總之作者設計了一個簡單而通用的策略來提高腫瘤治療的效率和精確度。這種新的方法是通過將基于適體的特異性識別能力與基于疊氮化合物/DBCO的生物正交化學結合起來實現的。以免疫檢查點阻斷療法為例,將疊氮糖作為“化學受體”結合到細胞表面糖蛋白“天然受體”上,使核酸適體與癌細胞發生共價交聯,能夠有效觸發精確和持續的抗腫瘤免疫治療。這種DNA邏輯計算介導的生物正交反應策略可以進一步擴展應用于精準的光動力治療或放射治療。https://pubs.acs.org/doi/10.1021/jacs.1c02016
Zhiyong Huang, et al. Regulating the Anticancer Efficacy of Sgc8–Combretastatin A4 Conjugates: A Case of Recognizing the Significance of Linker Chemistry for the Design of Aptamer-Based Targeted Drug Delivery Strategies. JACS, 2021.https://pubs.acs.org/doi/10.1021/jacs.1c03013