自從靶向細胞毒性 T 淋巴細胞相關蛋白 4 (CTLA-4) 的抗體 ipilimumab 成為美國食品和藥物管理局批準用于治療轉移性黑色素瘤的第一種免疫檢查點阻斷 (ICB) 療法以來,許多針對免疫檢查點的抑制劑如程序性細胞死亡1(PD-1)、PD配體1(PD-L1)和CTLA-4已經被開發出來。一些已經在各種癌癥中顯示出有希望的治療效果,例如黑色素瘤、非小細胞肺癌 (NSCLC) 和腎細胞癌 (RCC)。然而,也有研究表明,只有不到 30% 的 NSCLC、RCC 或黑色素瘤患者受益于 CTLA-4 或 PD-1/PD-L1 抑制劑,而其他癌癥類型的患者對 ICB 的反應或耐藥性較差治療。腫瘤促進免疫抑制微環境的一種機制是通過腫瘤抑制基因的缺失或突變,包括在 10 號染色體上缺失的編碼磷酸酶和張力蛋白同源物的基因 (PTEN)。這些基因的突變或缺失會導致小鼠模型對ICB治療反應差或耐藥。因此,腫瘤細胞中 PTEN 表達的再度恢復可以作為增強抗腫瘤免疫的一種手段。鑒于此,哈佛醫學院施進軍、Omid C. Farokhzad、國家納米科學中心王浩和中山大學梅林等人使用納米粒子將編碼 PTEN 的 mRNA 傳遞給小鼠中PTEN 缺陷的黑色素瘤或前列腺癌腫瘤,這恢復了 PTEN 蛋白的表達并促進了兩種腫瘤類型的抗腫瘤免疫反應。成果發表于Science Translational Medicine上,并被選為該期封面文章。
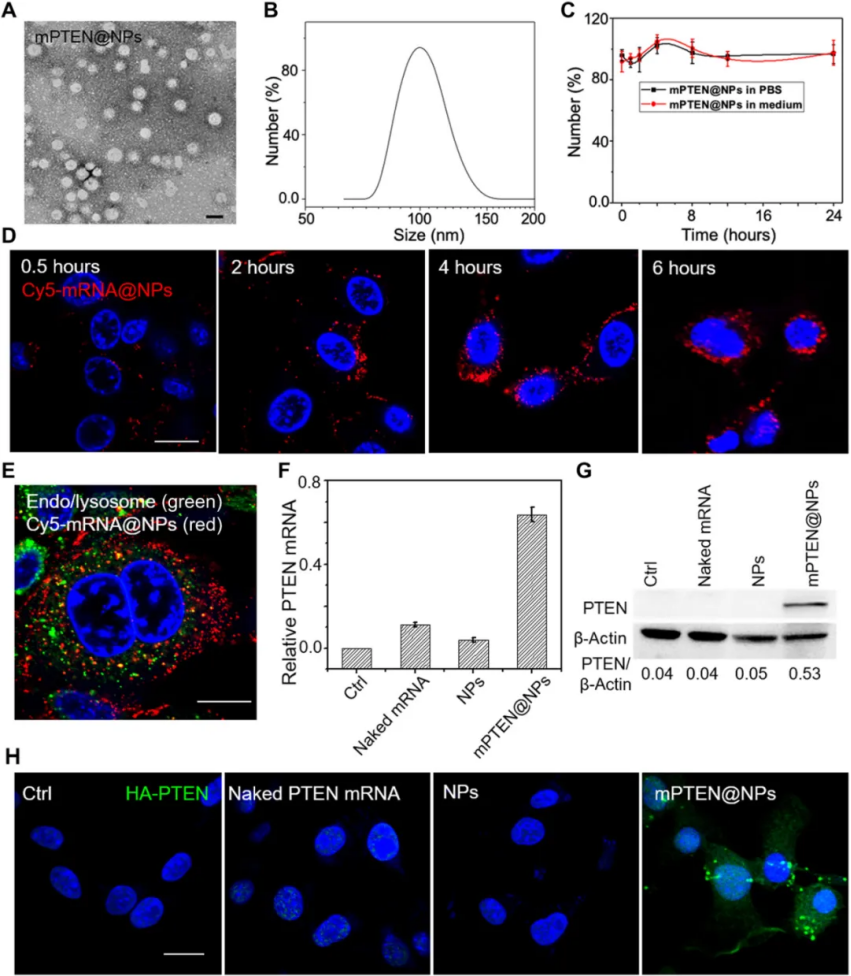
新的 PTEN mRNANPs 由甲氧基聚(乙二醇)-聚(乳酸-共-乙醇酸)(mPEG-PLGA)共聚物自組裝組成,其中 mRNA 與陽離子脂質類物質1,2-環氧十四烷改性第 0 代聚酰胺胺 (G0-C14)被載入納米顆粒中。
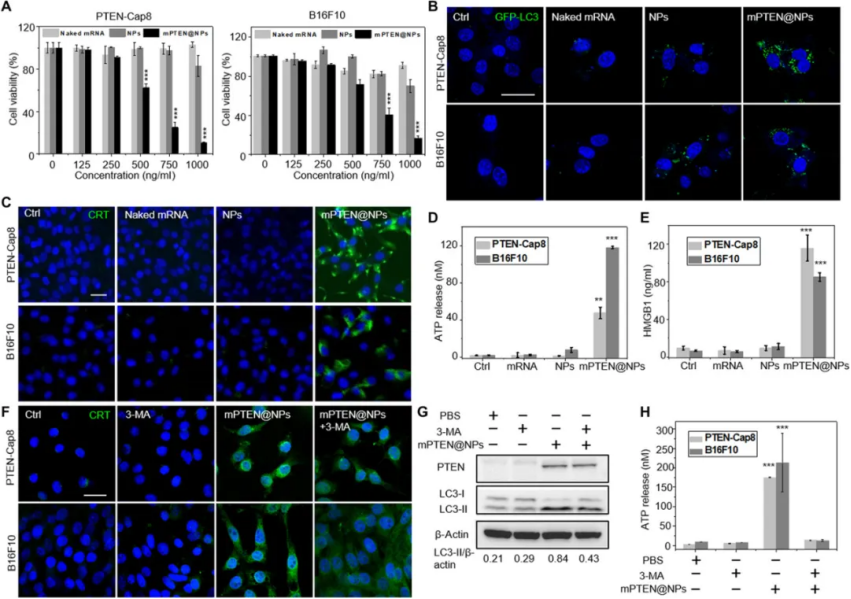
圖|mPTEN@NPs表征和體外抑癌基因 PTEN表達研究結果表明mPTEN@NPs通過誘導自噬激活和損傷相關的分子模式(DAMPs)釋放,成功觸發抗腫瘤免疫反應。此外,PTEN再激活減少了免疫抑制性腫瘤環境,提高了PTEN缺失或突變腫瘤對ICB治療的敏感性。
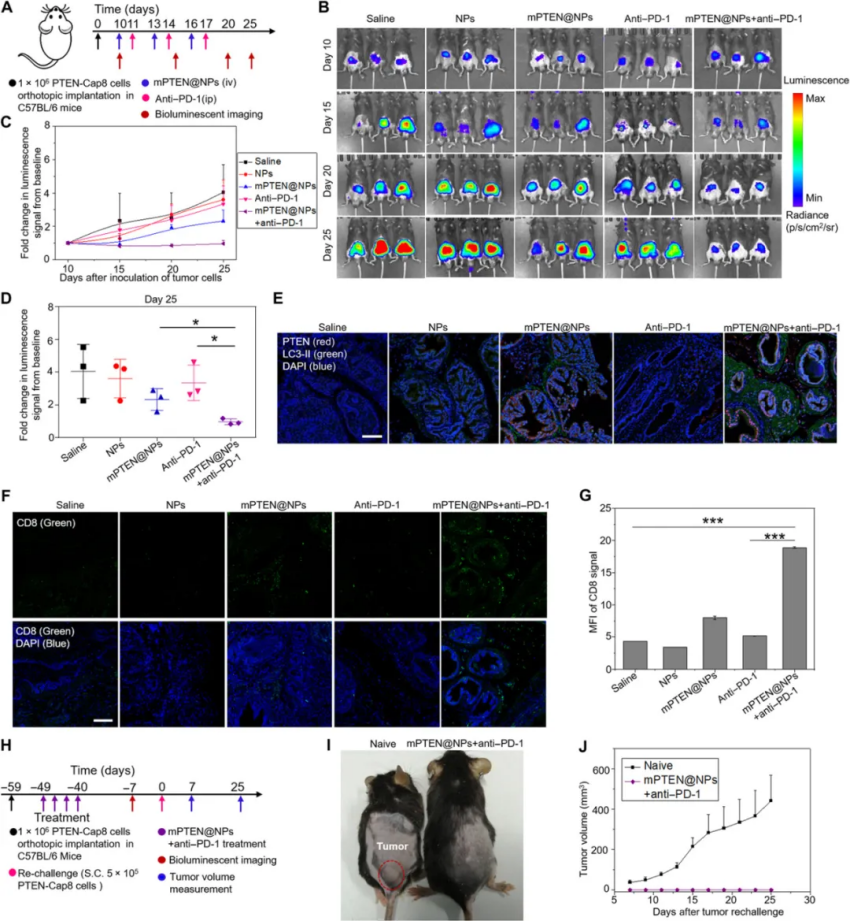
體內研究結果表明,PTENmRNA納米顆粒可以通過促進CD8+ T細胞浸潤腫瘤組織,增強促炎細胞因子(如白細胞介素12、腫瘤壞死因子-α和干擾素-γ)的表達,并減少免疫抑制性TME來逆轉免疫抑制性TME、調節性 T 細胞和髓源性抑制細胞。還比較了mPTEN@NPs 單獨應用、單獨應用抗-PD-1及其聯合應用于Pten突變黑色素瘤和Pten缺失前列腺癌的小鼠模型,驗證了聯合應用策略的有效抗腫瘤作用和免疫記憶。
綜上所述,該研究為引發抗腫瘤免疫反應提供了一種強大而有效的策略,該策略可能對具有 PTEN 缺失或突變的不同癌癥類型有用,期望將mRNA納米藥物與ICB治療相結合,可以開發出腫瘤抑制途徑特異性的精確免疫治療方法,從而實現有效、安全的腫瘤治療。Reactivation of thetumor suppressor PTEN by mRNA nanoparticles enhances antitumor immunity inpreclinical models. Science Translational Medicine 2021.DOI:10.1126/scitranslmed.aba9772https://stm.sciencemag.org/content/13/599/eaba9772