尋找高效無毒的材料來提高抗癌藥物的性能,是近幾十年來研究的熱點���。精心設計的合成材料由于其不確定的生物相容性和復雜的制造工藝而顯示出有限的臨床轉化����,但是自然存在的生物材料�����,例如細胞���、細胞膜和細胞衍生囊泡���,已經成為癌癥治療的替代藥物�����。細胞器是亞細胞水平上的生物效應器����,與DNA復制����、細胞代謝、蛋白質合成等生命維持活動密切相關。鑒于其相對中等的尺寸和單特異性功能���,細胞器可以作為新的候選材料進行探索,以豐富用于精確疾病治療的生物材料庫。近年來�,脂滴作為一種廣泛存在于脂肪細胞中的細胞器�����,由于其獨特的結構和在脂肪代謝和產熱中的重要作用�����,引起了人們的廣泛關注���。由于癌細胞可以利用脂肪細胞的脂質來支持其增殖����、侵襲和轉移����,脂質代謝已被用作癌癥治療的靶點。作為細胞內脂質儲存和運輸的庫�����,脂滴由一個脂質核心和一個磷脂單層組成����,作為一個脂質緩沖系統響應代謝變化��,并與其他亞細胞室相互作用以維持生理內穩態。此外,脂滴可以很容易地與其他細胞成分分離���,并且可以大量獲得,這為大規模生產鋪平了道路。鑒于此����,浙江大學顧臻教授�、南京大學朱俊杰教授和姜立萍教授等人利用脂肪細胞中的細胞器脂滴作為一種可控且生物相容的載體�,用于遞送抗癌藥物���。成果發表在Advanced Materials上�����,并選為該期的內封面�。

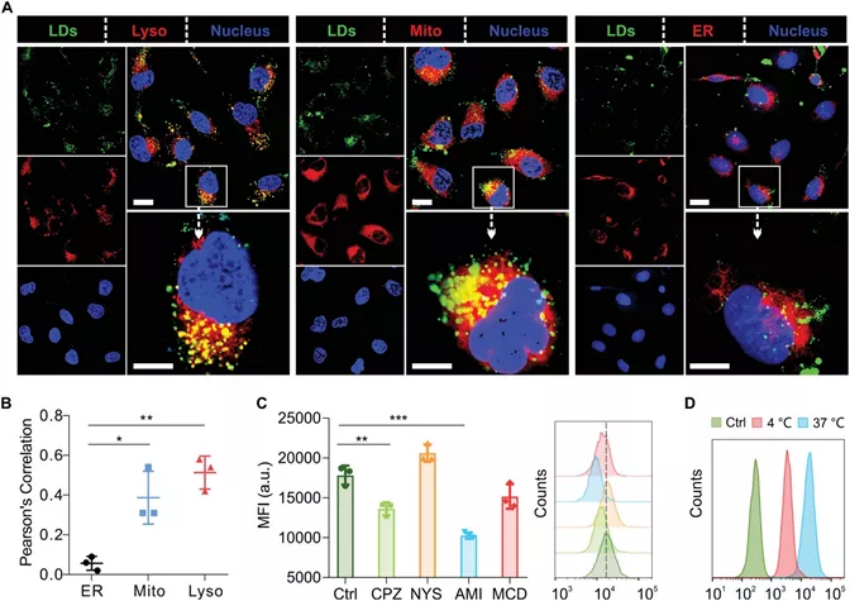
將脂滴設計成一種用于癌癥治療的通用藥物遞送系統��,因為富含脂質的隔室為親脂性藥物提供了理想的儲存庫���,并且腫瘤細胞內與異常脂質代謝的固有聯系可以被用來改善治療結果��。為了獲得含有豐富脂滴的脂肪細胞,3T3-L1前脂肪細胞首先在體外分化為脂肪細胞����,在此過程中球形脂滴逐漸成熟�����。一旦從脂肪細胞中分離出來,脂滴就保持了它們的形態完整性��,它們的大小從幾百納米到幾微米不等�。此外,研究人員還表明�,可以通過不同劑量胰島素的處理����,可以產生不同大小的脂滴����。另外,研究人員證明了在體外形成完全分化的脂肪細胞后����,脂質偶聯藥物可以特異性地加載到脂滴中。脂滴中的脂質含量和 Pyrolipid 的 ROS 生成能力均不受載藥過程的影響。因此,研究人員證明了工程化的脂滴可以通過包裹基于脂質的光敏劑�����,來協同增強癌癥光動力療法的療效�����。
在胞吞入癌細胞后�,Pyrolipid@LDs在激光照射下產生 ROS�����,通過氧化脂滴的脂質基質進一步引起脂質過氧化�����。此外,脂質的過度積累和氧化應激的升高破壞了細胞內的代謝平衡�����,并通過內質網應激啟動了細胞凋亡信號通路����。體內結果以及體外評估證實了 Pyrolipid@LDs 介導的光動力療法顯示出更好的抗腫瘤功效和最小的全身毒性�。
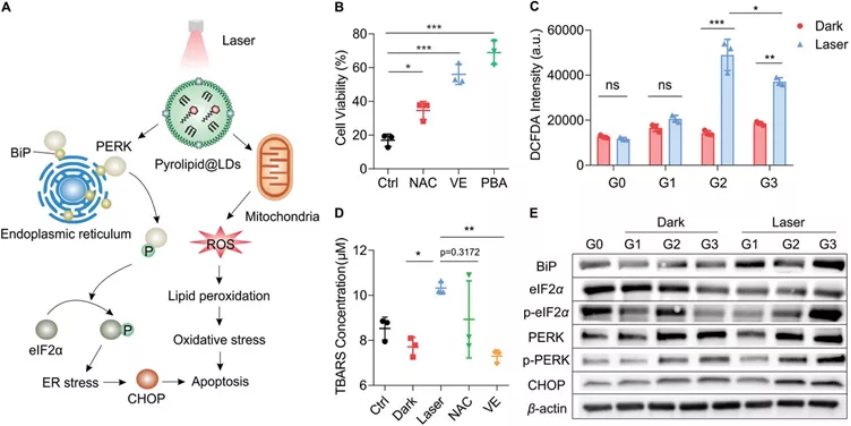
圖|Pyrolipid@LDs介導的抗癌作用機制研究綜上所述���,該研究證實了基于脂滴的藥物遞送系統的概念驗證�。這種細胞衍生的物質在生理環境中具有良好的穩定性,在適應不同應用時具有可控的理化性質����,與其他與代謝調節有關的細胞器保持相互作用,對正常器官的副作用有限,從而為臨床轉化提供了有前景的藥物載體。此外,冷凍干燥成粉末后���,脂滴可以穩定保存,這可能會促進其進一步商業化。這種基于細胞器的遞送系統可以將基于細胞的治療啟動到亞細胞水平��,為藥物遞送提供新的視角���,并為臨床轉化帶來希望��。Liang, T., et al.,Adipocyte-Derived Anticancer Lipid Droplets. Adv. Mater. 2021, 33, 2100629.https://doi.org/10.1002/adma.202100629








