
第一作者:Ruirui Li
通訊作者:趙東兵
通訊作者單位:南開大學
發展合成N雜環有機化合物的新方法對于有機化學的發展非常重要,通過擴環反應從具有應力的含π鍵的氮雜環出發,能用于構建較大的N雜環分子,但是此類方法中有時面臨著難以控制位點選擇性的問題、特定結構含π鍵的張力環有機分子。
有鑒于此,南開大學趙東兵等報道發展一種普適性合成方法學,在三元氮雜環、三元/四元環狀酮底物通過雙金屬協同催化實現二聚擴環反應,這種二聚反應具有高效率,能夠進行放大合成,為發展豐富的N雜環分子提供了一種非常有效的方法,比如能夠合成苯并氮雜卓酮、二氫吡啶酮、尿嘧啶等有機分子,這些分子廣泛存在于各種藥物分子、生物活性化合物分子。前期相關機理研究結果顯示,反應中的關鍵在于Pd0切斷酮分子張力環中的C-C鍵。
反應設計
三元環狀氮雜環由于環具有較高張力,廣泛用于有機合成領域,在該分子的催化轉化反應中,關鍵中間步驟是三元氮雜環結構向后過渡金屬配合物分子加成生成對應的金屬有機中間體,形成胺陰離子中間體;同時,三元/四元環酮分子中通過釋放環張力實現C-C鍵活化生成高反應活性金屬有機中間體同樣在多種反應中得到應用。
因此,作者設想反應能夠通過級聯催化反應過程,將三元氮雜環有機分子、三元/四元高張力環酮分子在同一個反應中進行合成,通過陰離子型胺向氮雜有機金屬物種進行親核加成,在一個反應中實現連續多個步驟。通過這種反應過程,將三元氮雜環與三元/四元環酮之間進行二聚,因此實現了擴環反應生成大環結構N雜有機分子。
該反應中關鍵性的挑戰在于設計合適的催化反應體系,從而能夠區分兩種反應物的反應活性。作者發現雙金屬協同催化體系能夠很好的實現這種擴環合成,而且能在反應中實現立體選擇性。
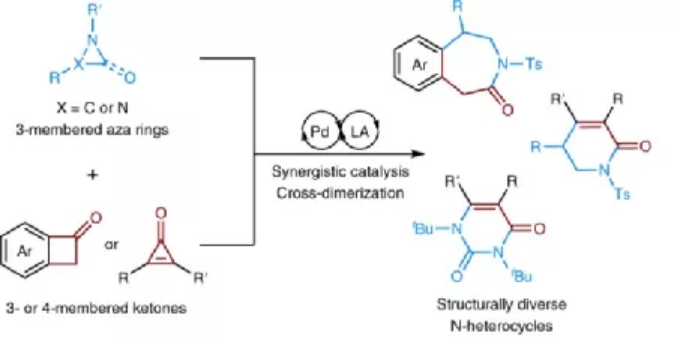
圖1. 該合成反應方法學的示意圖
反應情況

圖2. 合成反應條件優化
以N-對甲苯磺酰基苯基氮雜環丙烷、苯并環丁酮作為反應物,以Pd(PtBu3)2/吡啶惡唑烷配體作為催化劑體系,分別優化得到兩種與之配合的催化劑(分別為:MAD (雙2,6-二叔丁基-4-甲基苯酚)甲基鋁鹽)、BPh3/CF3SO3Li)。隨后考察了N雜環丙烷底物的兼容性,驗證了該反應具有較好的底物、官能團兼容性。
N雜環丙烷與環丙酮的擴環反應。催化劑為Pd、Cu雙金屬催化體系:Pd(PtBu3)2/CuBr/聯吡啶,該反應在室溫條件中進行,生成了二氫吡啶酮結構產物。
N雜環丙烷與叔丁基保護的二氮雜環丙烷酮反應。催化劑體系為:PdCl2/CuCl/P(OPh)3,該反應在30 ℃甲苯溶劑中反應,生成了尿嘧啶結構產物。
反應機理
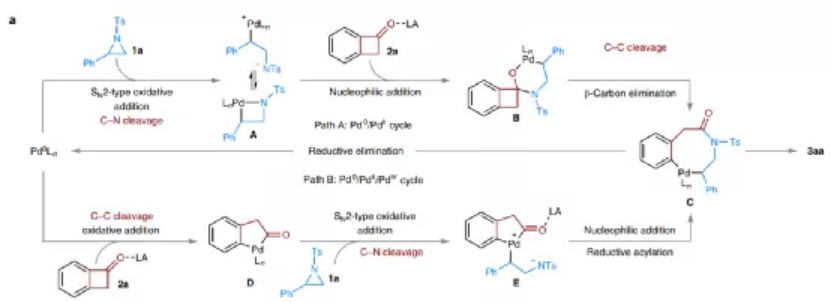
圖3. 兩種可能的反應機理
作者通過相關控制性實驗、DFT計算兩種方法結合,展示了反應的可能機理。在Pd0對催化反應中關鍵的張力環切斷的過程,分別可能通過Pd0/II催化循環(A過程)、Pd0/II/IV催化循環(B過程)進行反應。
在A過程中,Pd0對N雜環丙烷底物進行SN2氧化加成,通過切斷C-N鍵生成氮雜金屬環丁烷中間體A,隨后中間體A對環丁酮分子的C=O鍵進行親核加成反應生成氮雜六元環狀Pd中間體B,再通過β-C消除或者C-C鍵切斷生成氮雜8元環Pd中間體C,最后在中間體C上進行還原消除得到目標產物。
在B過程中,反應首先在苯并氮雜環丁酮底物上進行Pd0催化氧化C-C鍵切斷,生成五元環狀Pd中間體D,隨后通過SN2機理對氮雜環丙烷進行氧化加成生成中間體E、對C=O鍵進行親核加成、還原酰基化,生成中間體C,最后生成目標產物。
該反應方法中的Lewis酸起到兩種作用:通過與底物分子的羰基、磺酸基配位,促進張力環中C-C、C-N鍵的切斷;提高中間體氮陰離子(A或E)向羰基氧化加成的反應速率。
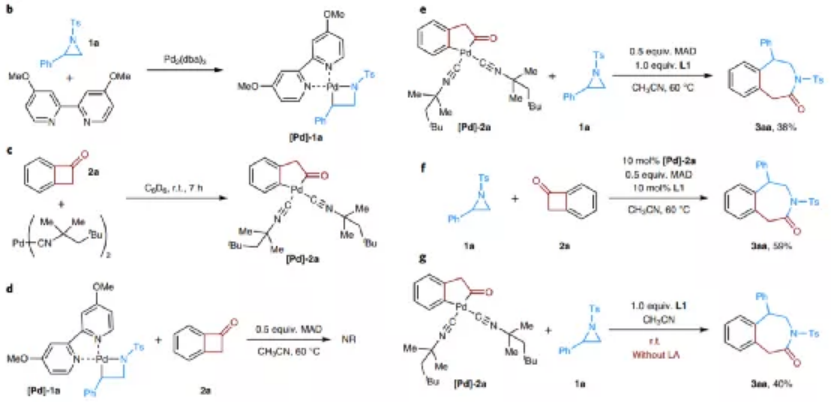
圖4. 反應機理研究
作者通過控制性實驗對反應機理進行驗證。通過化學計量比實驗,合成了五元Pd金屬環中間體[Pd]-1a、[Pd]-2a,隨后進行Pd金屬環中間體與另外一種反應物之間的化學計量比反應情況,發現N雜環丁烷結構[Pd]-1a與環丁酮分子之間的反應未發現目標;Pd金屬環戊酮結構[Pd]-2a能夠與N雜環丙烷反應生成目標產物,驗證了該反應機理能夠很好的進行,說明反應更有可能以Pd0/II/IV過程進行(B路線過程)。進一步的,作者通過DFT計算,研究了兩種不同的反應機理能量變化情況,驗證了Pd0/II/IV過程進行(B路線過程)過程中需要克服的反應熱力學阻礙較弱。
參考文獻及原文鏈接
Li, R., Li, B., Zhang, H. et al. A ring expansion strategy towards diverse azaheterocycles.Nat. Chem. (2021). DOI:10.1038/s41557-021-00746-7
https://doi.org/10.1038/s41557-021-00746-7











