熒光多路復用對于生物和生物醫學研究至關重要,通過使用光譜不同的熒光團,可以在一個樣本中同時顯示多種生物物種。然而,活體哺乳動物組織中的熒光復用仍然是一個重大的科學挑戰。已有的熒光團,如熒光蛋白和有機染料,大多發射光譜重疊的可見信號,這些信號可能會因組織異質性和深度位置而發生實質性改變,從而限制了可分辨標記顏色的數量。
盡管先進的光學顯微鏡和多光譜分解算法能夠實現亞細胞到納米級分辨率的高水平空間分辨率多路復用,但對于哺乳動物組織成像,由于熒光穿透有限,它們通常涉及使用侵入性采樣方法,如組織切片、清除或擴展。最近的發展表明,在第二個近紅外窗口(NIR-II;1,000–1,700nm)可提供更好的清晰度和更深的穿透深度。然而,許多已報道的NIR-II熒光團與可見探針具有相同的光譜重疊問題,事實上,發射紅移通常伴隨著光譜加寬。
鑒于此,復旦大學張凡、王尚風和華東理工大學張偉安等人報告了一種基于分子鉺 (III)-細菌葉綠素復合物的熒光團系統,該配合物具有大斯托克斯位移 (>750nm) 和窄的 NIR 到 NIR 下轉換光譜(半峰全寬≤ 32 nm)。這種雜化探針系統有助于實現高對比度和空間分辨率的多路NIR成像。成果發表在Nature Materials上。

研究人員使用內消旋四(五氟苯基)細菌葉綠素(TFPBC)并通過有效的合成路線獲得分子復合物 EB766,研究發現,EB766 在二氯甲烷中在 760 nm 處的激發導致在 1,530 nm 附近產生強烈的單色發光,當將這種復合物轉移到磷酸鹽緩沖鹽水中的磷脂膠束中時,發光強度降低了約 30%。
研究人員發現,從細菌葉綠素三重態到鉺 (III) 4I13/2 能級的快速 (2× 109 s–1) 和接近統一的能量轉移克服了臭名昭著的振動泛音淬滅,從而導致在水中能產生明亮而長壽命 (1.73 μs) 1530 nm發光。此外,EB766 在 760 nm 激發下在幻影組織中的最大光學穿透深度為 8 mm。
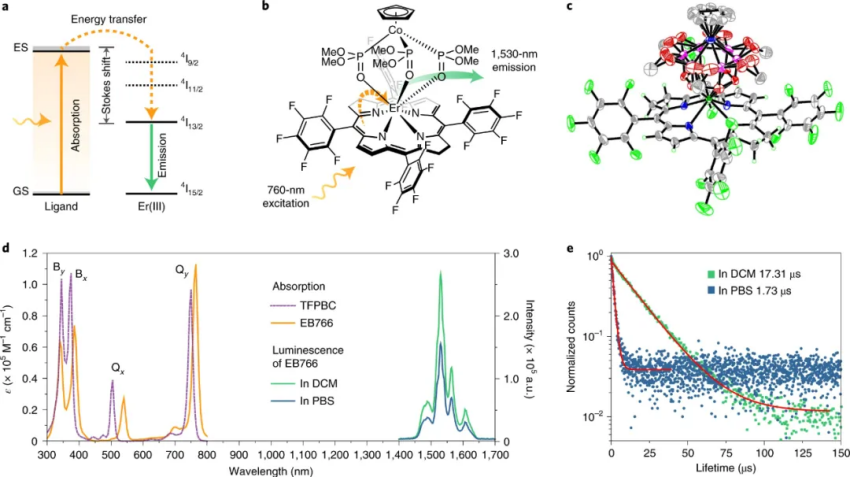
圖|EB766的發光原理、晶體結構和光譜特性
研究人員評估了 EB766 用于體內光學成像的能力。與在這些條件下完全漂白的吲哚菁綠 (ICG) 相比,EB766 在 760 nm 連續照射 30分鐘下具有相當大的光穩定性。此外,EB766 獨特的光譜特性支持基于激發或發射波長的多路復用,如:EB766與下轉換納米顆粒或Cy7.5連用。
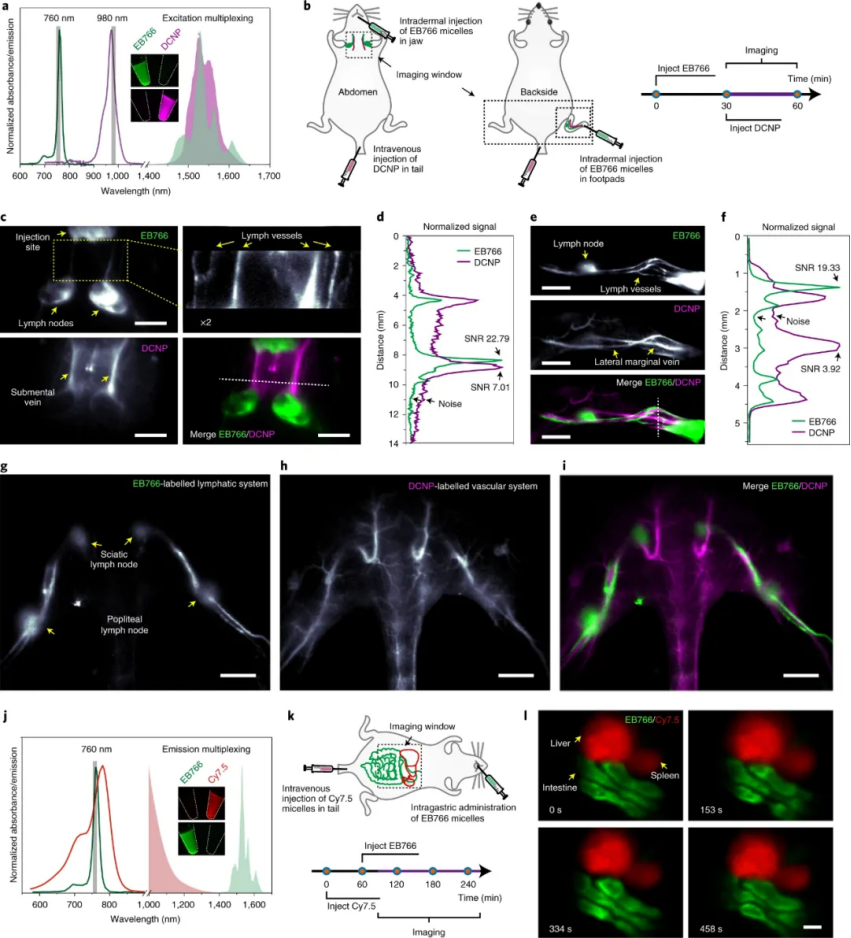
圖|體內全身 NIR-II 多重成像
研究人員還制備了一種基于EB766-牛血清白蛋白(BSA)復合物的細胞追蹤探針CT1530,該復合物與細胞穿透肽HIV-TAT結合,用于細胞內遞送。CT1530 保留了 EB766 的光譜性能,在短波長區域(800-1,000 nm)中觀察到配體熒光,在長波長區域(1,400-1,600 nm)中觀察到 Er(III) 發光。這種源自一個分子的雙發射特性使能夠對兩個波長區域的活體成像性能進行無偏見的比較。總而言之,研究人員展示了復合物在活體小鼠動態循環和代謝過程可視化中的激發/發射多路復用能力,并通過顱骨追蹤小鼠大腦中的癌細胞轉移。
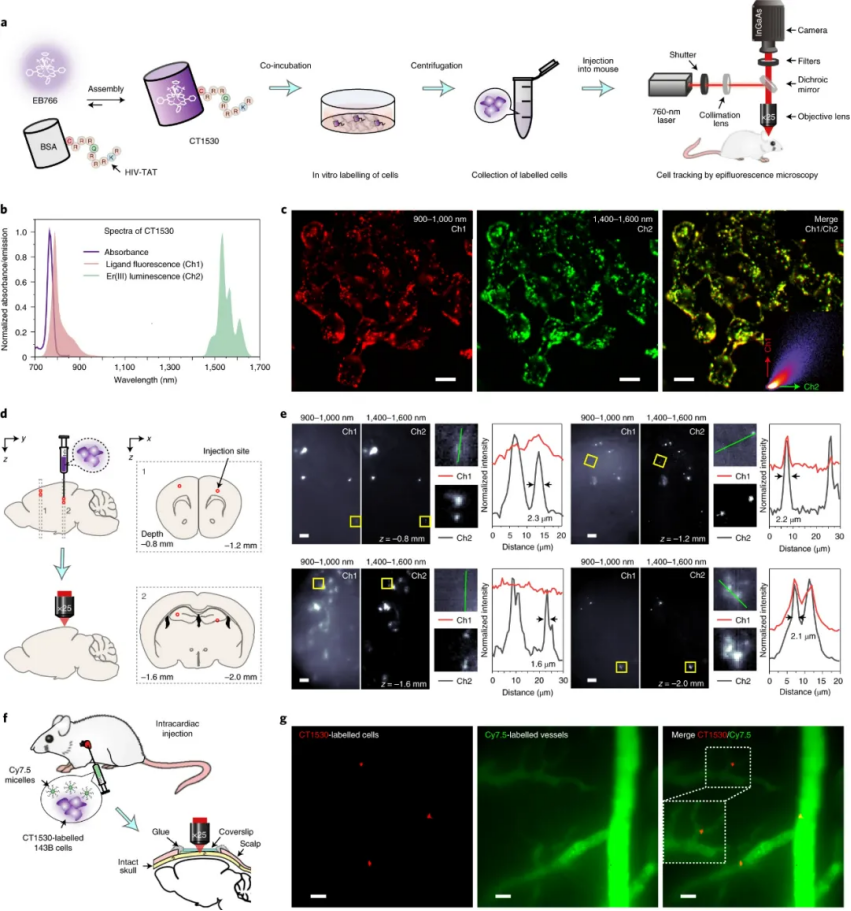
圖|小鼠腦癌細胞轉移的活體多重成像
綜上所述,研究人員在此報告了一種新的熒光團系統,即鉺 (III)-細菌葉綠素復合物,它具有大斯托克斯位移和NIR-to-NIR 窄帶光譜,是哺乳動物活體中深層組織 NIR 多色成像的理想工具。由于其獨特的光譜特性,這些配合物和其他現有的NIR-II熒光團之間的光譜重疊可以通過激發/發射復用方便地解決。
這種強大的多路復用能力,尤其是在“組織最透明”窗口(1,500–1,700 nm) 中,能夠以較少的侵入性在體內提供有關感興趣點生物分子、細胞相互作用和解剖精細結構(如脈管系統、前哨淋巴結和周圍神經)的高分辨率信息,促進外科、診斷和生物學研究。
值得注意的是,復旦大學張凡、凡勇和河北大學楊艷民等人于6月10日發表在Nature Nanotechnology上報道了一系列可被x射線激活的摻雜鑭系元素的納米顆粒(Ln-PLNPs),其在近紅外II區窗口具有超過 72 小時的發光壽命,實現在深部組織中顯示出高對比度和高分辨率生物成像。(用于 NIR-II 成像的 X 射線激活持久發光納米材料)

參考文獻:
Wang, T., Wang, S., Liu,Z. et al. A hybrid erbium(III)–bacteriochlorin near-infrared probe formultiplexed biomedical imaging. Nat. Mater. (2021).
https://doi.org/10.1038/s41563-021-01063-7
課題組介紹












