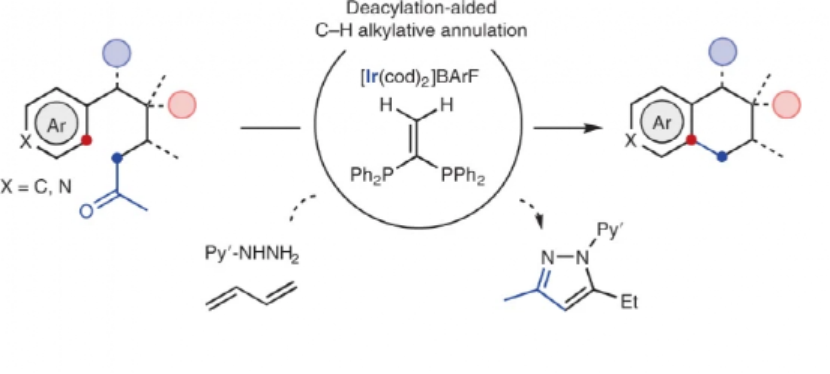
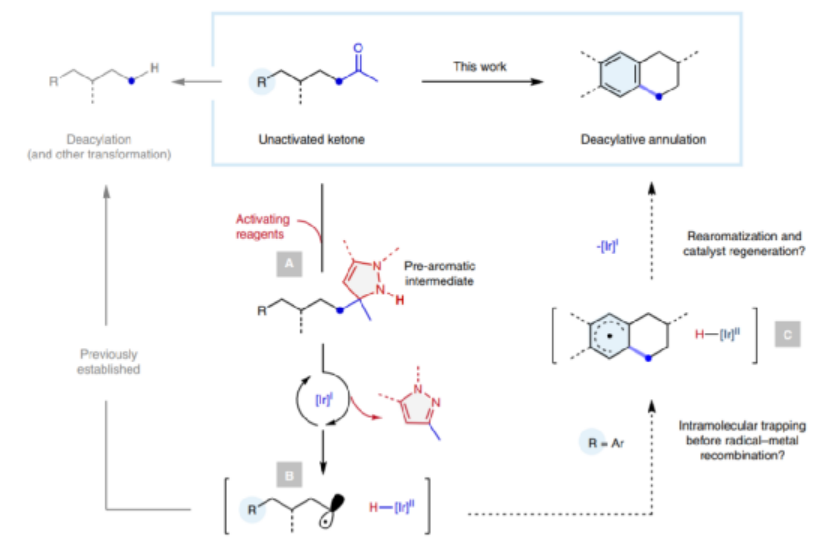
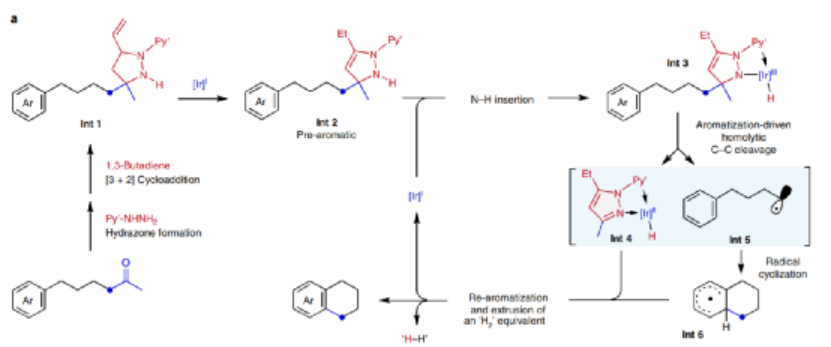
1.發展了一種通過分子內自由基成環���,合成多環有機分子的方法
2.該反應方法避免在底物上安裝高反應活性基團�,反應在非氧化/還原條件進行,避免了強酸/強堿反應環境����,因此實現了更好的官能團���、底物兼容芳烴����、雜芳烴稠環結構在生物活性分子中廣泛存在�����,芳烴分子C-H鍵與芳環上栓系的烷基基團之間成環反應為直接合成這種稠環結構分子提供了一種直接方法,但是該方法通常需要分子修飾特定的反應基團,或者可能難以實現成環反應�����。有鑒于此��,芝加哥大學董廣彬�����、加州理工學院Yan Xu等報道通過一種脫乙酰基自由基成環反應方法����,合成了大量的芳基稠環有機分子化合物��。該反應通過肼、丁二烯共同活化酮分子的乙?�;?,切斷酮的α-C-C鍵,隨后生成烷基自由基��,進行分子內脫氫成環反應���。該反應方法學的意義在于�����,以廣泛存在的酮作為生成自由基的前驅分子���,實現了流水線式合成結構復雜的多環結構有機分子,而且具有很好的官能團兼容���。芳烴、雜芳烴的稠環結構在藥物分子�����、天然產物���、生物活性分子中廣泛存在����,目前合成此類分子理論上有多種可行方法,其中直接從線性分子出發進行分子內芳環C-H烷基化成環的過程是一種最直接和有效的方法,該過程能夠免于對芳烴分子進行預官能團化修飾�����。這種直接合成芳烴的方法的缺點在于端基位點的可選官能團非常少�,需要與具有高反應活性的官能團配合,比如烷基鹵化物��、黃原酸基團、芳基硒化物、烯丙基砜、氧化還原活性酯等結構/基團����。向底物引入這些高反應活性官能團并不容易實現�����,而且此類高反應活性官能團在經歷多步反應過程中可能轉變。因此通過反應活性較弱的官能團進行反應受到關注,近期相關工作報道發現能夠在非活化烯烴通過金屬-負氫的氫原子轉移在溫和條件實現活化烯烴C-H鍵進行自由基成環反應�,還有相關報道發現能夠在羧酸官能團上通過氧化脫羧反應實現自由基關環�。雖然這些非常重要的進展廣泛拓展了該領域的發展���,一些對原子轉移催化反應��、對氧化反應敏感的官能團仍難以兼容該反應。作者發展了一種通過脫乙酰基進行C-H鍵成環的方法,因此能夠將廣泛存在的酮類有機分子作為反應物�,能夠在廣泛的芳烴���、雜芳烴分子實現分子內成環構建多環有機分子�����。該反應方法表現了原子經濟優勢和較好的官能團兼容,實現了酮作為高活性的自由基試劑前驅分子����,實現了在非氧化還原條件和pH中性條件的溫和反應條件進行反應�����。目前已知酮的α-C-C鍵均裂能通過紫外光Norrish-Young反應實現,或者將酮轉化為肟酯/活性酯/三級醇隨后進行β-切斷�����。作者并不使用以上兩種方法���,而是利用近期發展的Ir催化方法�����,以芳基化作為驅動力�,實現切斷酮的α-C-C鍵�����。具體通過酮���、肼、烯烴三組分反應生成五元環結構中間體(A)����,隨后通過生成芳香環吡唑作為驅動力���,實現Ir(III)催化切斷酮α-C-C鍵����,生成相應的烷基自由基��,同時Ir催化劑變成Ir-H中間體(B)��。隨后碳中心自由基被分子內的芳烴捕獲和成環,生成對應的環狀自由基中間體(C)���。隨后進一步通過氫的消除得到稠化雙環產物。優化的反應條件�。以攜帶芳基的己酮作為底物����,肼和1,3-丁二烯作為活化試劑�����,首先加入對甲苯磺酸(TsOH)作為催化劑進行反應��,隨后加入10 mol % [Ir(cod)2]BArF/雙芳基磷修飾的乙烯作為催化劑體系���,在160 ℃進行反應�,實現了脫乙?��;森h����。底物兼容性��。首先考察了該反應對芳烴結構的兼容情況����,發現苯�、萘、菲�����、蒽���、芘等不同芳環數目的芳烴都能夠很好的反應得到目標產物�����。隨后考察了芳烴的缺電子/富電子情況對反應的影響����,發現不同芳環電子濃度的底物都能兼容該反應��。該反應對能夠生成6元環的情況最有利�����,對于生成5元環、7元環的反應情況產率有所降低��,這是因為自由基被氫淬滅導致無法關環�,或者能夠與丁二烯反應導致副反應。該反應方法能夠在底物中同時形成兩個環�,比如從兩個芳環底物出發生成結構對稱的四環產物�����。底物中的官能團兼容性�����。該反應兼容底物分子中含有Weinreb酰胺基���、酯基�����、腈基、芳鹵基的情況�。此外����,該反應方法學兼容芳雜環結構��,比如吲哚�����、喹啉、二苯并呋喃、苯并噻吩����、咪唑�、喹唑啉酮等結構����。因此能夠合成一些具有藥物活性的稠環骨架結構分子����,此類分子結構通過現有方法難以合成得到�。而且��,當底物為噻吩或者異喹啉酮��,反應容易進行脫芳基化,因此能夠得到飽和度更高的雜環產物�����。合成應用���。作者考察了該反應方法學在合成稠芳環有機分子的效果�,該反應能夠用于合成抗驚厥劑(Anticonvulsant)的關鍵中間體分子。目前相關報道的方法需要5步��,總反應收率僅12 %����;通過作者發展的這種方法僅需要2步反應,總反應收率達到43 %;作者發現該反應能合成黃嘌呤(xanthine)分子。報道方法需要3步反應,通過作者發展的方法能夠在兩步反應中產率達到原來的兩倍;此外�����,該反應能夠用于復雜結構含N雜環多環有機分子的后期衍生化�����,而且作者發現當復雜有機分子底物上含有多種活性官能團����,比如烯基����、氰基��、富電子芳烴�����、羰基等在強Lewis酸/氧化型反應環境/還原型反應環境中難以穩定存在的底物,都能夠兼容這種反應方法學�����。作者基于相關控制性實驗�、理論計算結果,提出了可信度較高的反應機理:反應首先通過酮、肼反應生成腙,隨后與活化劑1,3-丁二烯進行Ir催化[3+2]環加成生成中間體Int 2�,緊接著通過Ir(I)催化進行N-H鍵氧化加成�,生成Ir(III)-H中間體Int 3���。隨后在芳香性驅動力作用進行C-C鍵均裂生成吡唑-Ir(II)-H中間體Int 4和烷基自由基中間體Int 5���。隨后通過自由基成環穩定作用得到Int 6�,最后消除氫得到產物,作者猜測最后消除氫的過程可能通過摘氫反應或者被Ir(II)-H中間體捕獲得到最終產物�����。Zhou, X., Xu, Y. & Dong, G. Deacylation-aided C–H alkylative annulation through C–C cleavage of unstrained ketones. Nat Catal (2021).DOI: 10.1038/s41929-021-00661-7https://www.nature.com/articles/s41929-021-00661-7