骨關(guān)節(jié)炎 (OA) 是整個(gè)關(guān)節(jié)的慢性退行性疾病,會(huì)導(dǎo)致疼痛和活動(dòng)能力喪失,從而導(dǎo)致生活質(zhì)量下降。OA是由機(jī)械和生化因素之間復(fù)雜的相互作用引起的。骨關(guān)節(jié)炎的進(jìn)展與損傷軟骨中細(xì)胞外基質(zhì)的酶降解引發(fā)的炎癥有關(guān)。鑒于此,范德堡大學(xué)Craig L. Duvall等人展示了一個(gè)局部注射的納米顆粒庫(kù),其功能化的抗體靶向 II 型膠原蛋白并攜帶靶向基質(zhì)金屬蛋白酶 13 基因 (Mmp13) 的小干擾 RNA,該基因可分解II型膠原蛋白。成果發(fā)表在Nature Biomedical Engineering上。

本研究中描述的治療使用抗體靶向來(lái)減少關(guān)節(jié)清除,在急性和嚴(yán)重創(chuàng)傷后骨關(guān)節(jié)炎小鼠模型中,實(shí)現(xiàn)了高達(dá) 90% 的靶基因沉默,在為期 6 周的研究中,即使在最終治療后 1 周,基因沉默仍然有效。MMP13抑制作用抑制了與組織重構(gòu)、血管生成、先天免疫反應(yīng)和蛋白質(zhì)水解相關(guān)的基因簇。
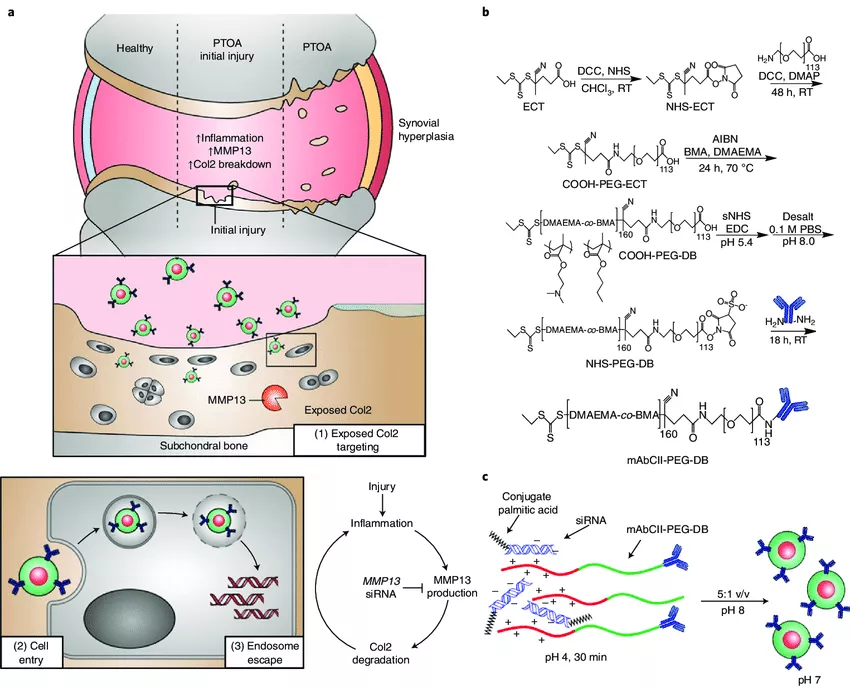
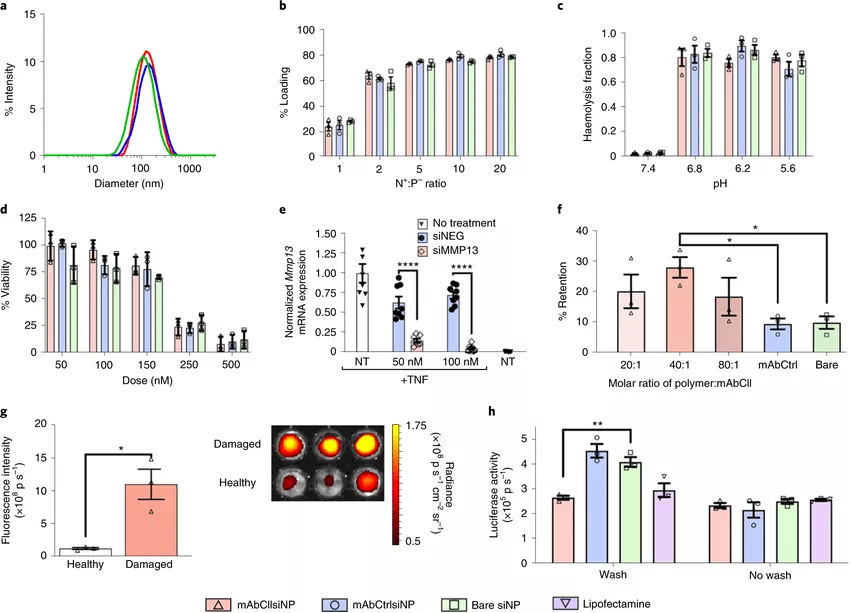
圖|物化表征
此外,注射劑量的局部保留和 MMP13 的特異性靶向有望減少與全身遞送、非選擇性合成小分子 MMP 抑制劑相關(guān)的毒性問(wèn)題。這種方法的治療相關(guān)性在積極的長(zhǎng)期創(chuàng)傷后OA 模型中得到了例證,其中治療導(dǎo)致 Mmp13 表達(dá)減少 80%,這保護(hù)軟骨完整性,改善總關(guān)節(jié)組織病理學(xué),減少異位礦化和骨贅形成,軟骨下骨破壞較少。皮質(zhì)類固醇治療沒(méi)有看到這些有益效果。該論文還表明,關(guān)節(jié)內(nèi)注射納米顆粒比單次注射或每周注射類固醇甲潑尼龍更能減少疾病進(jìn)展。
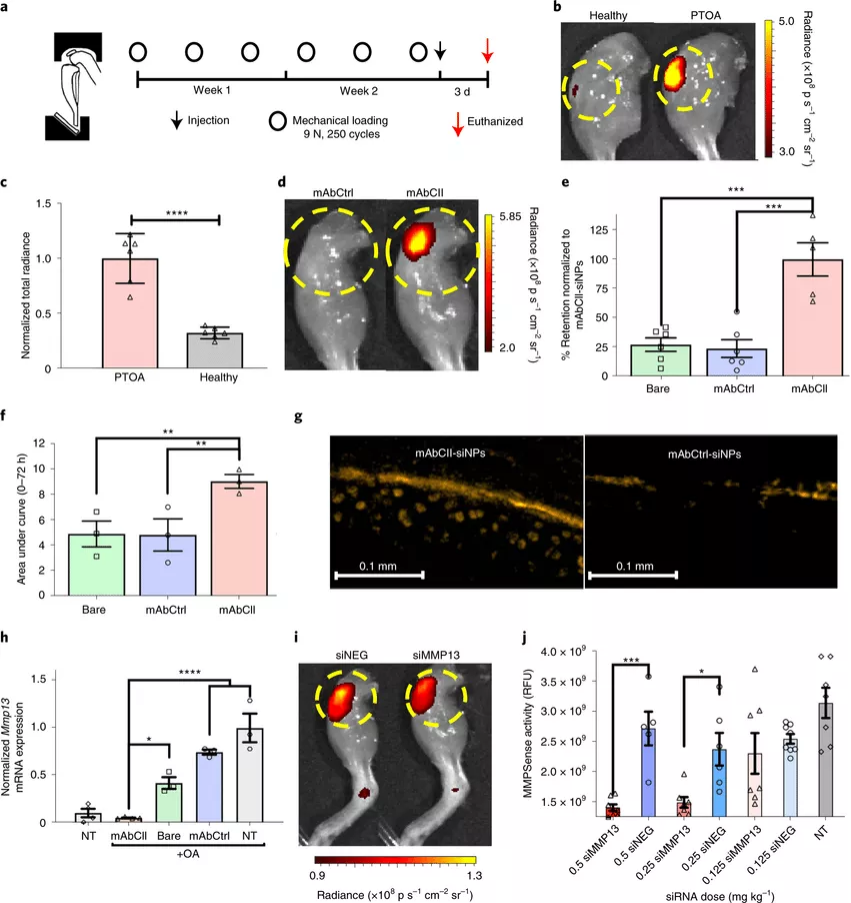
圖|MAbCII-siNP/siMMP13 在 PTOA 短期小鼠模型的膝關(guān)節(jié)中相對(duì)于裸露和 mAbCtrl 功能化的 siNPs 局部保留并有效地使 Mmp13 表達(dá)沉默綜上所述,使用基質(zhì)錨定納米載體對(duì) Mmp13 進(jìn)行 RNAi 沉默以延長(zhǎng)骨關(guān)節(jié)炎關(guān)節(jié)內(nèi)的保留,在阻止 創(chuàng)傷后OA進(jìn)展方面提供了相當(dāng)大的治療益處。這項(xiàng)研究驗(yàn)證了這樣一個(gè)概念,即用于原位形成的基于納米顆粒的貯庫(kù)的局部保留的基質(zhì)結(jié)合是提高細(xì)胞內(nèi)生物制劑(如 siRNA)作用的效力和壽命的可行策略。雖然較大(微尺度)顆粒的制劑也可能有助于保留,但由于較大顆粒的內(nèi)吞作用、內(nèi)體逃逸和組織穿透的限制,預(yù)計(jì)它不會(huì)對(duì)在細(xì)胞內(nèi)起作用的藥物有效。通過(guò)靶向骨關(guān)節(jié)炎軟骨受損的細(xì)胞外基質(zhì)中的膠原蛋白來(lái)持續(xù)藥物滯留也可能是用其他疾病修飾藥物治療骨關(guān)節(jié)炎的有效策略。Bedingfield,S.K., Colazo, J.M., Yu, F. et al. Amelioration of post-traumatic osteoarthritisvia nanoparticle depots delivering small interfering RNA to damaged cartilage.Nat Biomed Eng (2021).https://doi.org/10.1038/s41551-021-00780-3








