指導和校對:陳偉 教授
近期,美國德克薩斯大學陳偉教授團隊與合作者在Signal Transduction and Targeted therapy (Nature IF:18.187), Advanced Functional materials (IF: 18.808), Bioactive Materials (IF 14.59), Materials Today Physics (IF 9.298), PNAS (IF 11.205), Coordination Chemistry Reviews (IF 22.315), J. Mater. Chem. C (IF 7.393) 和Materials Science and Engineering C (IF 7.328) 等國際知名刊物上發表了一系列論著,進一步介紹了該團隊發明的新一代納米光敏劑銅半胱胺的奇特效應。這類新型納米光敏劑除了可以用于癌癥治療之外, 還可以用于細菌或病毒感染的治療,并且它作為發光材料還可以在發光顯示和光合作用的增強方面有潛在的應用。陳偉教授這一發明曾被美國電視節目CBS專門報道過,為這種新型銅半胱胺光敏劑的應用和產業化奠定了基礎。
癌癥是目前世界上影響人類健康的最大難題之一,被稱為“二號殺手”,因此怎樣治療癌癥備受關注。放療是目前最常用的治療方式之一;然而,放療在治療腫瘤尤其是深部腫瘤的同時,會隨劑量增加而加重對鄰近正常組織的損傷。如果能夠在保證腫瘤治療效果的前提下,盡可能地減少放射治療的劑量,將有助于提高放射治療的安全性。
隨著納米技術的發展,光動力治療(PDT)逐漸成為一種具有眾多優勢的癌癥治療手段。然而包括紫外光、可見光、近紅外光波段在內的光誘導的PDT在人體組織穿透力較差,能量衰減明顯。因此,在深部腫瘤的治療方面一直存在較大的困難。為了有針對性的解決這些問題,陳偉教授在2006年率先提出了X射線激發PDT治療, 目前這已經成為一個研究熱點。
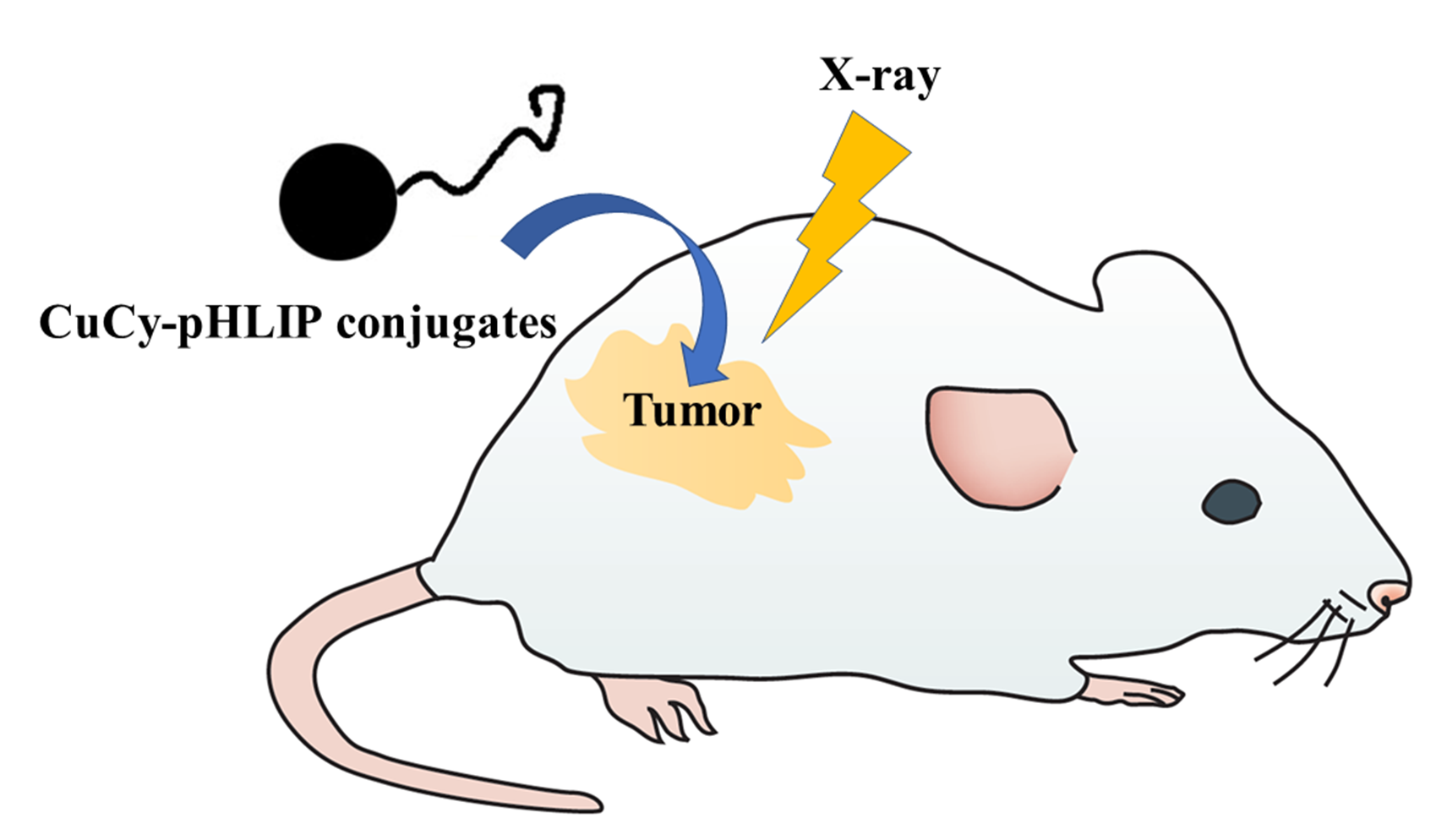
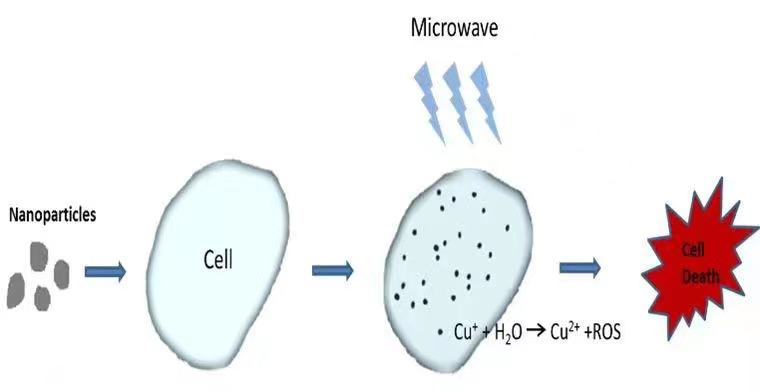
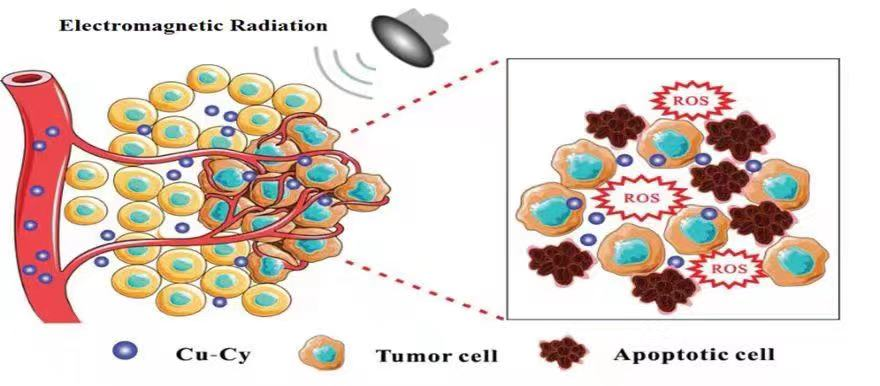
圖1. 銅半胱胺光敏劑在X光、微波或超聲作用下癌癥治療原理示意圖。
陳偉教授在2014年研發的銅半胱胺Cu-Cy光敏劑是一種多功能的新一代光敏劑。這個光敏劑比傳統光敏劑的優勢在于:Cu-Cy不但可以在一般的光(比如紫外光), 而且還可以在超聲、X射線或微波等作用下產生活性氧(ROS)(圖1)。因此它不但可以用于治療淺表癌癥還可以用于深部癌癥的治療,最近的結果還表明這個新的光敏劑還可以有效地殺死細菌或病毒 (圖2)。可見它的應用是非常廣泛的。
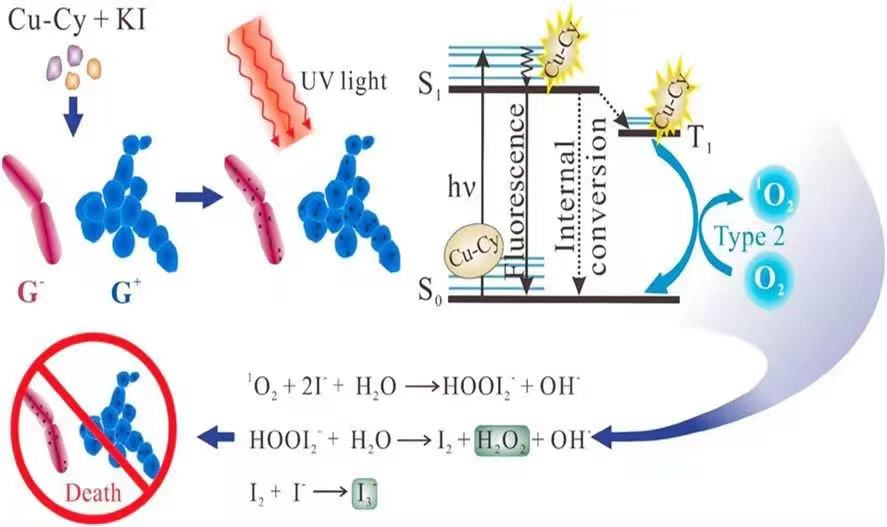
圖2. 銅半胱胺光敏劑殺死細菌的機理圖。
近來對這一材料的研究又得到了進一步的擴展。德克薩斯阿靈頓分校陳偉課題組和湖南師范大學張漫波課題組合作找到了發光性能可調,化學穩定性增加和暗毒性降低的Cu-Cy-X(X=F, Cl, Br, I)系列納米光敏劑。德州大學阿靈頓分校Huda教授課題組通過理論計算證實了Cu-Cy-X系列光敏劑的同構性和發光特性,并初步探索了這些光敏劑的細胞暗毒性和在紫外光和微波激發下對MCF-7細胞的光動力和微波動力效應,結果顯示,相比于Cu-Cy-Cl, Cu-Cy-I具有較低的細胞暗毒性和更好的微波增敏效應。這些新型光敏劑為光動力治療和微波動力治療開辟了新途徑。除此之外,由于它們具有很強的熒光,在固態照明和顯示,熒光傳感,微量水檢測,細胞標記和體內成像等方面都有潛在的應用(圖3和圖4)。
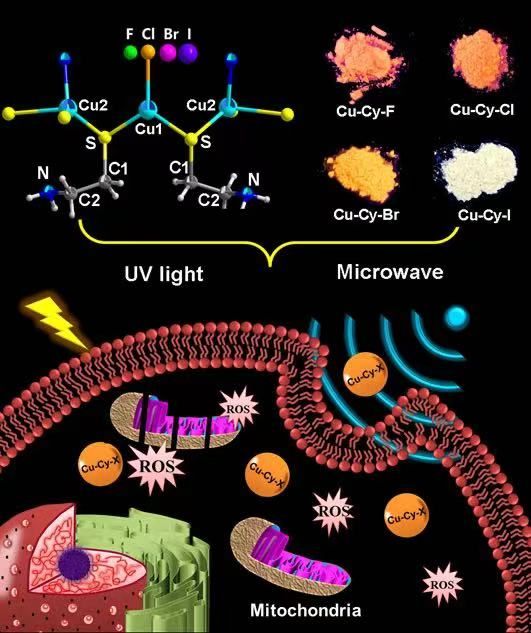
圖3. Cu-Cy-X的結構、光致發光和ROS生成示意圖。
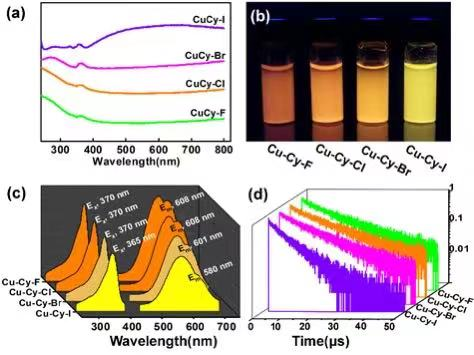
圖4. (a) Cu-Cy-X懸濁液的UV-vis吸收光譜;(b)室溫下Cu-Cy-X紫外線的照射下(360 nm 光照射);(c) Cu-Cy-X懸浮液的激發和發射光譜;(d) Cu-Cy-X發射衰減曲線。
根據已報道的Cu-Cy結構,中心金屬銅離子與半胱胺和氯離子兩種配體進行了配位。其中半胱胺螯合配體通過配位構建了Cu-Cy的二維層狀結構,而末端氯離子則由于中心金屬離子Cu(1)的配位環境,對Cu-Cy二維層狀結構沒有貢獻。根據酸堿軟硬理論(HSAB),Cu-Cy中的亞銅離子屬于軟酸,而氯離子屬于硬堿,所以Cu-Cl的共價鍵作用較弱,這降低了Cu-Cy的化學穩定性。基于以上分析,他們在Cu-Cy合成體系中引入具有軟堿性質的Br-和I-,得到了Br和I取代氯的Cu-Cy-Br和Cu-Cy-I,從而構建了穩定性更高、發光可調、單線態氧1O2產生能力更強的新型增敏劑。
他們通過監測Cu-Cy-X在去離子水中的紫外-可見吸收和光致發光強度,研究了其發光的物理穩定性。Cu-Cy-X (X = F, Cl, Br, I)懸濁液在第1天,第3天和第21天的紫外-可見光譜顯示隨著時間的推移,Cu-Cy-I的吸收峰沒有明顯變化,說明Cu-Cy-I比其他化合物更穩定。在觀察中,可以看出Cu-Cy-X的熒光發射強度在第3天沒有發生明顯的改變,表明Cu-Cy-X可以穩定48 h。第21天的測試結果顯示Cu-Cy-F, Cu-Cy-Cl,和Cu-Cy-Br發射強度大幅下降,而Cu-Cy-I的發射強度則基本保持不變,說明Cu-Cy-I在水溶液中具有良好的發光穩定性。
鑒于Cu-Cy-Cl在紫外光激發下具有良好的1O2生成能力,有理由期望Cu-Cy-Br和Cu-Cy-I具有類似的性能。他們采用TEMP作為1O2的捕獲劑,測量了Cu-Cy-X的EPR光譜,所有敏化劑均表現出TEMPO.的1:1:1三重態特征信號,說明Cu-Cy-X系列都能響應紫外光產生單線態氧。在相同的實驗條件下,Cu-Cy-X的1O2生成效率為I > Br > Cl,說明Br-和I-的配位取代,提高了Cu-Cy-X的單線態氧生成能力。RNO-ID法也顯示 RNO的吸光度在紫外光照射下被Cu-Cy-X產生的1O2猝滅,猝滅速率為I > Br > Cl,與EPR結果一致。
在用紫外光(365 nm)照射Cu-Cy-X處理過的細胞10 min后,他們評估了Cu-Cy-X在紫外光誘導下的PDT效應,由于Cu-Cy-I銅離子浸出率較低,所以它具有較低的細胞暗毒性。這一系列新材料除了在醫學上的潛在應用之外, 在光學傳感,發光和光合作用增強方面都有比較好的應用前景。
這類新一代的光敏劑最大的優點就是可以在X光,超聲或微波的激活下產生活性氧從而殺死癌細胞或病毒。能被X光激活的應用有比較明顯的優越性,因為這可以與現代的放療技術相結合以提高治療效果并減少有害的放射性劑量和副作用。對于這方面的應用一個關鍵的問題就是:這類新型光敏劑能否在臨床醫用的X射線作用下進行有效治療。為此,美國德克薩斯大學陳偉教授聯合中南大學湘雅二醫院陳翔宇教授和肖恩華教授在這方面進行合作,首次證明了這類光敏劑可以在臨床醫用X射線的作用下有效工作,他們的成果發表在科愛出版社創辦的期刊Bioactive Materials上:Study of copper-cysteamine based X-ray induced photodynamic therapy and its effects on cancer cell proliferation and migration in a clinical mimic setting。 在此他們首次利用深部腫瘤模型和臨床直線加速器,在較低的射線劑量下去探究Cu-Cy的抗腫瘤效果。不僅如此,他們還進一步嘗試去觀察抗腫瘤的機制。結果表明,Cu-Cy介導的X-PDT不僅能抑制腫瘤的生長,而且在動物體內實驗中表現出了較好的安全性。
他們在小鼠體外實驗首先測量了Cu-Cy的粒徑、分散度、吸收曲線。在隨后的細胞實驗中,從多個細胞水平(包括HepG2、Li-7、SK-HEP-1、4T1)分別驗證了Cu-Cy介導的X-PDT如何抑制腫瘤的增殖和遷移。實驗結果均表明了Cu-Cy顯著的抗癌作用,以及在未干預條件下Cu-Cy所具有的良好安全性。體內核磁共振(MRI)的實驗結果表明,在Cu-Cy 介導的X-PDT治療組中能發現生長明顯受限的腫瘤,通過全身掃描的結果并未發現有新發轉移灶的出現。在整個治療過程中,小鼠沒有出現明顯的毒性反應以及異常的行為改變。此外,通過構建兔子的VX2肝臟原位腫瘤大動物模型,從多個動物模型的實驗中進一步驗證了Cu-Cy 介導的X-PDT治療的有效性和安全性。
為了更加深入地了解Cu-Cy介導的X-PDT治療抑制腫瘤表型背后的潛在分子機制,他們通過細胞生物學技術檢測各表型所對應的特異性分子的表達情況。結果顯示,在X-PDT治療組中,增殖表型所對應的PCNA分子的表達量最低,而細胞遷移表型所對應的E-cad分子的表達量最高。說明X-PDT治療相比與其他各組對腫瘤的增殖和轉移都具有抑制作用。銅半胱胺Cu-Cy作為一種新型光敏劑,通過與臨床直線加速器相結合,將成為一種很有前景的腫瘤治療手段。它具有提高放療效率和抑制腫瘤增值、轉移的雙重效果。這項研究加深了我們對該治療機制的理解。而且通過模擬臨床環境,證明了Cu-Cy具有臨床轉化潛力,為納米材料的臨床應用提供了新的策略(圖5)。
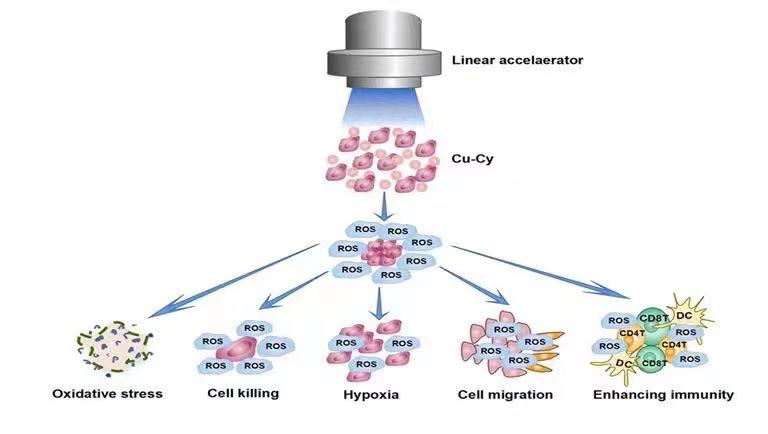
圖5. 醫用X光激發銅半胱胺治療和可能的功能示意圖。
此外,陳偉團隊與天津醫科大學張榮信教授的團隊合作研究發現這類新光敏劑在X光激發下還可以激活動物體內的免疫能力,為放療、光動力和免疫治療的結合打下了基礎。(圖6)

圖6. 基于銅半胱胺的放療、光動力和免疫增強的聯合治療。
對于傳統光動力治療,安全性是一個潛在的問題,因為大部分光敏劑在太陽光的照射下會產生很大的的毒性,這就要求治療后病人要在暗室避光一段時間,而對于陳偉教授團隊研發的銅半胱胺新型光敏劑則不存在這個問題,因為這類新型光敏劑在太陽光的照射下不會產生有毒的活性氧,作為實際的應用這也是一個很大的優點。陳偉教授這一發明已經獲得了6個美國專利和國際專利,目前陳偉教授和他的合作團隊正致力于產業化的研究和大動物的實驗,為進入臨床和產業化做準備。
美國德州大學物理系的陳偉教授

陳偉教授,德州大學阿靈頓分校物理系,納米生物物理專業終身正教授。多年來一直從事納米技術的尖端研究,系國際著名納米藥物和癌癥納米技術專家。在癌癥納米靶向治療和深部癌癥光動力治療劑CuS的光熱治療研究方面取得了優異成果,最先提出X光激發光動力的方法,研發出新一代可以用紫外、X光、微波和超聲波激發的新型銅半胱胺光敏劑。目前在Advanced Materials、Advanced Functional Materials、Bioactive Materials、PNAS, Coordination Chemistry Review, Signal Transition and Targeted Therapy (Nature) 等著名學術刊物發表論文300多篇,主持編寫專著1部,論文引用超過11770次,論文H指數達61。
其他合作通信作者
肖恩華影像醫學與核醫學博士,臨床醫學博士后,教授,主任醫師,博士生導師,博士后導師,中南大學湘雅二醫院醫學影像中心副主任
張漫波 湖南師范大學 副教授
張榮信 天津醫科大學 教授
張俊英 北京航天航空大學 教授
Michael P. Antosh 美國羅德島大學 副教授
Mohammad Huda 美國德州大學物理系 副教授
陳翔宇 放射/介入醫學科副主任醫師,碩士生導師,中南大學湘雅二醫院研究生部副主任
參考文獻
Xiangyu Chen, Jiayi Liu, Ya Li, Nil Kanatha Pandey b, Taili Chen, Lingyun Wang, Eric Horacio Amador, Yongjun Chen, Yuefei Liu, Enhua Xiao, Wei Chen, Study of copper-cysteamine based X-ray induced photodynamic therapy and its effects on cancer cell proliferation and migration in a clinical mimic setting,Bioactive Materials, 2021,7:504-514, https://www.sciencedirect.com/science/article/pii/S2452199X2100236X?via%3Dihub
Y. Wang, N.D. Alkhaldi, N.K. Pandey, L. Chudal, L.Y. Wang, L.W. Lin, M.B. Zhang, Y.X. Yong, E.H. Amador, M. N. Huda, Wei Chen, A new type of cuprous-cysteamine sensitizers: Synthesis, optical properties and potential applications, Materials Today Physics 2021,19:100435,
https://www.sciencedirect.com/science/article/abs/pii/S2542529321000961
Qi Zhang, Xiangdong Guo, Yingnan Cheng, Lalit Chudal, Nil Kanatha Pandey, Jieyou Zhang, Lun Ma, Qing Xi, Guangze Yang, Ying Chen, Xin Ran, Chengzhi Wang, Jingyi Zhao, Yan Li, Li Liu, Zhi Yao, Wei Chen, Yuping Ran, and Rongxin Zhang, Use of copper-cysteamine nanoparticles to simultaneously enable radiotherapy, oxidative therapy and immunotherapy for melanoma treatment, Signal Transduction and Targeted Therapy (Nature), 2020, 5:58.
DOI: 10.1038/s41392-020-0156-4
https://www.nature.com/articles/s41392-020-0156-4
Samana Shrestha, Jing Wu, Bindeshwar Sah, Adam Vanasse , Leon N Cooper , Lun Ma, Gen Li, Huibin Zheng, Wei Chenand Michael P. Antosh, X-ray Induced Photodynamic Therapy with pH-Low Insertion Peptide Targeted Copper-Cysteamine Nanoparticles in Mice, PNAS, 2019,116(34): 16823–16828
https://www.pnas.org/content/116/34/16823.short
Xiumei Zhen, Lalit Chudal, Nil Kanatha Pandey, Jonathan Phan, Xin Ran, Eric Amador, Xuejing Huang, Omar Johnson, Yuping Ran, Wei Chen, Michael R Hamblin and Liyi Huang, A Powerful Combination of Copper-Cysteamine Nanoparticles with Potassium Iodide for Bacterial Destruction, Mater. Sci. Eng. C. 2020, 110:110659 1-8
https://www.sciencedirect.com/science/article/pii/S0928493119347927
Lun Ma , Wei Chen, Gabriele Schatte, Wei Wang, Alan G. Joly, Yining Huang, Ramaswami Sammynaiken, and Marius Hossu, A new Cu-Cysteamine Complex: Structure and Optical Properties, J. Mater. Chem. C. 2014, 2, 4239–4246
https://pubs.rsc.org/en/content/articlehtml/2014/tc/c4tc00114a
Hongyu Guo , Junying Zhang, Lun Ma , Jose L. Chavez , Luqiao Yin , Hong Gao , Zilong Tang , and Wei Chen, A Non-rare-Earth Ions Self-Activated White Emitting Phosphor under Single Excitation, Advanced Functional Materials, 2015, 25: 6833–6838
https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.201502641
Cong Wang, Shuizi Ding, Shaoxiong Wang, Zikuan Shi, Nil Kanatha Pandey, Lalit Chudal, Lingyun Wang, Zijian Zhang, Yu Wen, Hongliang Yao, Liangwu Lin, Wei Chen, Li Xiong, Endogenous tumor microenvironment-responsive multifunctional nanoplatforms for precision cancer theranostics,Coordination Chemistry Reviews, 2021, 426: 213529
www.sciencedirect.com/science/article/pii/S0010854520304288
相關的電視和網絡視頻報道
CBS News WEI CHEN'S DISCOVERY of New Sensitizers
https://www.youtube.com/watch?v=tvkjhq1lrXk&t=29s
Microwave induced PDT
https://www.youtube.com/watch?v=iTS0KZDklmI
PNAS
https://www.youtube.com/watch?v=td-EjXl0T_A











