聶廣軍,中科院特聘研究員,國科大特聘教授;美國Houston Methodist Research Institute(休斯敦)兼職教授;Nano Letters 副主編。
課題組主要結合現代生物學、藥學、化學、生物材料以及納米技術和生物技術手段,研究納米和生物界面相互作用的基本規律,以及新型納米材料在生物醫學領域的應用。研究領域主要包括腫瘤納米生物學、納米生物技術和納米生物效應等。主要從事的研究方向包括:
1)腫瘤微環境調控的智能納米藥物;
2)膜泡系統的納米生物效應和藥物遞送;
3)生物分子指導的功能性納米材料設計、構筑和自組裝;
4)發展基于納米技術和生物技術的代謝疾病和退行性疾病的新型治療策略;
近期,奇物論編輯部對該課題組在ACS Nano上連續發表的3篇研究成果進行簡要總結,供大家學習和交流
1. ACS Nano:大小可切換的納米系統用于滲透促結締組織增生基質以增強胰腺癌治療

胰腺導管腺癌(PDAC)細胞被致密的細胞外基質(ECM)所包圍,這會極大地限制了治療藥物的進入,進而導致其對臨床化療的反應不佳。轉化生長因子-β1(TGF-β1)信號通路在纖維間質的構建中發揮著重要作用,并也為PDAC治療提供了一個潛在靶點。為了克服病理障礙,國家納米科學中心聶廣軍研究員、李一葉研究員和GILO研究所Seong-jin Kim開發了一種脂質體包裹、基于PEG-PLGA納米球的大小可切換型納米平臺,并將其用于對TGF-β1受體激酶抑制劑vactosertib(VAC)和細胞毒性藥物紫杉醇(TAX)進行聯合遞送。(1)實驗利用肽APTEDB對脂質體進行表面修飾,使其可以錨定在PDAC基質中豐富的腫瘤相關纖維連接蛋白上,并可在脂質體坍塌后釋放封裝的含TAX納米微球以及VAC來減小其尺寸。(2)VAC能夠抑制ECM增生以使得TAX能夠更容易地接近癌細胞,從而實現比游離的藥物組合更為有效的胰腺腫瘤抑制效果。綜上所述,這種尺寸可切換的納米系統能夠以固定的劑量組合進行連續藥物遞送,從而提供了一種高效的級聯藥物滲透策略,可用于對具有致密間質增生的癌癥進行增強的化療。Xiaozheng Zhao. et al. Penetration Cascade of Size Switchable Nanosystem in Desmoplastic Stroma for Improved Pancreatic Cancer Therapy. ACS Nano. 2021
DOI: 10.1021/acsnano.0c08860https://pubs.acs.org/doi/10.1021/acsnano.0c08860
2. ACS Nano:仿生納米顆粒用于在光熱治療后重塑炎癥微環境

在光熱治療后,殘余腫瘤病灶的完全消退往往依賴于免疫系統的激活和識別。然而在PTT后,殘余腫瘤會不可避免產生的局部炎癥進而募集大量的異常免疫細胞,特別是腫瘤相關巨噬細胞(TAMs),從而會進一步促進剩余腫瘤細胞的免疫逃逸和存活,導致腫瘤復發和發展。為了解決這一問題,國家納米科學中心趙瀟研究員和聶廣軍研究員制備了負載TAMs重極化試劑的仿生納米顆粒以重塑PTT后的炎癥微環境。(1)聚多巴胺納米顆粒既能夠作為光熱試劑以消融腫瘤細胞,也可以作為TMP195的載體以將M2型TAMs重新極化成抗腫瘤的M1表型。此外,實驗也利用巨噬細胞膜對該納米顆粒進行仿生包覆,使其可在PTT后通過炎癥介導的趨化作用實現對腫瘤部位的主動靶向。(2)實驗結果表明,這些具有免疫調節能力的仿生納米顆粒可在乳腺腫瘤模型中顯著提高了M1型TAMs的水平,進而使得腫瘤消除率從PTT后的10%提高到60%。綜上所述,這一研究表明將PTT與TAMs重極化相結合的協同治療策略可為治療PTT后惡化的腫瘤微環境提供一種有效方法和聯合治療方案。Yale Yue. et al. Biomimetic Nanoparticles Carrying a Repolarization Agent of Tumor-Associated Macrophages for Remodeling of the Inflammatory Microenvironment Following Photothermal Therapy. ACS Nano. 2021DOI: 10.1021/acsnano.1c05618https://pubs.acs.org/doi/10.1021/acsnano.1c05618
3. ACS Nano:可分離的微針貼片用于保護和遞送抗COVID-19 DNA納米疫苗
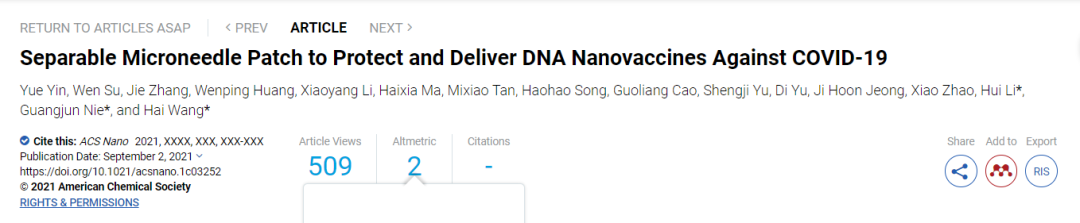
對COVID-19大流行進行成功控制不僅取決于疫苗的研制進展,還需要對疫苗的儲存、運輸和管理進行優化。理想情況下,核酸疫苗應直接接種到免疫細胞或組織(如淋巴結)中。然而,目前開發的疫苗通常是通過肌肉注射進行治療,而免疫細胞通常并不會駐留在那里。與此同時,目前的核酸疫苗必須冷凍保存,這也影響了其在發展中國家的應用。國家納米科學中心王海研究員、聶廣軍研究員和北京中醫藥大學李慧教授構建了一種可分離的微針(SMN)貼片以遞送聚合物封裝的spike(或核衣殼)蛋白編碼的DNA疫苗和免疫佐劑,進而實現高效免疫。(1)與肌肉注射相比,該SMN貼劑可將納米疫苗注入皮內,進而誘導產生有效且持久的適應性免疫,使得IFN-γ+CD4/8+、IL-2+CD4/8+ T細胞和病毒特異性IgG顯著升高。(2)體內實驗結果表明,該SMN貼片可在室溫下保存至少30天而不降低免疫反應。綜上所述,該納米疫苗SMN貼片對于開發先進的COVID-19疫苗和實現其全球應用而言具有重要的意義。Yue Yin. et al. Separable Microneedle Patch to Protect and Deliver DNA Nanovaccines Against COVID-19. ACS Nano. 2021DOI: 10.1021/acsnano.1c03252https://pubs.acs.org/doi/10.1021/acsnano.1c03252

聶廣軍,中科院特聘研究員,國科大特聘教授;國務院享受政府特殊津貼專家;基金委創新群體、中科院創新交叉團隊、中科院盧嘉錫國際團隊成員;2016年獲中國藥學會以嶺藥業青年科學家獎,美國Houston MethodistResearch Institute(休斯敦)兼職教授,英國醫學科學院Advanced NewtonScholar;中國生物物理學會常務理事,中國抗癌協會納米腫瘤學專業委員會委員,中國藥學會納米藥物專業委員會委員;國家納米科學中心科技處處長;Nano Letters 副主編。
2002年于中國科學院生物物理所獲得博士學位,之后在加拿大McGill大學從事博士后研究。2008年回國在國家納米科學中心建立了“納米生物學和納米生物材料”實驗室,組建了一個多學科交叉研究團隊。課題組現有研究員3名,副研究員3名,助理研究員2名,博新計劃博士后2名。課題組已先后獲得幾十項各類科研資助,主持了多項科技部、基金委、中科院、北京市科委、國際合作項目以及橫向合作項目等。與美國、英國、澳大利亞及加拿大等納米醫學和生命科學的多個著名實驗室建立了良好的合作關系,先后與6位中科院特聘訪問教授開展科研合作。課題組先后培養19名博士、8名博士后、17名碩士。先后獲得中國科學院優秀導師獎、中國科學院SABIC-CAS獎學金導師獎、中國科學院澳大利亞必和必拓(BHP Billiton)導師科研獎等教學獎。獲得天津市科技進步獎公益類一等獎、中國抗癌協會科技獎一等獎等獎項。
在Nature Biotechnology, Nature Biomedical Engineering, Nature Communications, Blood, JACS, JBC, Angew Chem Int Ed, Adv Mater, Nano Letters,ACS Nano, Adv Funct Mater, Biomaterials, Haematologica, Brit J Haematol,Antioxid Redox Sign, Cancer Letters, Small和Nanomedicine等發表論文140余篇;申請抗腫瘤應用等相關發明專利40余項(授權中國專利20余項,美國授權專利3項,日本專利1項,專利轉讓2項)。相關研究成果被Nature Biotechnology, NatureMaterials, Nature Biomedical Engineering, Nature Reviews of Cancer, Science Translational Medicine和Blood等進行了重點推薦和報道。