
第一作者:Jinming Yue
通訊作者:索鎏敏,許康
通訊單位:中科院物理研究所,美國陸軍研究實驗室
研究背景
在鋰離子電池出現之前,水是大多數電化學器件的通用電解質溶劑,包括電池、超級電容器、二氧化碳(CO2)電化學還原器件和電鍍器件,提供優異的動力學性能,如快速充電和高倍率性能以及低成本。事實上,所有這些水溶液器件通常在低電壓下工作,受限于水的窄電化學穩定窗口和嚴重的析氫副反應,同時沒有像非水電解質那樣,具有固體電解質界面(SEI)的動力學保護。最近,一種鹽包水(WIS)電解液的突破打破了這種窄電化學穩定窗口的限制,其在H2O中使用了超濃鋰鹽(21 M雙三氟甲烷磺酰亞胺鋰,LiTFSI),由于在水介質中形成了界面相,從而獲得了3.0 V的窗口。在早期的鋰離子電池試驗中,超濃LiNO3電解質的發展已有幾十年的歷史,但這些電解質從未形成過界面。顯然,除了高濃度外,陰離子化學也是誘導水界面形成的關鍵因素。以前的研究揭示了WIS電解質形成的界面化學,如LiF、Li2O和Li2CO3的混合物。雖然LiF必須由氟化的陰離子貢獻,但目前人們無法合理地解釋為什么不能在基于無機陰離子(LiNO3和Li2SO4)的其他超濃縮電解質中形成界面相,即使已經存在O2和CO2作為Li2O和Li2CO3的來源。
成果簡介
近日,中科院物理研究所索鎏敏研究員,美國陸軍研究實驗室許康研究員報道了觀察到水中CO2和TFSI陰離子之間存在濃度依賴性的締合,在5mol kg?1 的LiTFSI時達到最大強度。這種TFSI-CO2絡合物及其還原化學特性能夠將水溶液電解質的界面響應性與其塊體性質分離,從而使高電壓水溶液鋰離子電池在稀水鹽電解質中具有實用價值。所開發的CO2/水包鹽電解質(SIW)不僅繼承了WIS電解質的寬電化學穩定窗口和不可燃性,而且成功地克服了鹽過多帶來的諸多缺點。
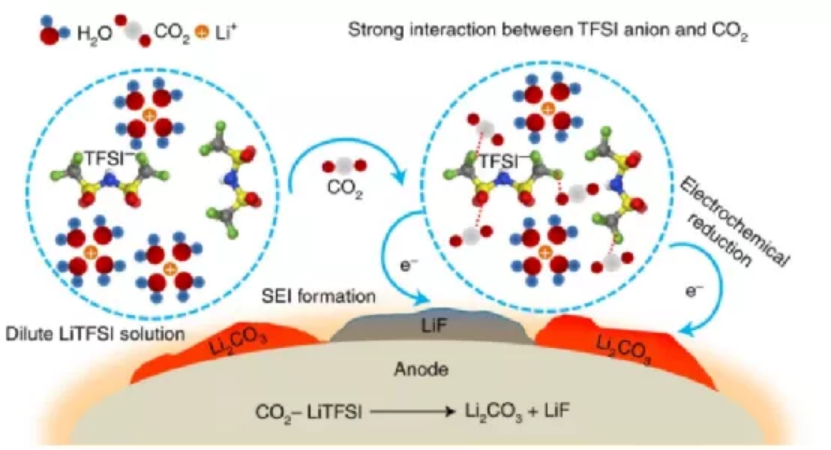
要點1:CO2對界面化學的影響
WIS電解質中的界面形成源于TFSI陰離子和溶解氣體的同時還原。然而,在電池中,由于與整個法拉第過程相比,界面形成相對應的質量相對較小,因此無法精確區分和量化陰離子和溶解氣體的特征還原電位。為了解決這一挑戰,研究人員設計了一種三電極裝置,提供連續的氣流,以便放大這些氣體的影響。所有實驗均在氬氣手套箱中進行,并用目標氣體對電池進行預凈化,以消除電解液中的其他殘留氣體。此外,以Mo6S8為工作電極,Ag/AgCl為參比電極的三電極裝置可以精確監測所有電化學反應的電位,對應于活性電極材料的氧化還原電位、氣體還原電位和電解液組分的分解電位(圖1a)。從充放電曲線(圖1b)的電位-容量關系中,可以獲得不可逆的法拉第反應,包括界面形成和電解質分解,同時,在不同的WIS電解質中,對初始放電過程中這些過程對容量的貢獻進行了定量分析(圖1c)。當WIS電解液被空氣飽和時,容量進一步增加到195.4 mAh g-1,而當WIS電解質被Ar飽和時,容量下降到147 mAh g-1。其中,基于飽和CO2和O2 WIS電解質的容量分別為406.7 mAh g-1和370.8 mAh g-1。因此,在負極材料的初始鋰化過程中,CO2和O2都對不可逆容量起主導作用。對于飽和CO2 的WIS電解質(165 mAh g-1),容量增加最顯著的是在階段III(圖1b),對于飽和空氣和O2的WIS電解質,容量增加發生在階段IV(圖1b)。
因此,CO2是對還原反應最敏感的氣體(2.6~2.2 V)。此外,O2在2.7-2.3 V范圍內也有很強的還原反應趨勢(圖2a)。這些電化學過程與各自的熱力學電位基本一致(CO2 → Li2CO3,2.58 V;O2 → Li2O2,2.68 V,圖2a)。同樣,在CO2、空氣和O2飽和的WIS電解液中,Mo6S8的第二平臺明顯擴展,這些都有助于TFSI陰離子的還原。
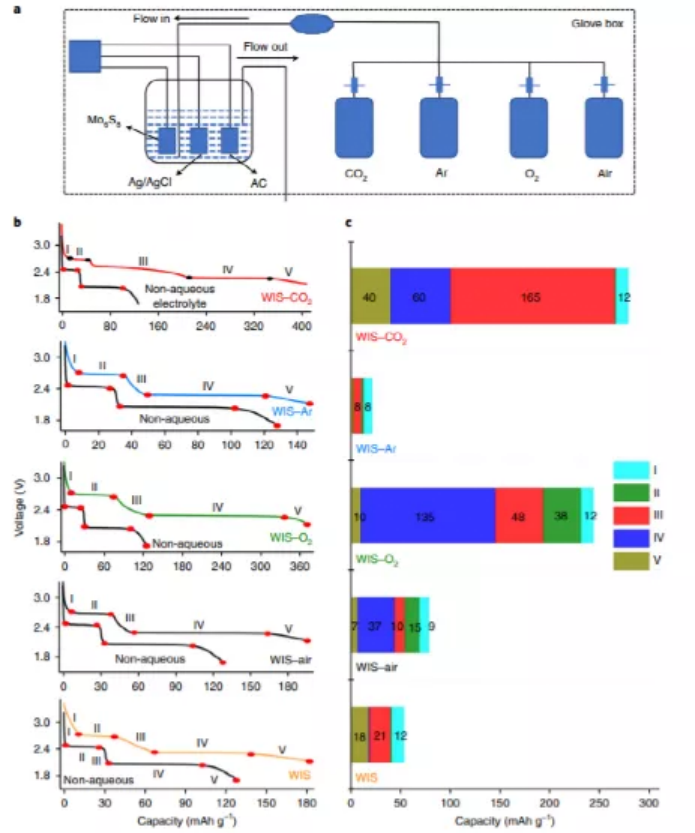
圖1. 不同WIS電解液對首次放電容量貢獻的定量分析。
研究人員比較了在各種氣體(CO2、Ar、O2和空氣)存在下,Mo6S8半電池的四種放電曲線(圖2a)。WIS-CO2電解質的放電曲線表明,CO2還原在2.58 V以下有一個明顯的斜率。在WIS-O2電解液中,也觀察到了類似的還原,但電位略高,為2.68 V。同時,由于TFSI陰離子還原開始時的電位低于2.9 V,先于CO2和O2過程。所有這些物種,溶解氣體(CO2或O2)和TFSI陰離子的同時還原都有助于界面化學。X射線光電子能譜(XPS)分析表明,電極表面的主要化學成分為Li2CO3和LiF。而在WIS-O2體系中,除了LiF外,還檢測到Li2O2(圖2d)。Li2O2可以穩定地存在于WIS電解質中,而不與溶劑(水)、鹽(TFSI)或其他因其還原而產生的成分發生反應。因此,溶解O2的還原產物是Li2O2,而不是更徹底的Li2O。在WIS-空氣體系中,O2和CO2共存,在XPS中同時檢測到上述產物,按豐度順序排列,分別是LiF、Li2O2和Li2CO3。最令人印象深刻的是WIS-空氣體系中,在經過長時間的Ar預凈化和測試過程中持續的Ar流之后,它顯示Li2CO3仍然存在(圖2c)。在WIS-CO2體系中發生了同樣的現象。這一結果有力地表明,簡單的氣體吹掃可以消除WIS電解液中溶解的O2,但不能消除CO2。因此,CO2和TFSI之間可能存在一種未知的獨特相互作用,這種作用在任何情況下都是導致富Li2CO3界面形成的原因。
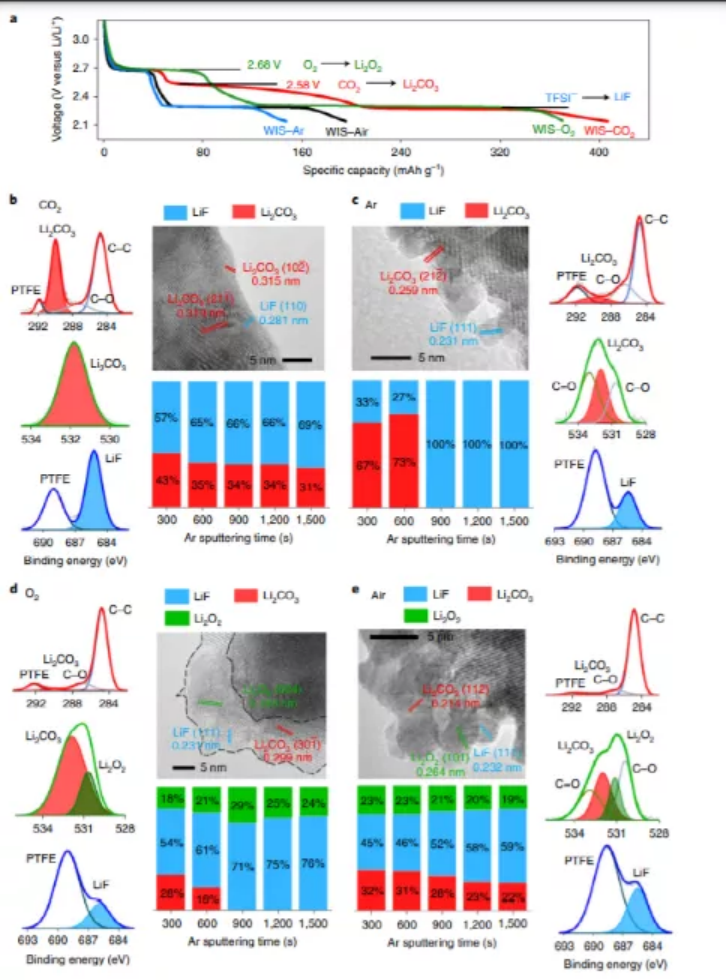
圖2. 三電極裝置中飽和各種氣體的WIS電解液(21 m LiTFSI)中Mo6S8電極上的SEI。
要點2:CO2/水包鹽(SIW)電解質的物理化學性質
基于上述結果,研究人員認為使用CO2作為添加劑,這樣就不必依賴極高的鹽濃度來形成界面。避免過高濃度的好處從5 m LiTFSI SIW電解質中可見一斑,其高最大電導率(49.46 mS cm?1)、極低粘度(4.84 mPa.s,圖3a)和極低的液相線溫度(Tl,?31 °C)接近體系的共晶點,實現了WIS電解質無法提供的出色性能。這種水溶液電解質繼承了WIS電解質的固有安全性,同時提供了稀釋液典型的出色的動力學相關性能,同時顯著降低了成本至~56%(圖3c)。圖3d顯示了不同氣體處理后5 m SIW電解液的pH值和CO2含量。在1.03 mm l-1的CO2飽和時,最低pH值為5.98,與其他各種氣體體系的pH值有顯著差異,這意味著更多的CO2可以溶解在電解質中,其最終析氫反應電位略高于5 m SIW電解質中的0.03 V;同時,關鍵性質(離子電導率和粘度)不受CO2溶解的影響。

圖3. 5 M LiTFSI溶液的物理化學性質。
要點3:CO2與TFSI陰離子的相互作用
研究人員利用核磁共振(NMR)和傅里葉變換紅外光譜(FTIR)研究了CO2-水和CO2-TFSI陰離子在5 m SIW電解液中的相互作用。13C NMR譜中證實了CO2的存在(圖4a),此外,1H和17O NMR在CO2存在下都有輕微的紅移(圖4a),這表明CO2的相互作用增加了周圍環境中的電子密度,降低了屏蔽。此外,LiTFSI溶液經CO2處理后的紅外光譜出現了明顯的畸變,可用兩個峰來擬合,分別對應于HCO3?(1055 cm?1)和CO2(1,043 cm?1,圖4b)。擬合結果表明,隨著濃度的增加,CO2與HCO3的峰面積比先增大后減小,在5 m(52.8%)時產生最大比值。此外,具有明顯化學位移的19F NMR光譜的不對稱峰表明CO2強烈影響F周圍的電荷密度(圖4c)。此外,與其他電解質(10m,Δδ=?0.02ppm;15m,Δδ=?0.01ppm;圖4d)相比,5 m SIW電解質呈現出最大的紅移(Δδ=?0.15ppm),表明CO2與TFSI之間的相互作用在5 m處達到最大值。
分子動力學模擬結果顯示,當濃度從21 m降低到5 m時,負電荷密度差從?1.18減小到?1.91,正電荷密度差從2.23減小到1.84,在5 m處用CO2處理后,F附近的電子密度變化最大(圖4e),與NMR結果相一致。上述結果表明,引入的CO2既與水相互作用,又與TFSI陰離子相互作用,其含量和存在高度依賴于鹽水比,引起F附近電子密度的變化。有趣的是,5 m SIW中的CO2與TFSI陰離子顯示出最強的相互作用,導致其中的CO2處于穩定而豐富的狀態,不容易被清除。富含CO2-SIW的電解液有利于SEI的形成,在較低濃度(5m)下具有優異的物理化學性質,有利于提高電池的動力學性能。

圖4. TFSI陰離子與CO2的相互作用。
要點4:CO2-SIW電解液電化學性能研究
電化學測試結果顯示,CO2-SIW電解質的初始庫侖效率(CE)為62.21%,其充放電曲線在1.86 V附近顯示出明顯的CO2還原(圖5a)。與之形成鮮明對比的是,純SIW和飽和SIW在不可逆充電過程中都有明顯的電解質分解,CE值分別為27.99%(SIW)、30.88%(Ar-SIW)、10.78%(O2-SIW)和57.69%(air-SIW)。圖5b,c顯示了所有SIW電解質在0.5 C下的循環性能,CO2-SIW電解質在100次循環(初始容量為95.94mAh g-1;100次循環,86.12mAh g-1)后保持了良好的循環穩定性,容量保持了90%,與原始SIW或飽和了其他氣體的SIW明顯不同,除了含空氣的SIW外,所有SIW都沒有超過20次的循環,這可能是由于空氣中的CO2所致。此外,CO2-SIW電解質在更高的倍率(2 C)下實現了長達2000次的循環壽命,容量保留率為70%(圖5d),這些結果表明,正極和負極在CO2-SIW電解質中都具有優異的化學和電化學穩定性。此外,XPS最終提供了SEI存在的直接證據。如圖5F所示,經過10次循環后,與初始電極相比,基于C 1s和O 1s光譜都有明顯的Li2CO3峰。作為對比,研究人員還測試了飽和CO2的5m LiNO3電解質,結果顯示,其嚴重的過充電問題,表明CO2無法形成任何界面。因此,CO2和SIW之間獨特的相互作用可能是形成界面的關鍵。
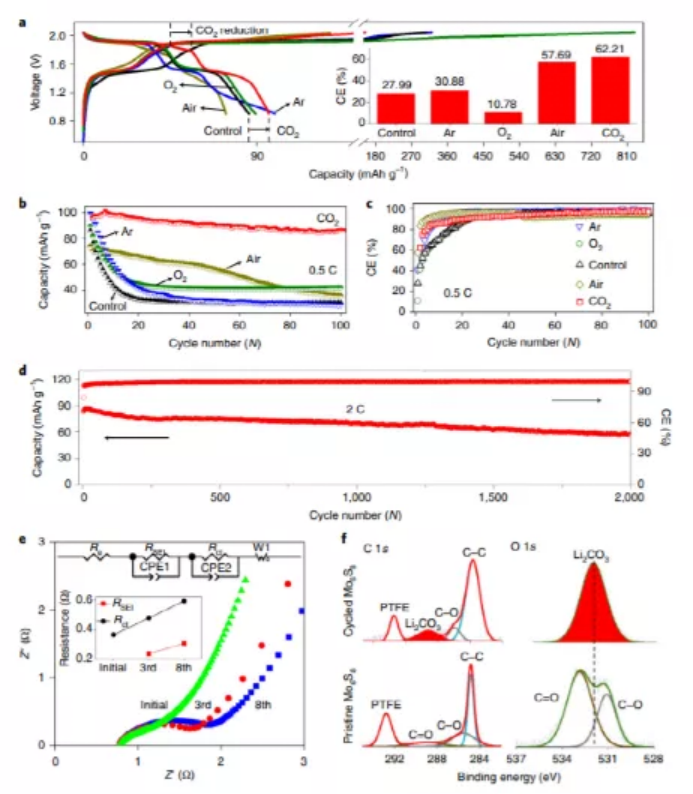
圖5. 水系全電池(LiMn2O4/Co2-SIW/Mo6S8)的電化學性能。
與WIS相比,CO2-SIW不僅表現出更出色的倍率性能,在15 C時的保持容量高達70%,而且還可以從大于300 μm的超厚Mo6S8電極上獲得總容量,具有40 mg cm-2的高負載量(圖6a),幾乎是商用鋰離子電池所用電極(100-200 μm)的兩倍。能夠應用厚電極是在電池水平上實現高能量密度的關鍵因素,但在現實生活中,這種能力往往受到電解質和中間相施加的動力學的限制。然而,在這項工作中,由于稀電解質的好處,基于厚電極的電池表現出優異的循環穩定性,提供了90 mAh g-1的初始容量以及50次循環后88%的保持率,而在WIS電解質中僅實現了25mAh g-1的低容量(圖6b)。此外,CO2-SIW可以在-40 °C的極低溫度下保持良好的流動性,這在WIS電解液(圖6c)中是無法實現的,使用CO2-SIW電解質制造的電池表現出出色的低溫耐受性,在?40 °C的溫度下,0.5C時的容量保持在70mAh g-1以上(圖6d)。
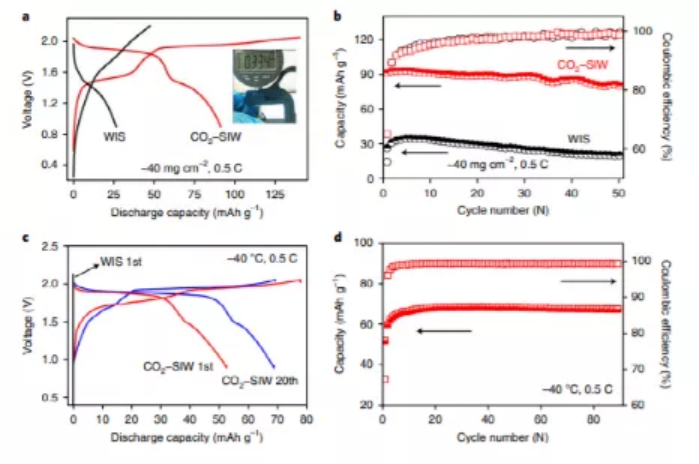
圖6. 動力學決定的LiMn2O4/Mo6S8水系全電池在CO2-SIW和WIS電解液中的電化學性能。
研究人員建立了一個綜合的CO2-SIW電解質電化學還原機理:i)SIW電解質對CO2具有有很強的親和力,它既與水結合,又與TFSI陰離子結合,并在其中富集;ii)在放電過程中,CO2的優先溶解傾向于在正極表面還原為Li2CO3。與Li-CO2電池的電化學相比,CO2的還原電位(2.58 V)略低于觀察到的2.8 V,這可能是由于CO2-TFSI陰離子相互作用所致,這需要額外的能量才能打破。由于Li2CO3有效地抑制了負極上的析氫反應,同時也有助于TFSI陰離子的還原。CO2和TFSI陰離子還原的結合使得即使在低鹽濃度下也能形成強有力的界面。
小結
1)研究人員利用自制的三電極連續供氣裝置,研究了Wis電解液中各種氣體的還原機理。
2)全面的界面表征揭示了CO2和TFSI之間獨特的相互作用,進而影響了電化學行為,導致界面相中富含Li2CO3。利用這一發現,設計了一種CO2-SIW電解質(CO2在5 m LiTFSI-H2O),其中CO2作為界面形成添加劑。這種稀電解質繼承了WIS電解質廣泛的電化學穩定窗口和安全性,同時成功地克服了其動力學慢、液相線溫度高和成本高的缺點。
3)使用CO2-SIW制成的水系鋰離子電池不僅具有與WIS電解液相似的性能,而且還具有優異的倍率性能、出色的低溫性能(?40 °C)以及基于高質量負載厚度電極可獲得的大容量。
4)除了電池性能上的這些好處外,較低的濃度還將成本降低了一半。
這種CO2-TFSI相互作用的發現不僅有利于實際的水系鋰離子電池,修正了不可持續的超高濃度方法,而且在更廣泛的背景下,可引導人們揭示曾經被忽視的電解質成分之間的復雜相互作用,并利用它們進行界面化學操作。
參考文獻
Yue, J., Zhang, J., Tong, Y. et al. Aqueous interphase formed by CO2 brings electrolytes back to salt-in-water regime. Nat. Chem. (2021).
DOI:10.1038/s41557-021-00787-y
https://doi.org/10.1038/s41557-021-00787-y











