白血病一直是人類健康的嚴重威脅,成人和兒童的存活率都很低。迄今為止,化療仍是臨床上的主要治療方式,針對不同的白血病類型,已經(jīng)建立了許多基于化療藥物及其組合的方案。
在這些化療藥物中,三氧化二砷(ATO) 是治療急性早幼粒細胞白血病 (APL) 的一線抗腫瘤藥物。作為藥用形式,三價砷(AsIII)主要通過誘導細胞凋亡發(fā)揮抗白血病作用。然而,臨床制劑中的 ATO 是一種離子劑(ATO 注射液),在體內(nèi)可快速清除。這種非靶向分布總會降低治療指數(shù)并引起毒副作用。更嚴重的是,這種離子 AsIII 在其他類型的白血病細胞中的吸收效率甚至可能更低。這種困境強調(diào)迫切需要開發(fā)新策略以有效地將 AsIII 輸送到不同的白血病類型。
鑒于此,過程工程研究所馬光輝、魏煒,北京大學馬丁和南方醫(yī)科大學李玉華等人開發(fā)了一種基于鐵蛋白(Fn)的納米藥物,用于靶向遞送砷(As)并有效治療多種白血病類型。成果發(fā)表在Nature Nanotechnology上。

通過對大量臨床樣本的篩選,研究人員證實,不同形式的白血病患者均具有穩(wěn)定且強表達的CD71。這一發(fā)現(xiàn)也支持了 CD71 可用作開發(fā)治療白血病的新型精準療法的新靶點的可能性。此外,作為CD71配體,鐵蛋白具有獨特的四級結(jié)構(gòu)和內(nèi)腔,有利于藥物的裝載。在三價鐵介導的配位過程的幫助下,化學治療藥物ATO的藥用形式三價 As (AsIII) 被有效地裝載到Fn中,其中,每個 Fn 中的負載含量約為 200 As。由此產(chǎn)生的As@Fn以高親和力與幾種類型的白血病細胞特異性結(jié)合,從而顯著提高了 AsIII 的攝取并大大增強了細胞毒性。且內(nèi)化后,AsIII將在酸性溶酶體中釋放。
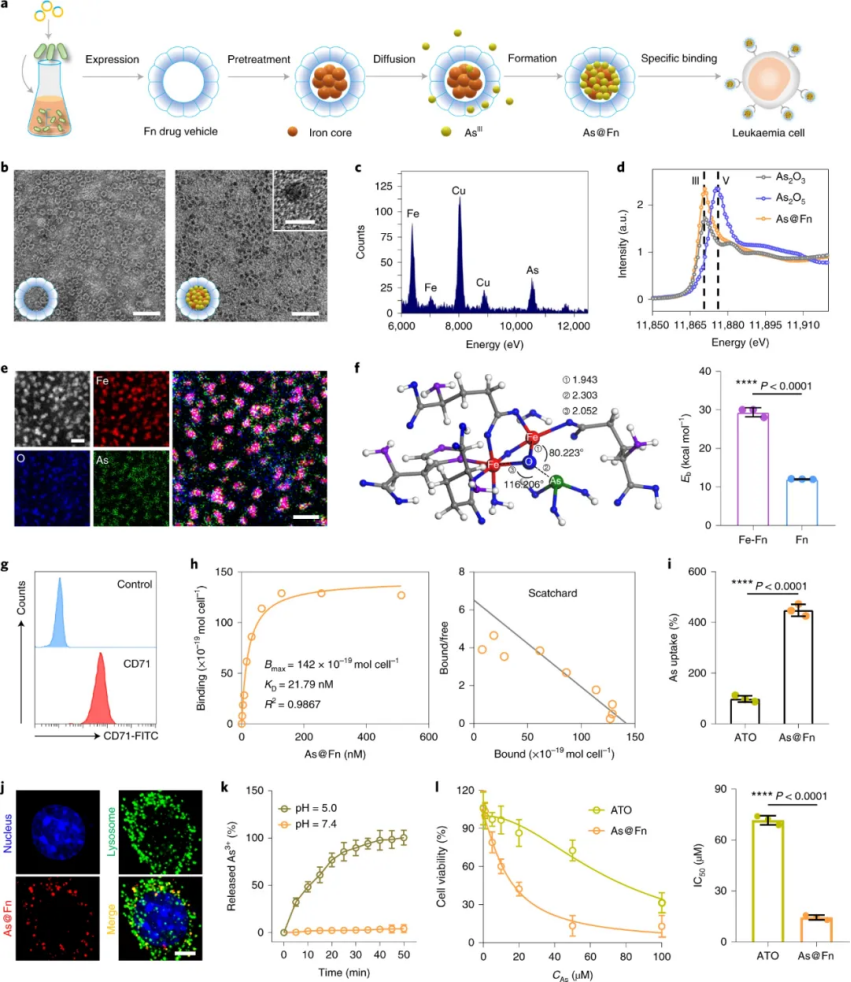
圖|As@Fn納米藥物的制備及體外特異性受體介導的攝取、有效釋放和細胞毒性
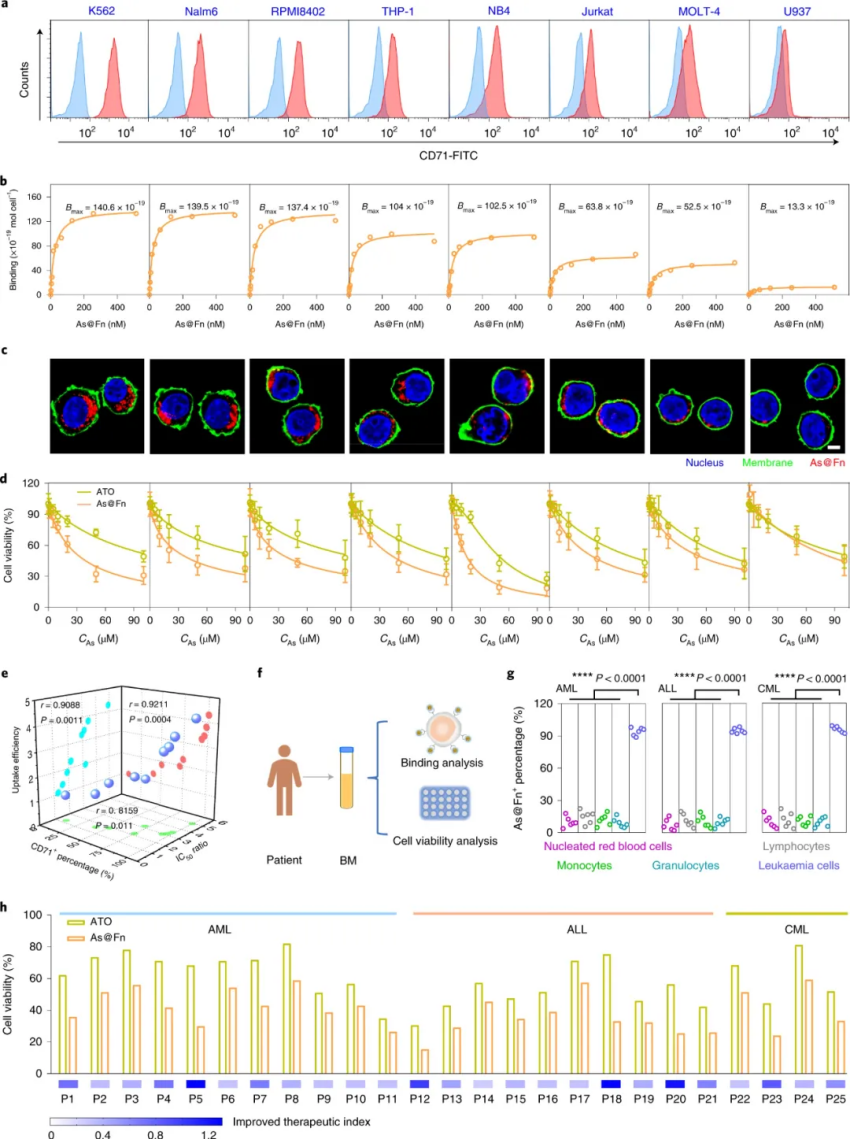
圖|應用于不同白血病細胞系和臨床樣本的As@Fn的特異性結(jié)合和細胞毒性評估
在細胞系來源的異種移植(CDX)模型和患者來源的異種移植(PDX)模型上,研究人員系統(tǒng)地驗證了這種特洛伊木馬策略可以表現(xiàn)出比 ATO 和其他化療聯(lián)合治療更優(yōu)越的抗白血病功效,同時幾乎沒有觀察到異常。研究人員追蹤了 PDX 模型小鼠的存活情況,發(fā)現(xiàn)其他三組小鼠均在約 5 周內(nèi)死亡,而 75% 的 As@Fn 處理小鼠在 6周后仍然存活。
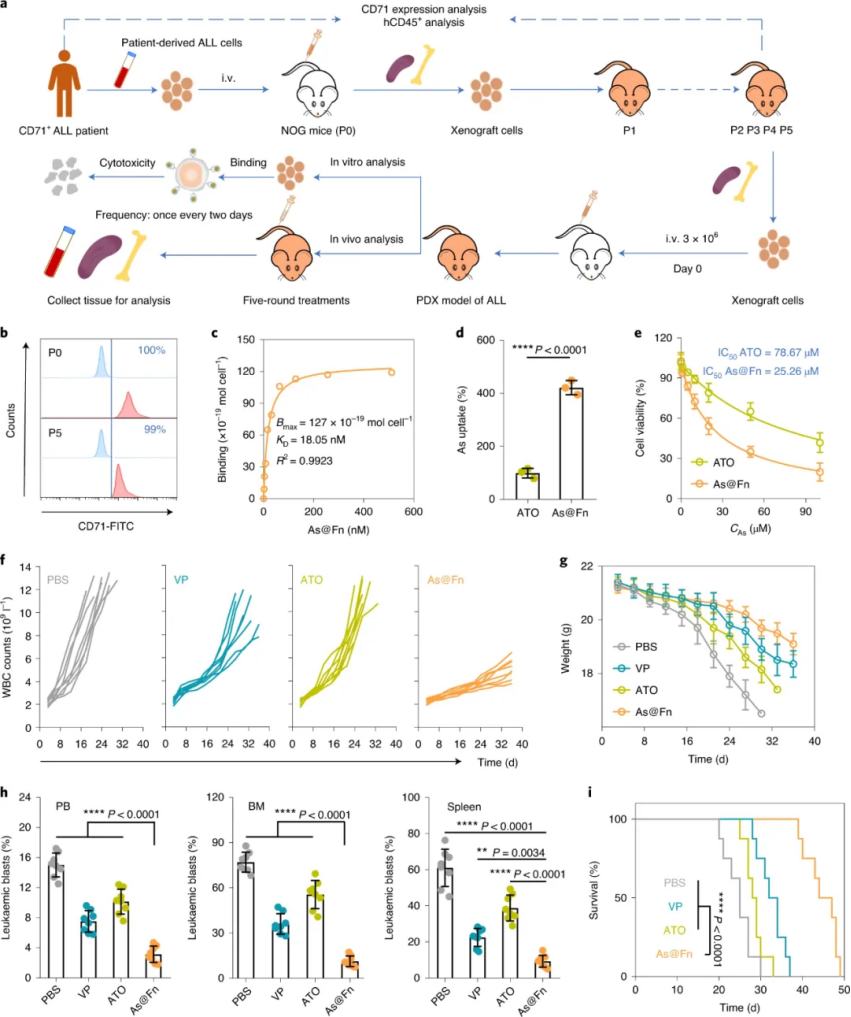
圖|ALL-PDX 模型中的強效抗白血病活性
綜上所述,研究人員發(fā)現(xiàn)CD71 在不同亞型和疾病進展階段的白血病患者中始終高表達,并利用配體蛋白合理設(shè)計了一種仿生載體,用于精準遞送As III。As@Fn 納米藥物對結(jié)合具有高 CD71 表達的 HL-60 AML 白血病細胞表現(xiàn)出高親和力,發(fā)揮比 ATO 更強的細胞毒性作用。
除 AsIII外,F(xiàn)n 腔內(nèi)可裝載僅對一種特定類型的白血病有效的其他抗癌藥物。此外,可以想象在 Fn 腔中裝載可以協(xié)同作用并通過不同機制發(fā)揮抗白血病作用的多藥。非白血病血液系統(tǒng)惡性腫瘤(如多發(fā)性骨髓瘤和淋巴瘤)的細胞也可能強烈表達 CD71。這可能會提供了一個進一步擴大As@Fn納米藥物的治療范圍,以治療其他惡性血腫的機會。
參考文獻:
Wang, C., Zhang, W., He,Y. et al. Ferritin-based targeted delivery of arsenic to diverse leukaemiatypes confers strong anti-leukaemia therapeutic effects. Nat. Nanotechnol.(2021).
https://doi.org/10.1038/s41565-021-00980-7











