嵌合抗原受體 (CAR) T 細胞免疫療法已顯示出根除腫瘤的巨大潛力。CARs是一種人工合成受體,被設計到效應 T 細胞的質膜 (PM) 中,并以獨立于主要組織相容性復合物方式與特定的腫瘤抗原結合。抗原識別允許工程化 T 細胞被激活并隨后執行它們的腫瘤殺傷功能。盡管在癌癥治療方面取得了成功,但由于缺乏對 T 細胞活性的劑量、位置和時間的精確控制,CAR T 細胞療法仍然充滿安全挑戰,例如細胞因子釋放綜合征(CRS)和脫靶效應的細胞毒性。因此,迫切需要對治療活動進行精確時空控制的基于智能CAR T 細胞的療法。
鑒于此,美國德州農工大學周育斌、黃韻和麻省大學韓綱等人描述了光開關 CAR (LiCAR) T 細胞的工程設計,該細胞可以在腫瘤抗原和光的雙重存在下精確地啟動抗腫瘤免疫反應。成果發表在Nature Nanotechnology上。

由于抗CD19 CAR T細胞已被美國食品和藥物管理局(FDA)批準用于治療血液腫瘤(Yescarta和Kymriah),因此,研究人員將研究重點放在CD19抗原的靶向性上。
光可開關CAR(LiCAR)是通過細胞內分裂CAR的功能域并將光響應模塊安裝到分開的CAR的每一半中來設計。然后通過將光學二聚體與細胞外抗原結合模塊或源自常規 CAR 的細胞內信號轉導模塊融合,生成了一系列混合構建體。經實驗表明,基于 CRY2 和 LOV2 的 LiCAR為理想組合。因此,LiCAR T 細胞表現出光依賴性激活,表明使用光微調 T 細胞激活程度的可行性。

圖|光控CAR(LiCAR)T細胞的設計
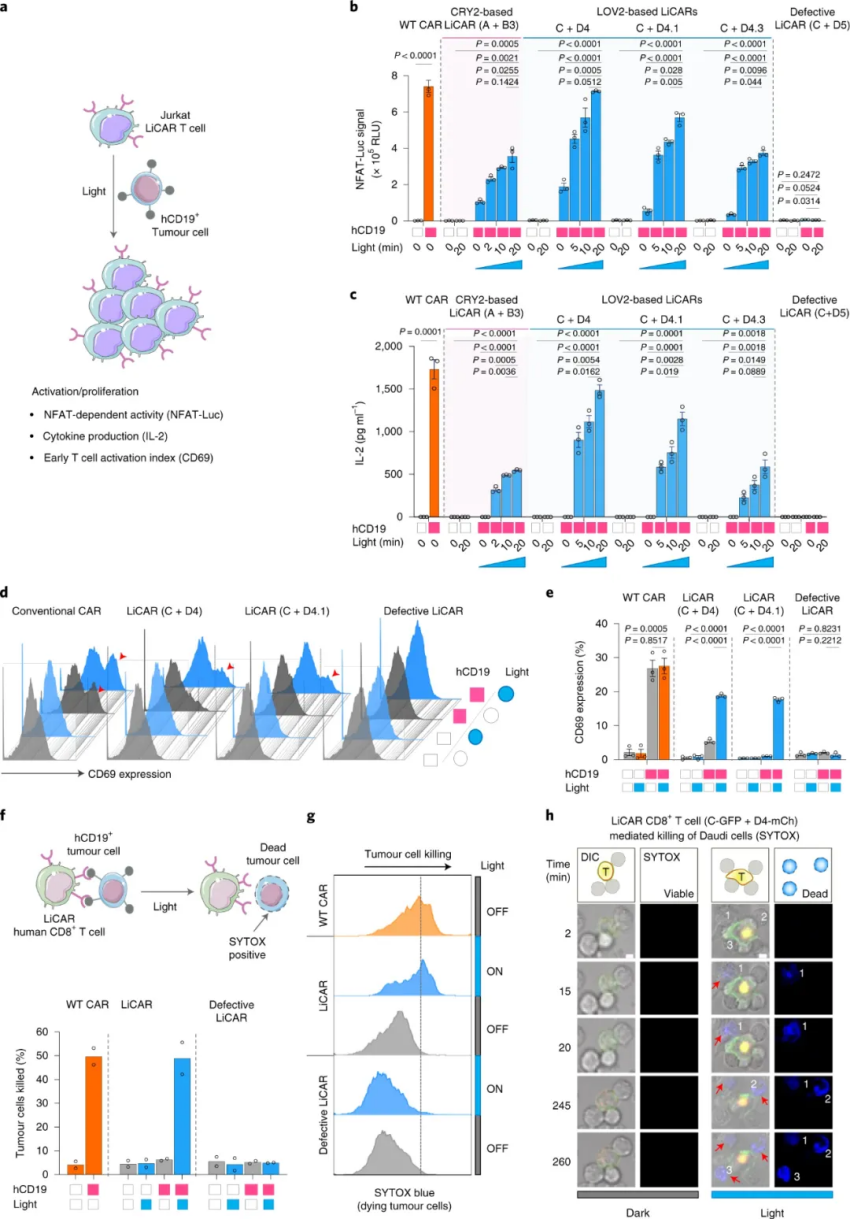
圖|由 LiCAR T 細胞實現的光可調免疫反應
在后期的細胞殺傷實驗中表明,LiCAR T 細胞能夠在腫瘤抗原和光的雙重存在下對同源靶細胞產生抗腫瘤細胞毒性。此外,為了證明體內無線光遺傳免疫治療的可行性,研究人員進一步將 LiCAR T 細胞與可手術移除的上轉換納米板 (UCNP) 相結合,這些納米板具有增強的近紅外 (NIR) 至藍色上轉換發光。UCNPs 作為微型光傳感器,在深組織可穿透近紅外光的刺激下,使活體動物的 LiCART 細胞能夠誘導激活。這種 NIR 光可調納米光遺傳學平臺能夠時空控制 CAR T 細胞介導的針對血液系統惡性腫瘤和實體瘤的細胞毒性,并具有定制的劑量和持續時間,從而大大減輕與當前免疫療法相關的副作用。
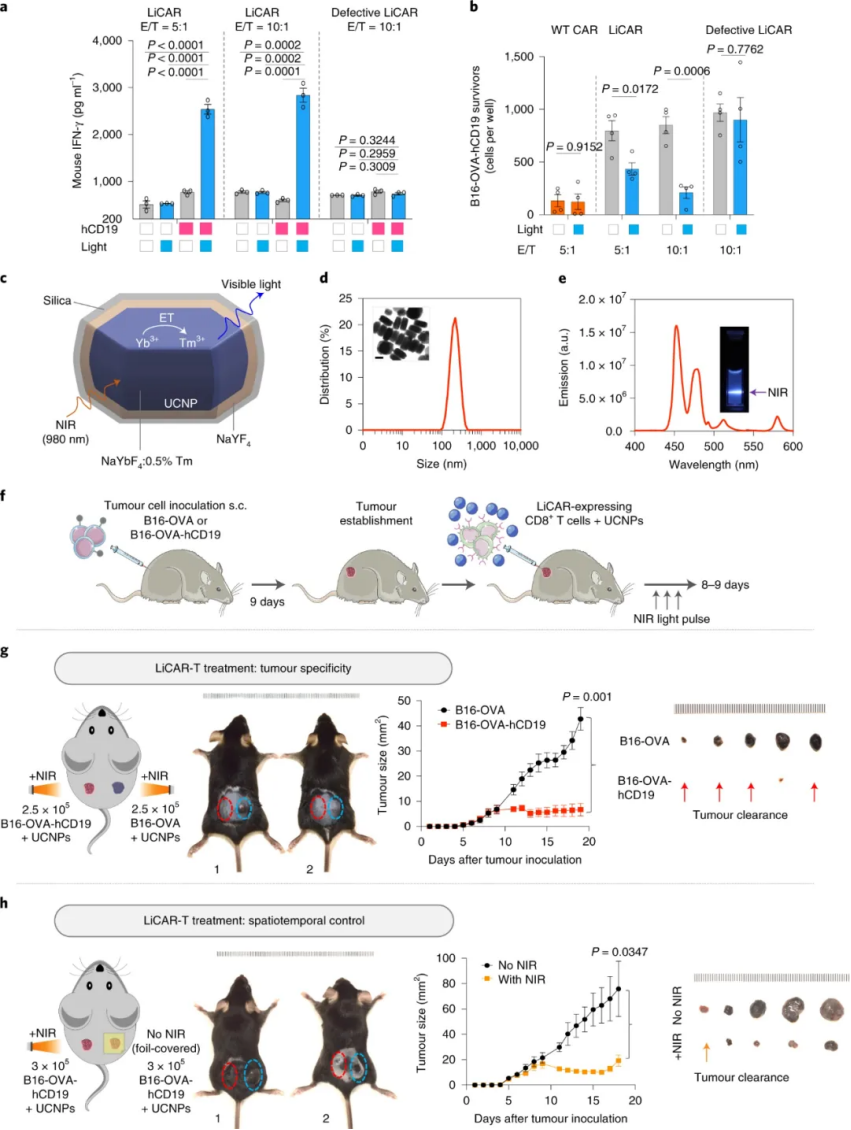
圖|一種使用 LiCAR T 細胞精確破壞黑色素瘤的納米光遺傳學策略
綜上所述,結合上轉換納米材料,LiCAR 允許通過體內深層組織穿透近紅外光,實現時間和位置特異性 CAR T 細胞介導的抗腫瘤活性。這種混合策略允許對 T 細胞介導的免疫反應進行精確的時空調節,并減輕與現有 FDA 批準的 CAR T 細胞療法相關的副作用。預計它最終會導致新一代個性化納米光遺傳學免疫療法的發展,其中 T 細胞介導的治療活動的時間、位置和劑量可以根據患者的需求量身定制。此外,相信該納米光遺傳學平臺將有利于 CAR T 細胞生物學的機械解剖,這可以作為一個獨特的可調體內模型來闡明治療性T細胞的動力學和動力學特征,并確定安全閾值的抗腫瘤免疫性而不引起有害的副作用。
值得注意的是,在2019年,中國科學技術大學薛天教授研究組與麻省大學醫學院韓綱教授等人在Cell發表了利用上轉換納米粒子首次實現動物裸眼紅外光感知和紅外圖像視覺能力。
圖|Cell
在2018年,日本RIKEN腦科學研究所Thomas J. McHugh、Shuo Chen和新加坡國立大學劉小鋼團隊在Science報道了一種基于上轉換納米顆粒的深度腦刺激光遺傳學。研究人員利用鑭系摻雜的上轉換納米顆粒作為光學轉換器,將透過組織的近紅外光轉化為可見光,組織外的近紅外不易被散射,而組織內的可見光則可以有效控制離子通道的開關。
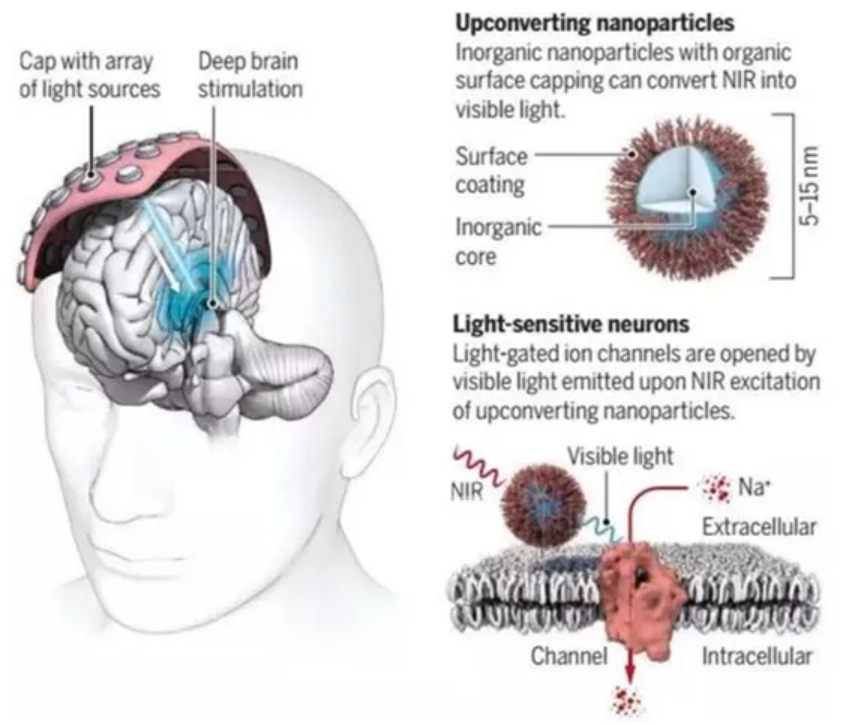
圖|Science
參考文獻:
1. Nguyen,N.T., Huang, K., Zeng, H. et al. Nano-optogenetic engineering of CAR T cellsfor precision immunotherapy with enhanced safety. Nat. Nanotechnol. (2021).
https://doi.org/10.1038/s41565-021-00982-5











