疫苗是對抗現有和新出現的傳染病的關鍵技術。據估計,疫苗每年可在全世界挽救 25 百萬人的生命。然而,提高疫苗反應的效力、質量和持久性仍然是一個挑戰。隨著我們對免疫系統知識的加深,很明顯疫苗成分必須在正確的時間出現在正確的位置,以協調有效和持久的反應。材料平臺,如納米顆粒、水凝膠和微針,可以設計成在空間和時間上控制疫苗成分與免疫細胞的相互作用。基于材料的疫苗接種策略可以通過改善先天免疫細胞的激活、創造局部炎癥灶、靶向淋巴結遞送和控制疫苗遞送的時間范圍來增強免疫反應,目的是誘導增強的記憶免疫以防止未來感染。近日,斯坦福大學EricA. Appel等人在Nature Reviews Materials上強調了強體液和細胞介導的免疫反應背后的生物學機制,并探索了操縱和控制這些機制的材料設計策略。

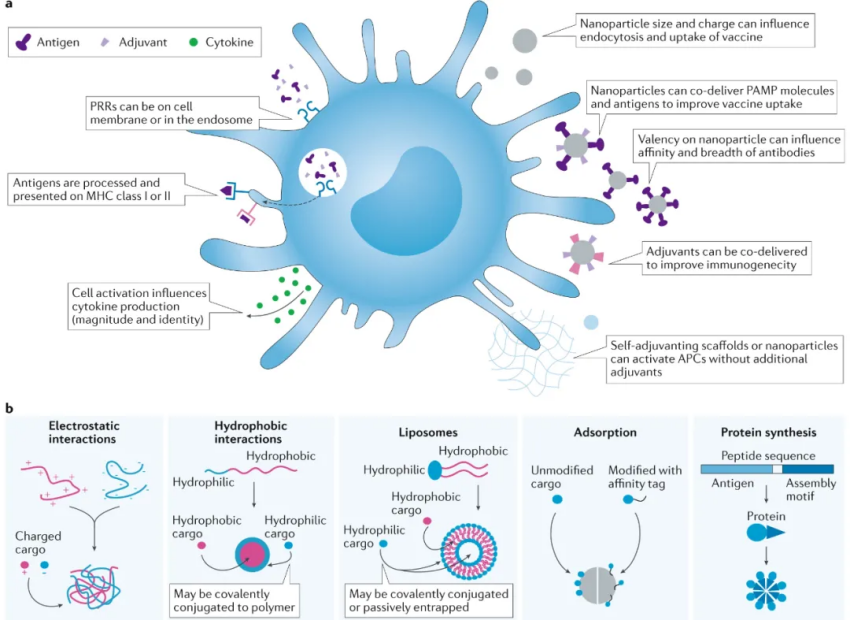
接種疫苗后,細胞和疫苗成分之間的相互作用會導致強烈而持久的反應。在給藥部位,先天免疫細胞,如中性粒細胞和抗原呈遞細胞 (APC),首先遇到抗原和佐劑。疫苗的抗原成分在呈遞到 APC 表面主要組織相容性復合體 (MHC) 分子之前被 APC 內吞和分解。隨著先天免疫細胞被激活,它們會釋放細胞因子,將其他免疫細胞從血液中吸引到給藥部位。可溶性疫苗成分和活化細胞進入淋巴管并到達局部淋巴結。強大的適應性反應的成熟和發展在疫苗接種部位下游的淋巴結(引流淋巴結)中繼續存在。在疫苗反應的早期,淋巴結駐留的吞噬細胞和來自外周組織的遷移性先天細胞呈遞抗原并產生炎癥信號以激活 T 細胞。隨著免疫反應的發展,被稱為生發中心的B細胞發育部位在淋巴結的B細胞區形成。接種疫苗后,局部先天細胞立即將細胞因子釋放到循環中,以實現協調反應。這些信號對于觸發細胞浸潤到注射部位至關重要。接種疫苗后,漿細胞分泌抗原特異性抗體,這些抗體通過循環系統到達組織,在接觸病原體后立即產生反應。記憶 T 細胞還使用循環系統來檢查身體是否有外來入侵者。

圖|疫苗進展時間表和疫苗免疫反應
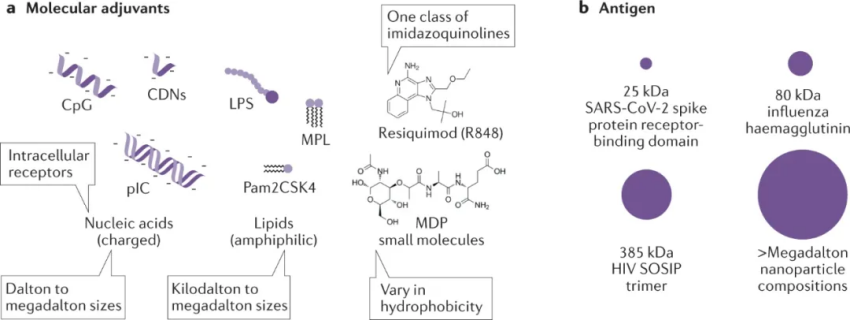
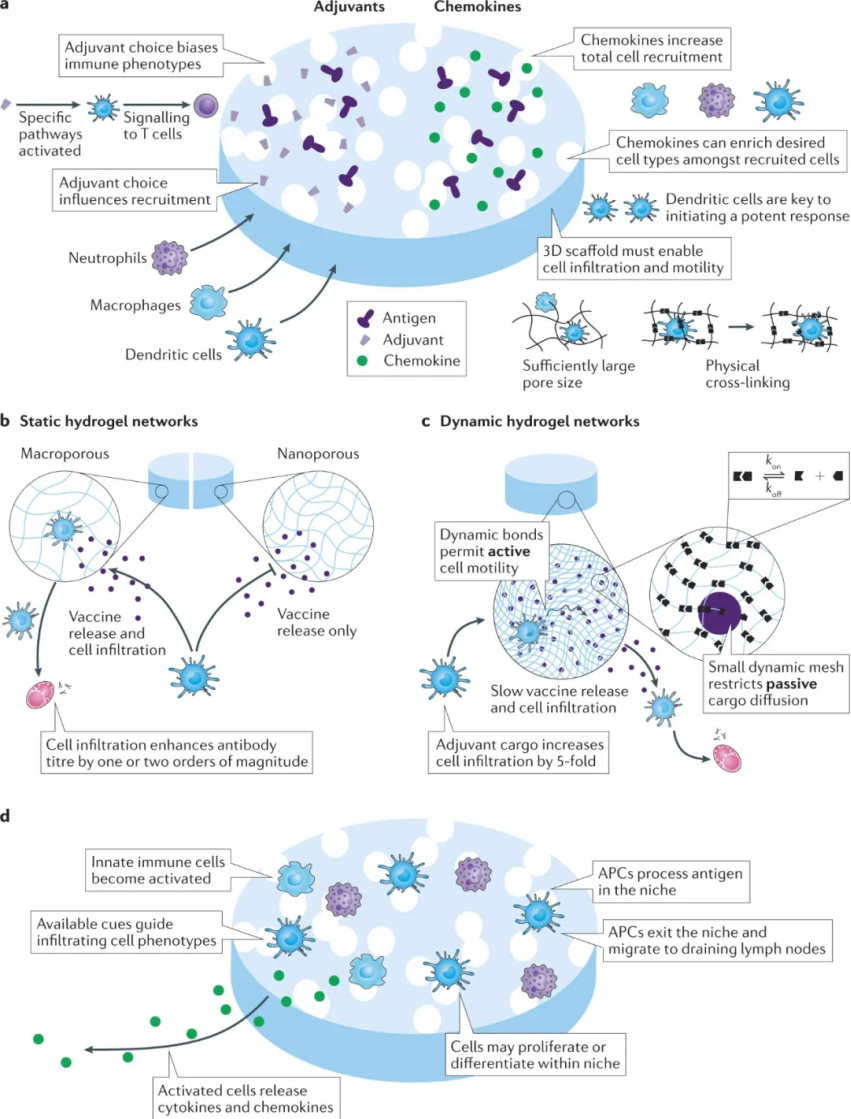
與滅活或減毒疫苗相比,基于蛋白質抗原的亞單位疫苗為更精確的疫苗設計、提高安全性和制造提供了機會。然而,亞單位抗原通常表現出低免疫原性、APC攝取和加工差以及淋巴組織靶向性差。因此,免疫刺激佐劑用于增強抗原免疫原性并提高疫苗效力。這些佐劑募集并激活先天免疫細胞,包括中性粒細胞、自然殺傷細胞、先天淋巴細胞、巨噬細胞、單核細胞和樹突細胞,并在注射部位和淋巴結誘導表型成熟和細胞因子的產生。通常選擇多種佐劑來模擬全病原體疫苗。重要的是,針對多種 PRR 開發的大多數佐劑分子在物理化學上是不同的,在分子量(從數百道爾頓到數百萬道爾頓)、電荷(從不帶電到帶電的核酸)和相對疏水性方面各不相同。類似地,亞單位抗原的分子量有很大差異。因此,亞單位疫苗是物理化學上不同分子的復雜混合物。納米顆粒、抗原偶聯物、自組裝支架、水凝膠或微針可用作控制亞單位疫苗成分向免疫系統遞送的位置和時間尺度的載體,以增強疫苗反應的許多要素。注射部位激活的先天免疫細胞對于啟動疫苗反應至關重要。浸潤的 APC 亞群必須有效地吸收疫苗抗原并將其呈遞給 CD4+ 和 CD8+ T 細胞。顆粒構建體可以設計為通過增加佐劑效力和改善抗原加工來增強先天免疫反應。因此,給藥途徑對于改善注射部位反應很重要,因為不同部位具有不同數量和類型的常駐固有免疫細胞或者可能包含不同的生理屏障。顆粒增加佐劑效力。先天細胞必須在正確的位置和正確的時間被激活,以觸發 APC 的成熟以及促炎細胞因子和趨化因子(如 IFNγ 和 IL-12)的產生,它們共同刺激下游的體液和細胞反應。利用微納米顆粒遞送小分子,可實現很好的免疫刺激作用。此外,顆粒還可以提高抗原識別,攝取并通過它們的尺寸,形狀和表面性質的調控增加的胞吞作用被APC處理生物材料支架可用于在給藥部位募集和編程先天免疫細胞,以誘導有效的適應性免疫。為了增加先天免疫細胞對注射部位的浸潤,生物材料應易于以微創方式注射,并在注射部位創建 3D 支架,為細胞募集提供空間。水凝膠、自組裝支架、微粒和微針可以設計成留在注射部位并促進免疫細胞浸潤以產生局部炎癥微環境。可調式微環境形成材料的開發將有助于對疫苗識別和微環境持續時間框架對免疫反應的幅度、持續時間和質量的影響進行更強有力的調查。
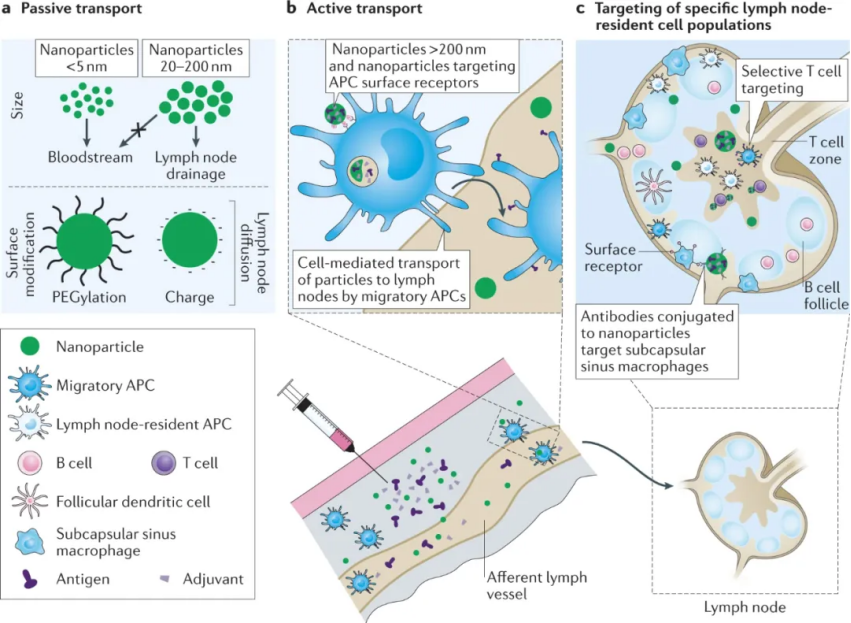
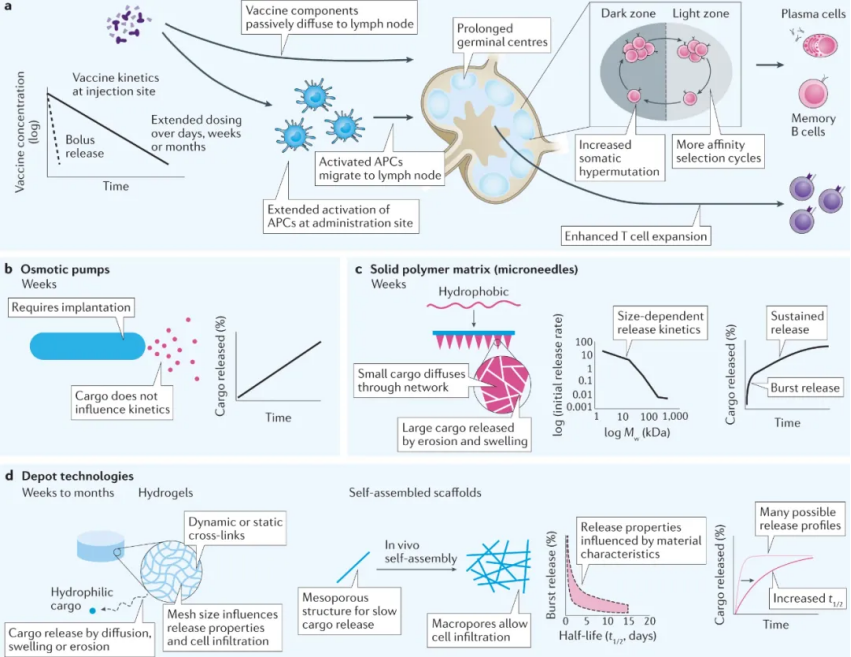
材料可用于通過傳入淋巴管將疫苗成分輸送到引流淋巴結中,這提供更易于轉化的工具,以增強淋巴結中的抗原呈遞、APC 成熟和淋巴細胞啟動。目前所研究的被動或主動運輸策略,可以被材料利用以到達關鍵細胞,使其成為克服與傳統遞送方法相關的挑戰的強大策略。疫苗成分被動靶向淋巴結駐留的 APC,繞過 APC 從注射部位遷移到淋巴結(通常需要 24-48 小時),可以實現更快速的 T 細胞激活。因此,能夠被動引流和延長疫苗成分在淋巴結中保留的遞送載體能夠快速刺激有效的免疫反應。由納米顆粒尺寸的精確設計,形狀和表面特性(即,電荷和疏水性)可以實現高效的淋巴結靶向,而無需特定的細胞靶向配體。細胞介導的運輸也可用于將疫苗成分輸送到淋巴結。在這里,外周 APC 在注射部位吸收貨物并通過淋巴管遷移到引流淋巴結,在那里它們激活 T 細胞并啟動免疫反應。可以通過直接靶向 APC 表面受體或通過調整納米顆粒大小和表面化學來設計遷移 APC 對納米顆粒貨物的攝取以及隨后向淋巴結的轉運。將疫苗成分靶向淋巴結中的特定免疫細胞可以提高疫苗反應;然而,淋巴結的結構和分隔使得獲取特定細胞群具有挑戰性。納米載體可用于克服這一挑戰并在時空上設計疫苗的遞送。納米顆粒大小、聚糖的存在和抗原價數都會影響免疫原靶向濾泡樹突細胞,濾泡樹突細胞在 B 細胞活化中發揮不可或缺的作用,并促進強大的抗體反應。如:50-100 nm 的納米顆粒在濾泡樹突細胞網絡中保留數周,而較小的顆粒在 48 小時內被清除。調制疫苗暴露的動力學到免疫系統能夠極大地影響免疫應答,因為疫苗應答的許多功能都需要精確的時域信號。與推注相同疫苗相比,持續釋放導致更強大的生發中心反應、更高的抗體滴度和更多樣化的表位靶向。因此,可以開發類似微針、疫苗倉庫技術來實現持續性釋放。綜上所述,疫苗反應由精確的時空信號引導,免疫調節材料可以提供這些信號,以提高疫苗反應的效力、持久性和質量。基于材料的疫苗接種策略可以通過改善先天免疫細胞的激活、創造局部炎癥微環境、靶向淋巴結遞送和控制疫苗遞送的時間框架來增強免疫反應,目的是誘導增強的記憶免疫以防止未來感染。本文強調了強體液和細胞介導的免疫反應背后的生物學機制,并探索了操縱和控制這些機制的材料設計策略。Roth, G.A., Picece,V.C.T.M., Ou, B.S. et al. Designing spatial and temporal control of vaccineresponses. Nat Rev Mater (2021).https://doi.org/10.1038/s41578-021-00372-2