許多生物技術和生物醫學應用依賴于工程細胞,這需要在體外或離體細胞內遞送大分子���,如 DNA、RNA 或蛋白質��。為了克服化學轉染試劑或病毒載體的局限性��,新的和改進的物理轉染技術的發展顯著激增�,所有這些技術都旨在實現體外或離體的有效細胞轉染�,并盡可能降低細胞毒性。其中�,納米顆粒 (NP) 敏化光穿孔��,或簡稱光穿孔��,是一種特別有前景的物理轉染方法��,提供了效率、安全性和靈活性的獨特組合。然而��,在生產用于治療應用的工程細胞時���,由于 NPs 的存在����,光穿孔的使用與安全性和監管問題有關。已經表明,在使用 Au NPs 進行光穿孔后����,即使經過嚴格洗滌����,大量Au仍與這些細胞相關����,而且在使用氧化鐵納米顆粒時也是如此。因此,從監管的角度來看����,通過 NP 致敏光穿孔工程改造的細胞將被歸類為“中等暴露的長期侵入性醫療器械”����,需要對其進行廣泛的生物相容性測試��。如果可以在不將細胞暴露于 NPs 的情況下進行光穿孔���,它將被歸類為“低暴露的短期非侵入性醫療設備”,只需要進行最低限度的生物相容性測試��。鑒于此,南京林業大學黃超伯���、熊燃華聯合比利時根特大學Kevin Braeckmans、Stefaan C. De Smedt等人提出了一種基于光熱電紡納米纖維 (PEN) 的簡單方法。通過在生物相容性電紡納米纖維中嵌入光敏納米顆粒����,可實現類似傳統的納米顆粒敏化光穿孔一樣進行光熱效應誘導膜通透性����,而無需細胞與納米顆粒直接接觸���。成果發表在Nature Nanotechnology上���。

納米纖維是由聚己內酯 (PCL) 和氧化鐵納米顆粒(IONPs)以不同重量百分比溶解在DMF- THF中的混合物制備的���。該混合物用于纖維的靜電紡絲����,纖維收集在安裝在接地旋轉收集器上的顯微鏡載玻片。研究人員首先表征了嵌入電紡納米纖維中的IONPs的形態、密度和分布�����。
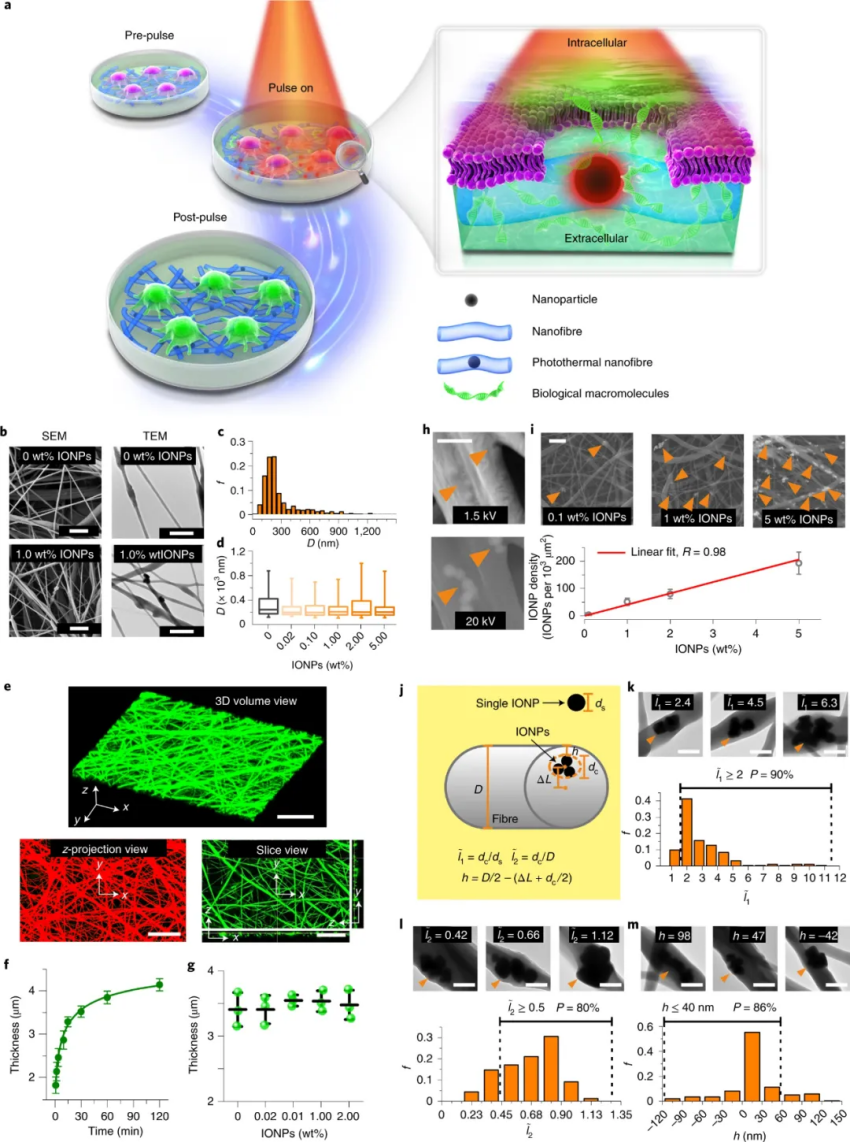
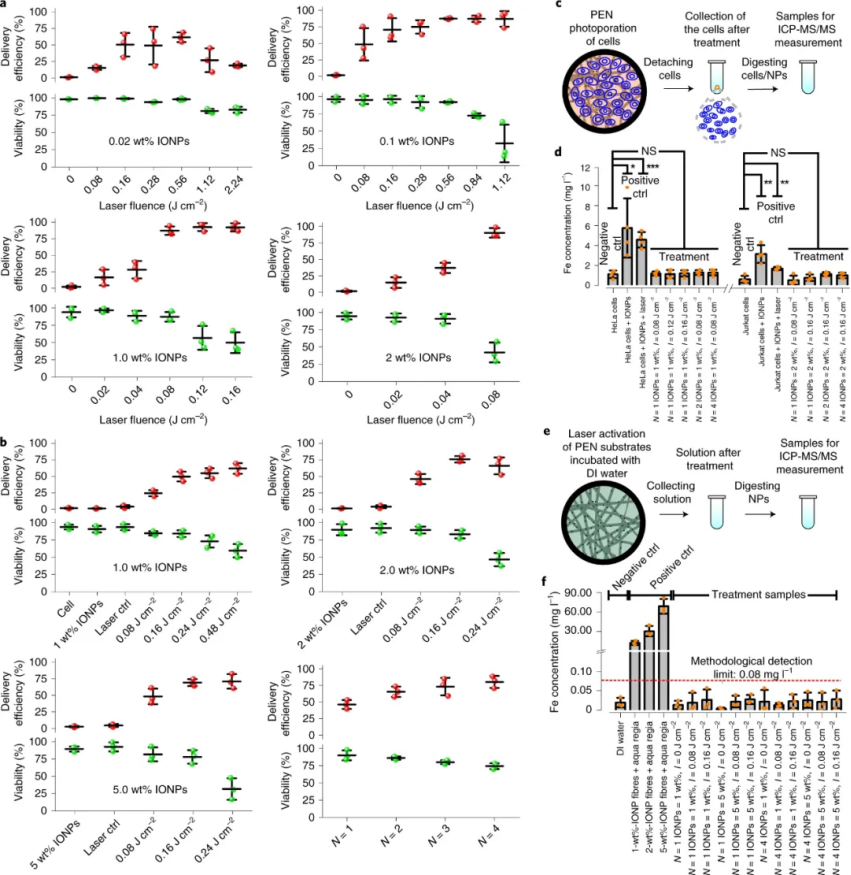
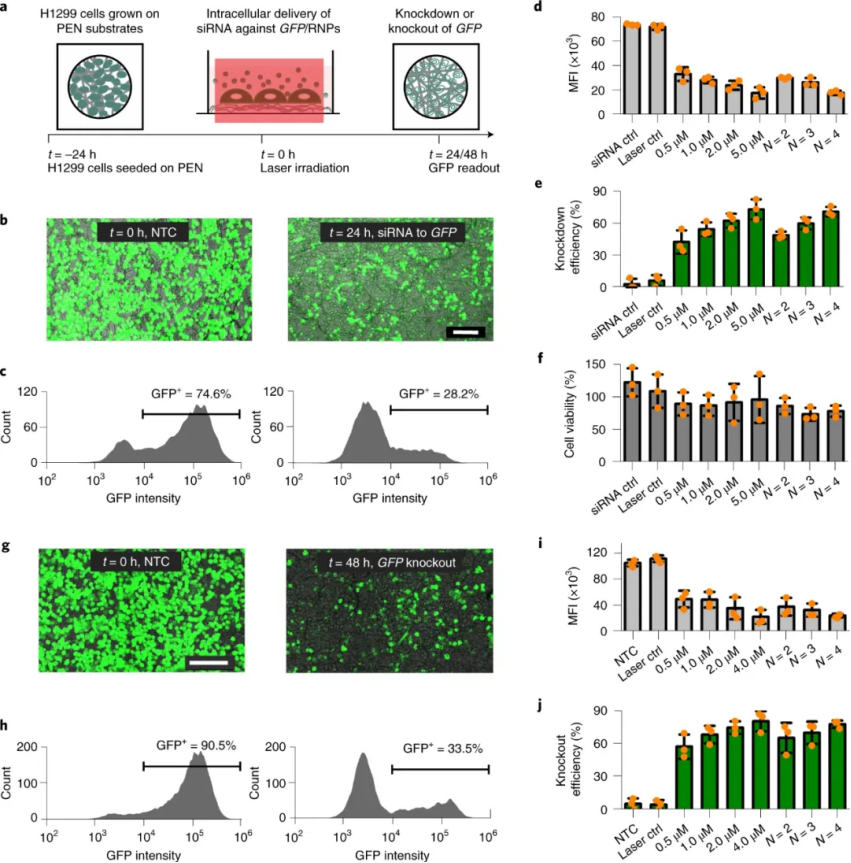
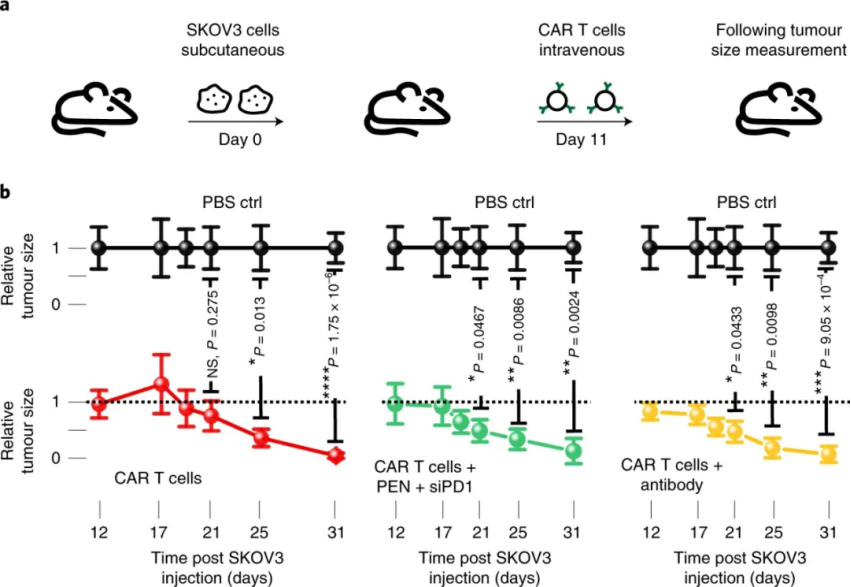
圖|光熱納米纖維細胞內遞送的概念和光熱電紡納米纖維的表征接下來��,研究人員確定在用納秒激光脈沖照射 PEN 后��,不僅可以在貼壁細胞實現安全有效地轉染一系列大分子(如10 kDa 葡聚糖),還可以用于懸浮細胞��。值得注意的是����,PEN 底物可以重復激光激活�,可導致遞送效率逐漸提高。此外�����,通過電感耦合等離子體串聯質譜法 (ICP-MS/MS) 進行的元素分析表明�,激光照射后沒有 IONPs 泄漏到細胞培養基中。還有���,從嵌入的 IONP 到細胞膜的熱傳遞的數值模擬使能夠了解激光脈沖能量密度、IONP 聚集狀態和納米纖維內的分布如何影響細胞膜通透性�。圖|PEN 光穿孔使大分子能夠安全有效地輸送到細胞在成功遞送模型大分子后�,研究人員研究了 siRNA和CRISPR-Cas9系統作為功能性大分子的遞送��。研究發現通過 PEN光穿孔在貼壁細胞中進行有效的基因沉默或敲除��。這表明PEN 光穿孔不僅能夠輸送相對較小的生物分子,如 siRNA�����,還能夠輸送相當大的大分子復合物��,如 CRISPR-Cas9 核糖核蛋白 (RNP)���。值得注意的是����,PEN 光穿孔細胞能夠立即恢復并呈指數增長�����,就像未經處理的細胞一樣����。然而��,電穿孔細胞需要 4 天才能恢復指數生長。圖|PEN光穿孔用于 siRNA 基因沉默或 CRISPR-Cas9 介導的基因敲除此外����,研究人員還證明了使用 PEN 光穿孔技術可以對胚胎干細胞和人類 T 細胞等難以轉染的細胞進行基因工程改造���,而且不會改變體外 T 細胞穩態和功能���。重要的是��,利用該技術對CAR T細胞進行改造�����,通過體內實驗觀察到用siPD1進行PEN光穿孔的CAR T細胞能夠在 21 天后顯著減小腫瘤體積,這證實了PEN 光穿孔 T 細胞完全保留了其治療潛力��,并且 siRNA 介導的 PD1 受體敲低可為實體瘤的治療提供治療優勢����。綜上所述,PEN 能夠在多種細胞類型中實現細胞膜透化�,而無需接觸具有潛在毒性的光熱納米粒子�,從而為使用光穿孔技術安全有效地生產基因修飾細胞療法鋪平了道路�。此外,已經證明����,這種方法可以有效地誘導干細胞中的基因敲除和原代人類 T 細胞中的基因沉默���,表明 PEN 光穿孔具有臨床轉化的潛力�,例如用于細胞治療的工程細胞的產生����,包括干細胞治療或過繼性 T 細胞療法���。Xiong,R., Hua, D., Van Hoeck, J. et al. Photothermal nanofibres enable safeengineering of therapeutic cells. Nat. Nanotechnol. (2021).https://doi.org/10.1038/s41565-021-00976-3