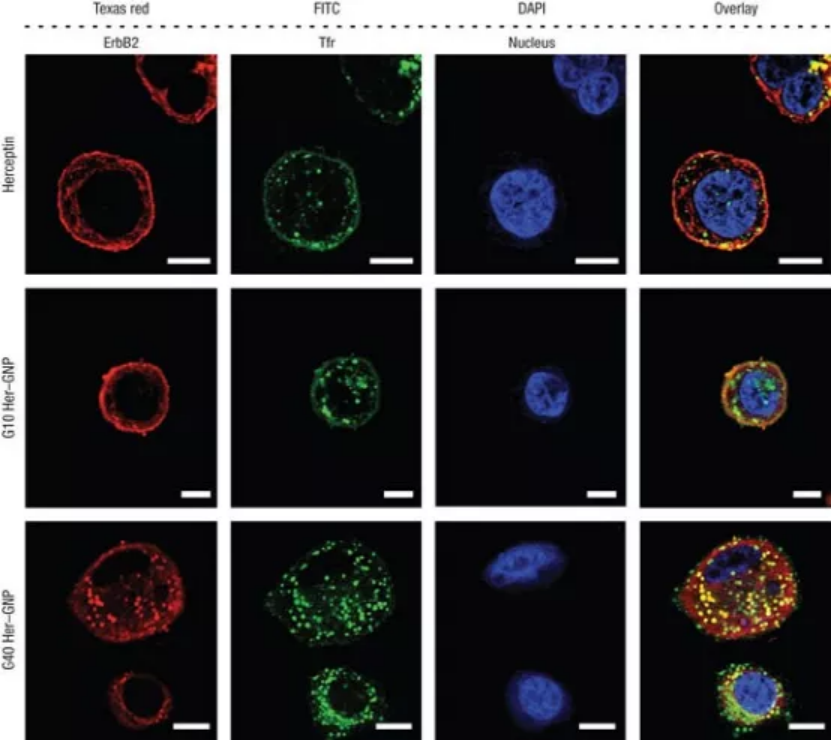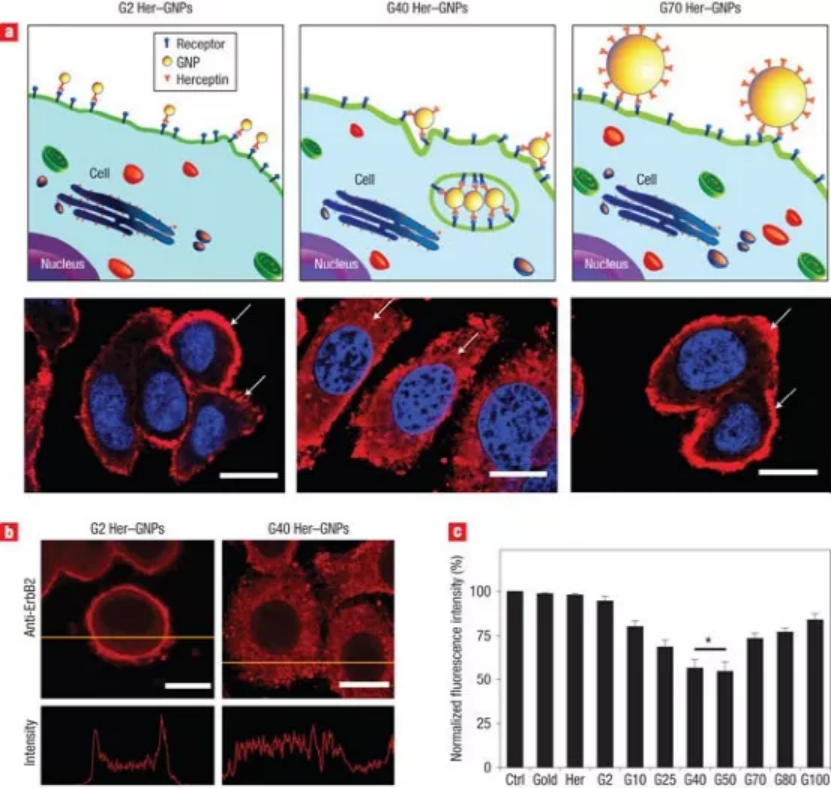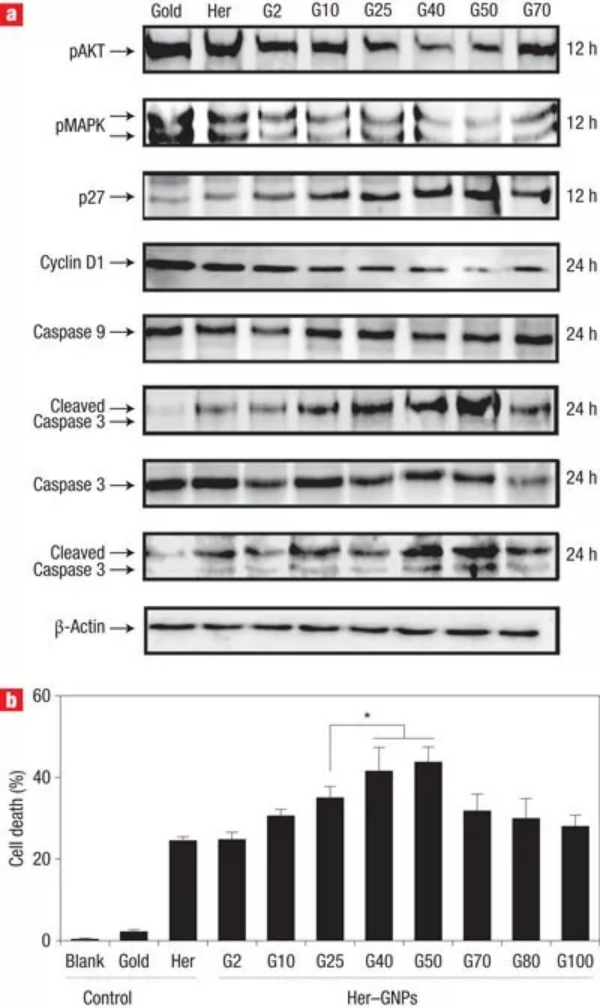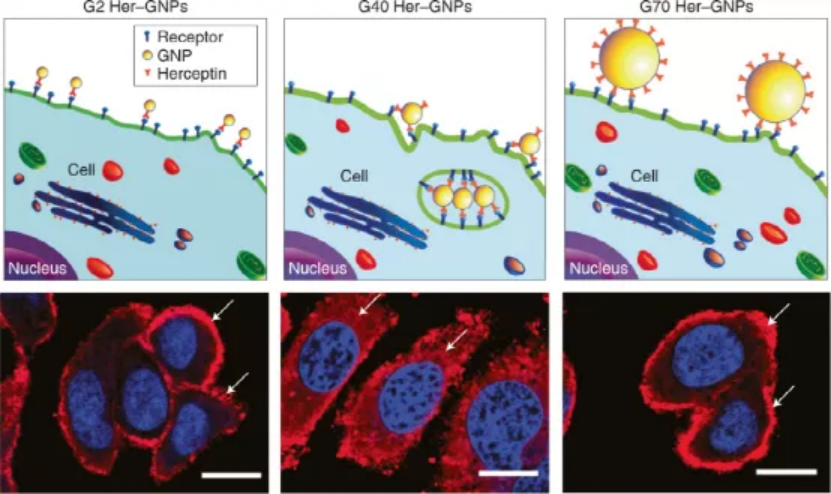
2008年,加拿大多倫多大學的Warren C. W. Chan教授在發表的一篇《Nature Nanotechnology》文章中提出,工程化的納米粒子可以積極調節目標細胞的反應,同時自己也可以作為治療劑。這項研究打破了以往的認知,即納米粒子只是被動的藥劑,僅用于將藥物運送到體內的特定目標,而不與生物環境發生相互作用。在該研究中,作者用赫賽汀分子功能化了不同尺寸的Au和Ag納米顆粒,用以靶向幾種卵巢癌和乳腺癌細胞表面過表達的ErbB2受體。通過研究這些納米顆粒與SK-BR-3細胞(一種乳腺癌細胞)的相互作用,觀察到了受體介導的細胞攝取依賴于納米顆粒的大小。通過熒光成像跟蹤直徑為2 nm、40 nm和70 nm納米顆粒的內吞,發現40 nm的納米顆粒的內吞作用最強。此外,當40 nm納米顆粒被吞噬時,驅動內化的ErbB2受體也被內化,這與游離赫賽汀或者40 – 50 nm直徑范圍外的納米顆粒的情況相反。該研究具有深遠的影響,這意味著通過改變抗體功能化納米顆粒的尺寸,可以改變膜結合ErbB2的水平。這直接影響細胞膜受體調控的細胞信號事件,從而調節細胞行為。事實上,與使用游離赫賽汀抗體處理的細胞相比,使用40 nm納米顆粒處理的細胞抑制了細胞生長和增加了細胞死亡。總之,這篇論文證明了納米顆粒不是被動的傳遞劑,而是可以主動修飾細胞行為用來調節細胞過程。它介紹了一種想法,即通過改變納米粒子的基本性質(如尺寸和曲率),可以使納米粒子用來刺激特定的細胞反應。這項工作還強調了研究納米粒子和生物物質之間的基本相互作用的重要性,以充分利用它們的能力,同時抑制它們的毒性。從那時起,這個概念就深深影響了納米醫學領域的研究。目前,該論文已被引用2730次(來源Google學術),其中包括多篇Science和Nature系列頂級期刊。該論文的主要作者Warren Chan說:“在我們創造了納米-生物相互作用這一術語之后,人們對基礎納米顆粒研究表現出了巨大的興趣。”“這些研究正在推動納米技術在癌癥、免疫和其他醫療應用方面的設計。”該論文的第一作者將在這項工作中獲得的見解應用到他隨后的科學研究中:“這項研究影響了我在開發用于癌癥免疫治療的多價抗體/蛋白質功能化納米顆粒方面的后續工作。雖然我們的研究重點是納米癌細胞的相互作用,但隨著癌癥免疫療法和疫苗的發展,同樣的原理可以應用于納米免疫相互作用。”自2008年以來,納米材料設計取得了重大進展,生產出了多種智能和多功能的納米顆粒,成功應用于臨床前研究中。這些功能化的納米顆粒能夠對不同刺激有響應,而且可以提供精確的疾病靶向,從而改善治療和診斷結果。盡管,納米-生物相互作用的基本認識取得了飛速的進展。但是,在13年后的今天,如何解開納米材料和生物實體之間通信的基本方面,仍然是釋放納米醫學全部潛力的關鍵。第一作者:Wen Jiang, Betty Y. S. Kim納米粒子可以控制細胞的基本功能,并有可能殺死癌細胞,這得益于它們本身的尺寸大小。要點1:尺寸明確的工程化納米顆粒積極參與和調節細胞反應的過程研究者合成了多價工程化納米顆粒來選擇性地控制赫賽汀及其受體ErbB2之間的特定相互作用。將多個赫賽汀分子附著在納米顆粒表面,可以形成多價工程化納米顆粒,交聯表面ErbB2受體,并改變細胞活動。使用大小在2到100 nm之間的膠體金納米顆粒(GNPs)制備了具有不同多價的穩定納米結構的懸浮液。與未修飾的GNPs相比,當與ErbB2過表達的人乳腺癌SK-BR-3細胞孵育時,觀察到Her-GNPs的攝取顯著增強。Her-GNPs的內化作用強度依賴于納米顆粒尺寸,在25-50 nm尺寸范圍內吸收效率最高,而在這個尺寸范圍之外的細胞攝取顯著減少。圖1. Her-GNPs和ErbB2受體之間的特定相互作用決定了它們的內化過程。內吞過程是膜受體呈現的直接衰減機制,Her-GNPs誘導交聯可以下調細胞膜ErbB2水平。游離的Herceptin、G2(Herceptin功能化的2 nm Au納米顆粒)、G10和G70處理的細胞表現出類似的膜ErbB2定位模式,幾乎不存在于細胞質中。但是,對于G25和G40 Her-GNP處理的細胞,大量ErbB2受體位于細胞質內。使用熒光強度測試的橫斷面分析證實ErbB2從細胞表面重新分布到細胞質。在G40/G50 Her-GNPs處理的細胞中,表面ErbB2水平的波動最為顯著,在兩種情況下都觀察到40%的下降。在其他納米顆粒系統中,包括赫賽汀包被的銀納米顆粒(Her-SNPs)中也觀察到類似的大小依賴的膜受體呈現減少趨勢。綜上所述,這些結果表明,利用納米顆粒大小可以實現膜受體下調。圖2. ErbB2受體內化對納米顆粒尺寸大小的依賴。圖3. 膜ErbB2表達下調與納米顆粒大小的關系。要點3:不同粒徑的納米顆粒對下游蛋白表達,40 nm納米顆粒處理的細胞抑制了細胞生長和增加了細胞死亡Her-GNP處理的細胞中膜受體表達水平的改變直接影響下游激酶的翻譯后修飾,這些激酶對ErbB2信號通路至關重要。研究者觀察到AKT和MAPK的活化顯著降低,其中在G40/G50 Her-GNPs處理的細胞中效果最佳。AKT下游的細胞周期調節因子(如細胞周期蛋白D1)在24 h時被抑制,細胞周期蛋白依賴性激酶抑制劑p27在12 h后表達升高。而在游離Herceptin處理的細胞中,這些蛋白的基礎表達水平表明Her-GNPs積極參與增強生長抑制作用。因為AKT的激活也可以抑制凋亡信號,檢測了caspase的激活作用。與單獨使用Herceptin處理相比, G40 Her-GNPs處理細胞導致細胞死亡幾乎增加了兩倍。雖然所有Her-GNPs均能增強凋亡活性,但在G40或G50 Her-GNPs處理的細胞中差異最大。使用Her-SNPs體系也獨立證實了類似的實驗結果,表明所觀察到的效應也適用于其他納米顆粒體系。(1)尺寸明確的工程化納米粒子可以選擇性地誘導膜受體內化,下調其表達水平。這反過來又會改變下游的信號傳遞和隨后的細胞反應。(2)證明納米結構不僅可以被動地與細胞相互作用,而且還可以積極參與和調節對調節細胞功能至關重要的分子過程。(3)這一概念在理解納米結構與生物系統的相互作用和協助智能納米器件的設計方面具有重要意義,對發展基于分子的新型診斷和治療具有巨大潛力。1、Jiang, W., Kim, B., Rutka, J. et al. Nanoparticle-mediated cellular response is size-dependent. Nature Nanotech 3, 145–150 (2008).DOI:10.1038/nnano.2008.30https://doi.org/10.1038/nnano.2008.302、Pastore, C. Size-dependent nano–bio interactions. Nat. Nanotechnol. 16, 1052 (2021).DOI: 10.1038/s41565-021-00996-zhttps://doi.org/10.1038/s41565-021-00996-z