最近,微生物納米藥物在腫瘤治療領(lǐng)域顯示出巨大的前景。這種復(fù)合納米藥物整合選定的微生物和納米材料可能會顯示微生物療法的優(yōu)勢,同時將不良副作用降至最低,這鼓勵研究人員制造一種新的“微生物納米藥物”,該藥物有望用于腫瘤特異性治療,而不會對正常組織產(chǎn)生嚴重副作用。
鑒于此,中國科學院上海硅酸鹽研究所施劍林院士、林翰等人報道了一種名為LOD/TPZ@Lips-LA 的新型微生物納米藥物,它是通過將乳酸氧化酶(LOD)和前藥替拉扎明(TPZ)共負載的脂質(zhì)體通過通過酰胺縮合反應(yīng)錨定在乳酸菌 (LA) 表面而構(gòu)建的,用于化療協(xié)同的抗腫瘤免疫。成果發(fā)表在Nano Today上。

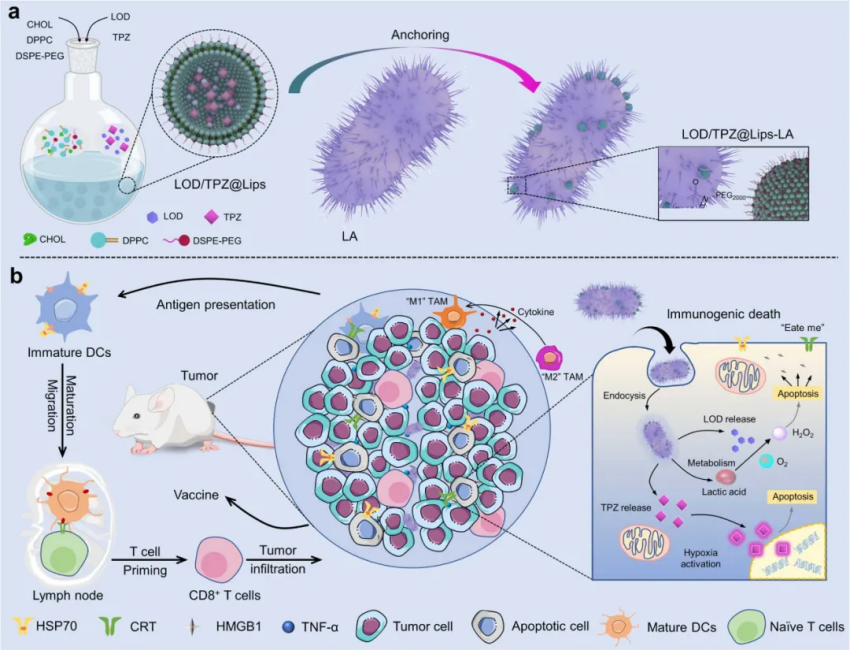
整體示意圖
負載的乳酸氧化酶(LOD)催化乳酸氧化成H2O2,導(dǎo)致氧化應(yīng)激水平增加,進一步加劇腫瘤內(nèi)的缺氧,從而激活對缺氧敏感的TPZ前藥進行化療。此外,TPZ 和LOD 通過 LA 的腫瘤靶向性質(zhì)有效地遞送至腫瘤組織,其中納米藥物通過原位 ROS 產(chǎn)生和基于LA代謝的 TPZ 激活誘導(dǎo)顯著的腫瘤細胞凋亡。除了通過 TZP 直接誘導(dǎo)腫瘤細胞凋亡外,LOD/TPZ@Lips-LA 還可以進一步誘導(dǎo)強大的 ICD,這可以通過上調(diào)標記蛋白表達(例如鈣網(wǎng)蛋白 (CRT)、熱休克蛋白 70 (HSP70) 和高移動性組框 1 (HMGB1))。
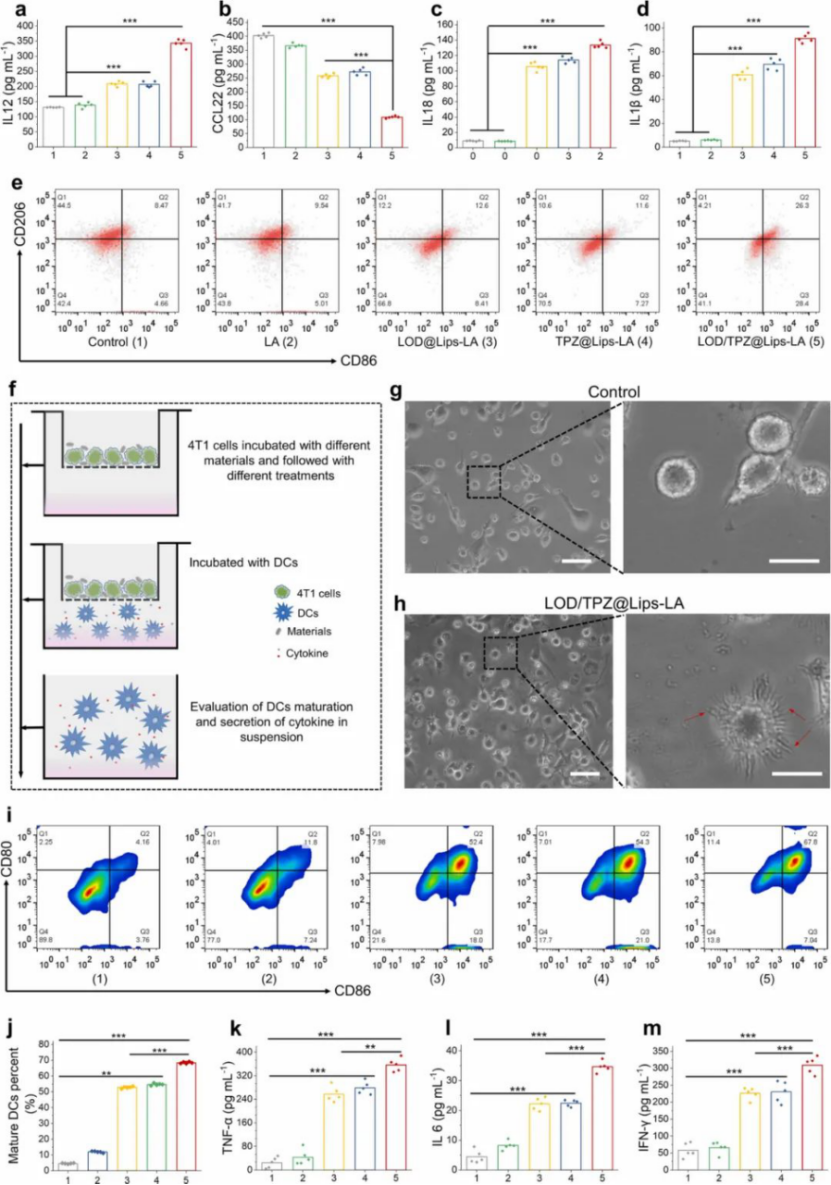
圖|微生物藥物誘導(dǎo)的RAW 264.7 體外免疫反應(yīng)和 DCs 成熟
更重要的是,LOD/TPZ@Lips-LA誘導(dǎo)的ICD通過顯著的生物標志物表達調(diào)控誘導(dǎo)強大的抗癌免疫,其特征是先天性腫瘤相關(guān)巨噬細胞的抗致瘤性M1極化和適應(yīng)性細胞毒性 CD8+ T 細胞在腫瘤中的浸潤,從而協(xié)同放大所設(shè)計的微生物藥物的腫瘤抑制作用。
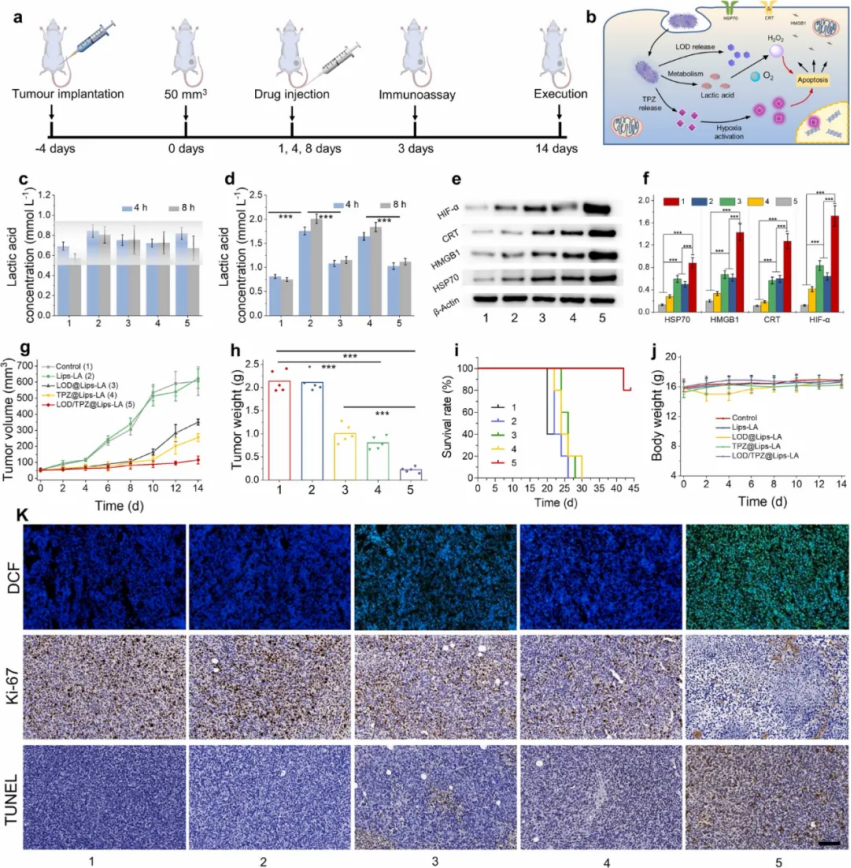
圖| LOD/TPZ@Lips-LA對4T1荷瘤小鼠的體內(nèi)腫瘤治療效果
綜上所述,本文設(shè)計并構(gòu)建了一種新型微生物納米藥物,以協(xié)同基于細菌代謝的化學療法與由化學療法誘導(dǎo)的免疫原性細胞死亡 (ICD) 激活的增強的抗腫瘤先天/適應(yīng)性免疫。這種基于細菌代謝和協(xié)同抗腫瘤免疫的 LOD/TPZ@Lips-LA 策略啟用了ICD,通過設(shè)計新型微生物納米醫(yī)學,為未來進行高效癌癥治療提供了一種有前景的范例。
參考文獻:
Microbiotic nanomedicine for tumor-specific chemotherapy-synergized innate/adaptive antitumor immunity. Nano Today 2022.
DOI: 10.1016/j.nantod.2022.101377
https://doi.org/10.1016/j.nantod.2022.101377











