生物大分子,包括肽、蛋白質和RNA,由于其高效、特異性和安全性等關鍵優勢,是治療各種疾病的有前途的治療方法。然而,由于其細胞膜通透性差和或限制其細胞內暴露的內體包埋,其治療潛力尚未完全實現。因此,人們對開發能夠將治療藥物輸送到細胞質的安全載體有著濃厚的興趣。理想情況下,內體逃逸可以在載體中進行化學編碼,以促進治療有效載荷的釋放。或者,使用非內吞進入機制的方法也可以提高輸送效率。此外,重要的是,封裝方法不會影響貨物的生物活性,并且載體的細胞毒性可以忽略不計。目前解決這些問題的策略依賴于納米級載體,例如無機納米粒子、合成聚合物或納米級混合組件,它們可以介導細胞膜融合。在替代方法中,大分子藥物與細胞穿透肽結合或復合以增強內體逃逸。盡管這些方法很有前景,并且越來越多地考慮用于臨床轉化,但它們也存在缺陷。具體來說,制造方法可能很復雜,并且經常使用會降低生物活性的有機溶劑。一些載體僅限于特定類型的生物大分子,而另一些則僅限于釋放分子量相對較小的有效載荷。對于某些載體,例如無機和脂質納米顆粒,也提出了安全問題。無論載體是無機基還是有機基(聚合物、脂質、肽或其融合物),通常認為它們的尺寸必須低于200nm才能穿過細胞膜。最近的研究挑戰了這個概念。具體而言,研究發現通過液-液相分離(LLPS)獲得的微米大小的肽凝聚物(其中可以募集蛋白質和低分子量化合物)也能夠通過非內吞途徑穿過細胞膜,有可能為治療藥物的細胞內傳遞開辟新途徑。受富含組氨酸(His)的自凝聚喙蛋白(HBPs)啟發的肽凝聚體與傳統的納米級遞送載體相比,表現出幾個優勢,包括:(1)快速(在幾秒鐘內)和有效地在凝聚微滴內招募治療藥物;此外,誘導凝聚的物理化學條件可以通過單個氨基酸突變精確調節。基于這些優點,南洋理工大學Ali Miserez等人假設肽凝聚物可用于細胞內遞送具有廣泛分子量和等電點(IEP)的大分子治療劑。成果發表在Nature Chemistry上。

為了實現這一點,研究人員開發了短的富含組氨酸、pH 響應的喙肽 (HBpep) 凝聚體,該凝聚體與含有二硫鍵的自我犧牲部分結合,可觸發液滴的分解,從而促進有效載荷在細胞內還原環境中的遞送。具體而言,HB pep在低 pH 值下處于單體狀態,但隨后在中性 pH 值下迅速相分離成凝聚微滴,同時在該過程中從溶液中募集各種大分子。
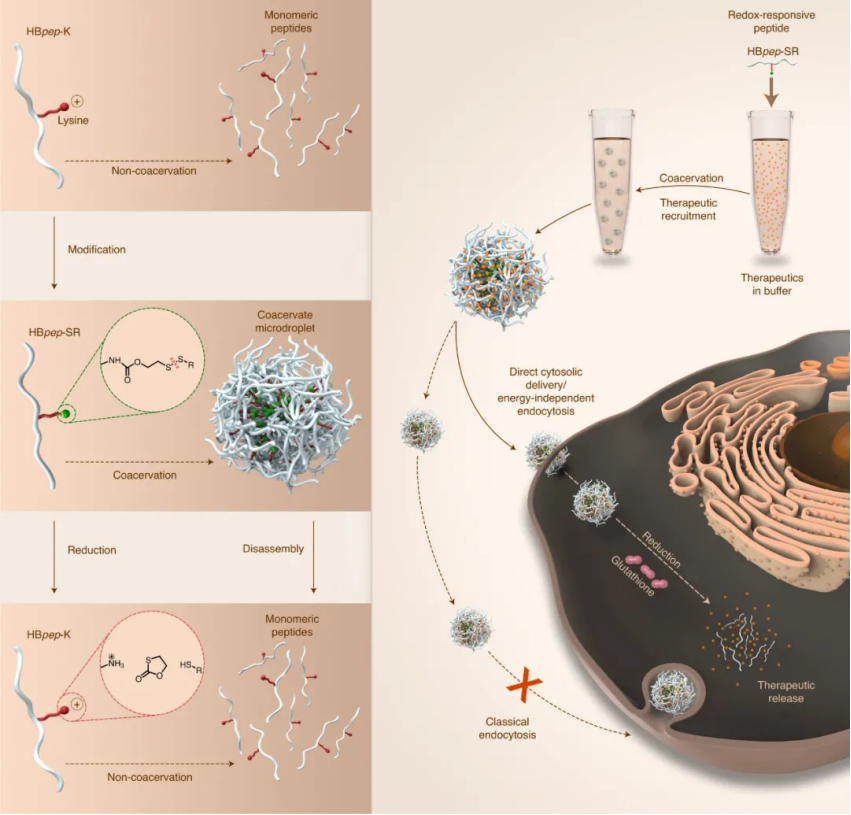
圖|氧化還原反應肽的設計可使HBpep SR直接進入細胞內,從而繞過經典的內吞作用研究人員發現,這些凝聚體微滴繞過經典的內吞途徑,能夠直接有效地在細胞溶質中遞送各種大分子,從小至 726 Da 的治療性肽到大至 430 kDa 的酶。它們還可以以高轉染效率遞送信使RNA(mRNAs),同時還可以防止它們被核糖核酸酶過早降解,這可能是因為一旦形成微滴,RNase就不能通過微滴擴散。綜上所述,本文表明,HBpep-K與自我犧牲部分結合后(HBpep SR),呈現液-液相分離,形成凝聚微滴,在其中可以有效地招募各種生物大分子(包括蛋白質、肽和 mRNA)。裝載貨物的凝聚體被各種細胞系吸收并在細胞質中實現氧化還原觸發的貨物釋放。貨物募集和隨后釋放的多功能性使這些氧化還原反應凝聚體能夠提供單一或組合的大分子治療劑,使這種細胞內遞送平臺成為治療各種人類疾病(如癌癥、代謝和傳染病)的有希望的候選材料。值得注意的是,該方法不涉及內體逃逸或細胞膜融合(細胞內遞送的兩種主要機制),并且凝聚體是微米大小的載體,而不是當前絕大多數細胞內遞送策略中使用的納米載體。據推測,通過液-液相分離實現的凝聚體的液體狀特性對其穿過細胞膜的能力至關重要,從而導致膽固醇依賴性攝取,盡管確切的進入機制仍不清楚,目前正在研究中。未來的工作將旨在闡明肽微滴的攝取和膜運輸途徑,以及評估它們的體內安全性、有效性和組織分布。還設想可以通過其他物理化學觸發器誘導微滴分解和治療劑釋放,這可以進一步擴大它們在細胞內藥物遞送應用中的轉化潛力。Sun,Y., Lau, S.Y., Lim, Z.W. et al. Phase-separating peptides for direct cytosolicdelivery and redox-activated release of macromolecular therapeutics. Nat. Chem.(2022).https://doi.org/10.1038/s41557-021-00854-4










