能夠?qū)⑼庠葱载浳镙斔偷交罴?xì)胞中的藥物備受追捧,并在細(xì)胞生物學(xué)中得到廣泛應(yīng)用,而有效的細(xì)胞內(nèi)靶向?qū)τ陂_發(fā)新型診斷和治療藥物至關(guān)重要。功能性單克隆抗體的細(xì)胞內(nèi)遞送將允許利用以前無法成藥但與治療相關(guān)的靶標(biāo),例如大量的細(xì)胞內(nèi)蛋白質(zhì)-蛋白質(zhì)相互作用 (PPI)。盡管該領(lǐng)域取得了進(jìn)展,但由于當(dāng)前載體的毒性或有限的功效,細(xì)胞內(nèi)遞送仍然是一項艱巨的挑戰(zhàn)。使用病毒和非病毒載體以及電穿孔等物理技術(shù)將貨物運(yùn)送到細(xì)胞中。每種方法在體外、離體和體內(nèi)應(yīng)用的背景下都呈現(xiàn)出明顯的優(yōu)勢和劣勢。聚陽離子非病毒載體,如聚合物、脂質(zhì)顆粒和細(xì)胞穿透肽 (CPPs),在過去的三十年中被廣泛研究,作為將藥物轉(zhuǎn)運(yùn)到細(xì)胞中的一種手段。原型CPP Tat 已廣泛用于細(xì)胞內(nèi)靶向治療的設(shè)計。然而,內(nèi)吞捕獲被認(rèn)為是細(xì)胞內(nèi)遞送的障礙。Tat 遞送的貨物從內(nèi)體的低水平泄漏通常效率太低,無法適用于大多數(shù)細(xì)胞內(nèi)靶向應(yīng)用。
最近的一些研究試圖解決內(nèi)體捕獲的問題。發(fā)現(xiàn)與綠色熒光蛋白綴合的環(huán)化 Tat (cTat-GFP)和寡精氨酸通過跨細(xì)胞膜的直接易位進(jìn)入細(xì)胞質(zhì)和細(xì)胞核。線性寡聚精氨酸被用作一種試劑,通過與質(zhì)膜的直接相互作用將一系列貨物(包括酶、納米抗體和抗體)輸送到細(xì)胞中。一種專門設(shè)計用于內(nèi)體分解的 CPP (L17E) 被證明可以促進(jìn)貨物從內(nèi)體中逸出。在體內(nèi)轉(zhuǎn)化應(yīng)用中使用這些方法的一個重要障礙是在體外獲得理想結(jié)果所需的相對較高的濃度 (>10μM)。重要的是,臨床使用的免疫治療劑(10mg kg-1)的典型劑量導(dǎo)致抗體血漿峰值濃度僅為 2μM 或更低,這強(qiáng)調(diào)了對活性約為 1μM 的 CPP 遞送技術(shù)的需求。
觀察到 Tat 和其他 CPP 在內(nèi)化之前聚集,以及最近對聚陽離子劑的電荷密度與遞送功效之間關(guān)系的見解,因此,可以假設(shè)預(yù)先將 Tat 肽排列成多聚體簇確定的化學(xué)支架會增加它們的功效。
鑒于此,牛津大學(xué)Katherine A. Vallis等人報道了一種使用三聚體細(xì)胞穿透肽 (CPP) 將抗體和抗體片段遞送到細(xì)胞質(zhì)和細(xì)胞核中的方法。成果發(fā)表在Nature Chemistry上。

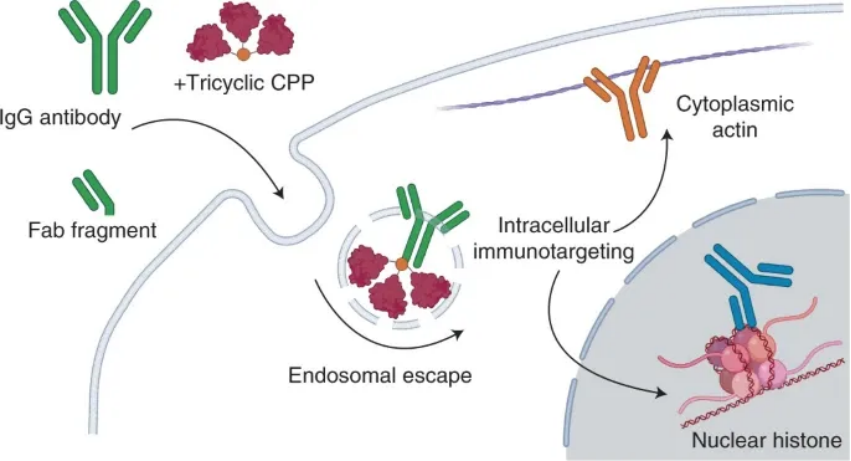
示意圖
研究人員報道了基于Tat肽的線性和環(huán)狀序列的四種Tat三聚體的設(shè)計和合成,其排列在兩種不同的四聚體核心結(jié)構(gòu)上,其使用活細(xì)胞共聚焦顯微鏡在體外評估。結(jié)果表明,合成核心結(jié)構(gòu)的幾何形狀影響遞送的功效,并且用環(huán)化變體替換線性Tat改變了攝取機(jī)制。
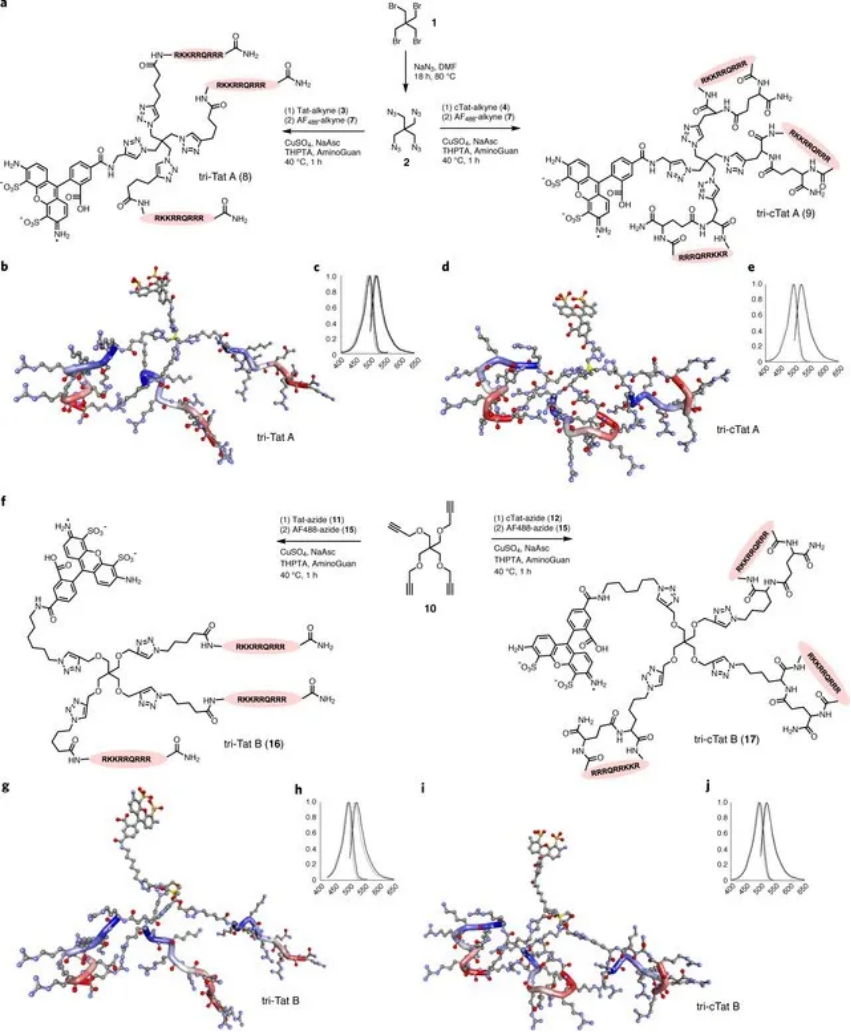
圖 | 三聚體 Tat 構(gòu)建體的合成
研究人員確定了一種三環(huán)先導(dǎo)結(jié)構(gòu)(三聚炔烴官能化支架B, tri-cTat B),并展示了將功能性抗體和抗體片段遞送到 HeLa 細(xì)胞的胞質(zhì)溶膠中,這些抗體和抗體片段結(jié)合細(xì)胞內(nèi)肌動蛋白原纖維和在活細(xì)胞的胞質(zhì)溶膠和細(xì)胞核中表達(dá)的熒光蛋白。
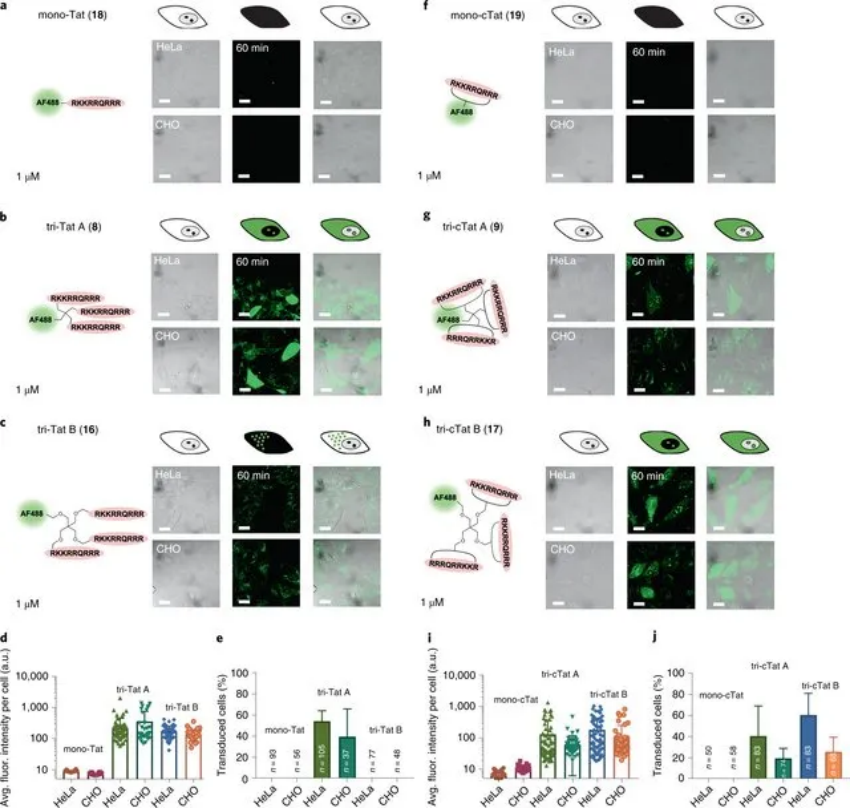
圖|HeLa 和 CHO 細(xì)胞中線性和環(huán)狀 Tat 三聚體的活細(xì)胞共聚焦顯微鏡
本報告中提供的數(shù)據(jù)表明,CPP 不是通過單一途徑進(jìn)入細(xì)胞質(zhì),而是能夠結(jié)合不同的細(xì)胞表面成分,并易于在攝取機(jī)制之間切換,以找到進(jìn)入細(xì)胞的最有利的途徑。研究結(jié)果表明,可以通過改變 Tat 三聚體構(gòu)象的幾何形狀來改變攝取機(jī)制,同時保持氨基酸序列和凈電荷不變。
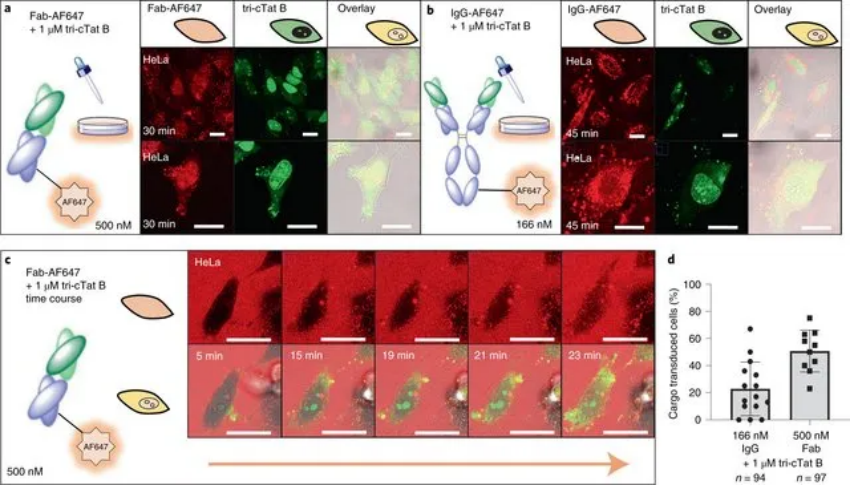
圖|使用 tri-cTat B 在活 HeLa 細(xì)胞中共同遞送抗體和抗體片段
綜上所述,tri-cTat B是一種高效的非病毒遞送劑,可將生物大分子貨物快速、無毒地轉(zhuǎn)運(yùn)到細(xì)胞中。與病毒遞送方法相比,這種方法具有一些重要的優(yōu)勢,病毒遞送方法僅限于核酸遞送,可以觸發(fā)宿主免疫反應(yīng),而機(jī)械遞送方法經(jīng)常導(dǎo)致細(xì)胞質(zhì)內(nèi)容物丟失,會過度破壞有機(jī)分子并使蛋白質(zhì)變性,并且不太適合體內(nèi)翻譯。使用 β-肌動蛋白抗體和 Fab 片段成功靶向肌動蛋白應(yīng)力纖維,以及使用 IgG 進(jìn)行核內(nèi) RFP,提高了使用免疫劑對抗細(xì)胞質(zhì)和細(xì)胞核內(nèi)的治療靶標(biāo)以影響以前無法藥物治療的疾病相關(guān)途徑的可能性。總之,tri-cTat B可以作為一種有效的遞送劑來解決靶向細(xì)胞內(nèi)治療靶點的挑戰(zhàn)。此外,這里報道的結(jié)構(gòu)-活性見解將有助于開發(fā)具有定制機(jī)械特性的新型 CPP 多聚體。
值得注意的是,南洋理工大學(xué)Ali Miserez等人近日發(fā)表在Nature Chemistry上的發(fā)現(xiàn),表明凝聚體微滴可繞過經(jīng)典的內(nèi)吞途徑,能夠直接有效地在細(xì)胞溶質(zhì)中遞送各種大分子,從小至 726 Da 的治療性肽到大至 430 kDa 的酶。(另辟蹊徑!截然不同的胞質(zhì)遞送方式,登上Nature Chemistry!)

參考文獻(xiàn):
Tietz,O., Cortezon-Tamarit, F., Chalk, R. et al. Tricyclic cell-penetrating peptidesfor efficient delivery of functional antibodies into cancer cells. Nat. Chem.(2022).
https://doi.org/10.1038/s41557-021-00866-0











