大多數藥物使用需要頻繁給藥的短效制劑,這會對患者的依從性產生負面影響,并增加與使用不一致相關的失敗風險。相比之下,長效釋放制劑可以實現藥物持續數周、數月或數年的持續釋放。長效藥物遞送可以通過將體內藥物水平維持在不低于最低治療血漿濃度或不超過安全閾值濃度的最佳濃度來提高藥物療效和安全性。這對于一些特定患者或必須到達身體特定區域(例如口腔、關節、眼睛或大腦)的藥物,長效局部治療尤為重要。近日,美國佐治亞理工學院Mark R. Prausnitz在Nature Reviews Materials上討論了釋放藥物至少 1 個月并已獲得美國食品和藥物管理局 (FDA) 批準的長效給藥制劑的進展,重點是其制劑中使用的材料。

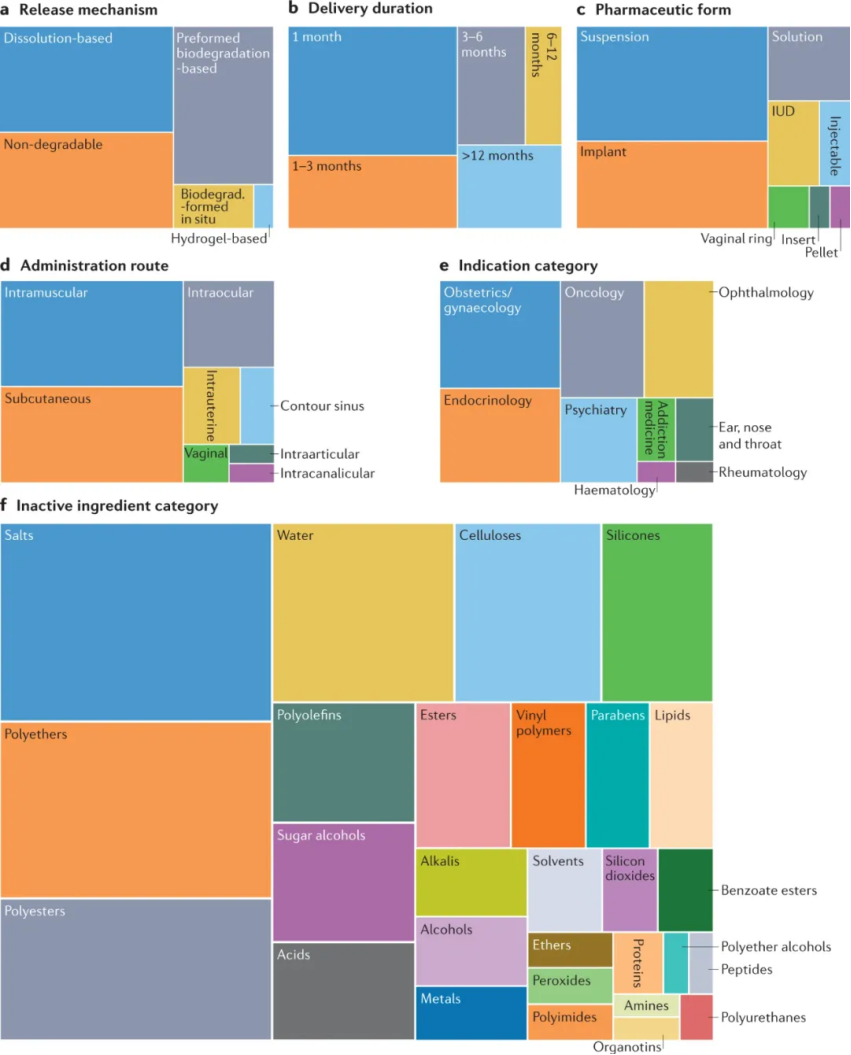
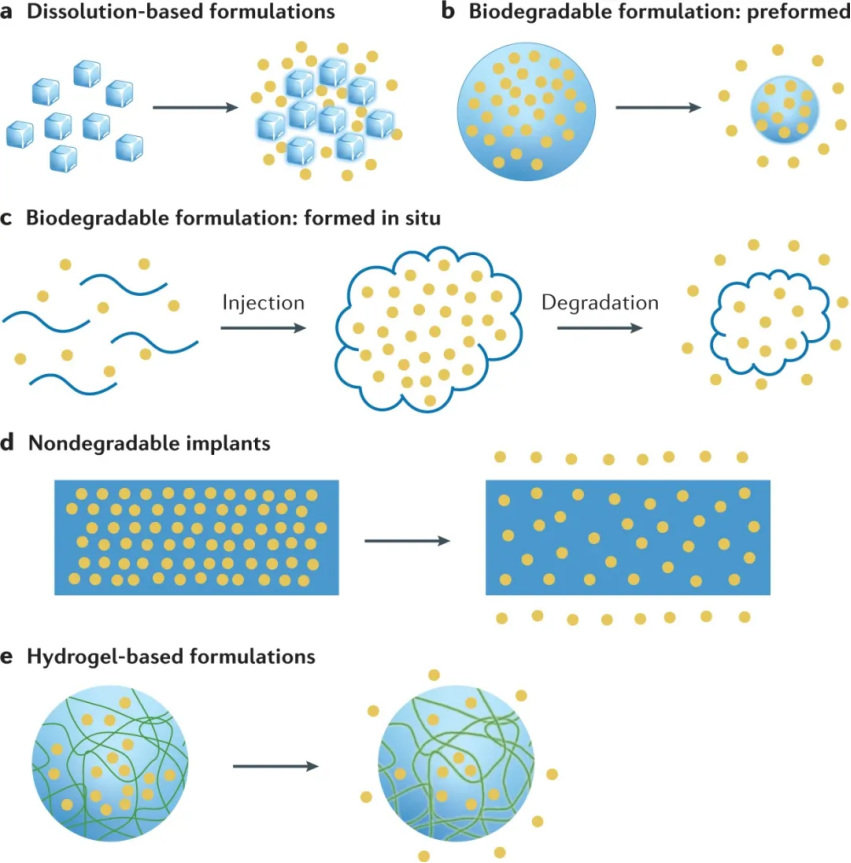
大多數長效給藥制劑的設計基于溶解型制劑、預制或原位可生物降解系統、不可降解植入物或水凝膠。作者發現了60多種不同的材料用于長效遞送配方,最常見的是鹽、聚醚、聚酯、水、纖維素、有機硅、聚烯烴、糖醇、酯和酸或堿。
圖|長效給藥制劑的類型
用于遞送難溶性藥物的基于溶解的藥物遞送制劑作為藥物顆粒的懸浮液注射,該懸浮液精細分散在水性或油性載體中。藥物粒徑可能從納米到數百微米不等;由于其較小的表面積與體積比,較大的顆粒通常釋放藥物更慢。注射的顆粒通常保留在給藥位置,在那里它們可能被吞噬細胞內化。然后藥物通過緩慢溶解釋放,允許局部治療作用或全身吸收。與通常具有較低載藥量的賦形劑控制的長效制劑相比,藥物混懸劑遞送還允許施用高藥物劑量。此外,藥物的化學穩定性可以通過混懸劑提高,因為藥物制劑在釋放到體內之前一直保持固態。作者確定了至少 21 種經FDA批準的基于溶解的長效給藥制劑。這些配方中的大多數設計用于每月遞送,其中一些持續 2 至 3 個月,而兩種配方可以釋放 6 個月。這些藥物被配制成混懸劑(水介質中水溶性較差的藥物晶體),大多數是肌肉注射;有些是皮下注射或注入眼睛。可溶性太高而無法開發為活性藥物成分懸浮液的藥物可以與速率控制賦形劑一起配制,以實現長效藥物遞送。通常,藥物被封裝在可生物降解的聚合物基質中,其作用是減緩藥物釋放并在釋放過程中穩定藥物。用于此類制劑的聚合物通常不溶于水,并通過水解或酶促過程分解成可從體內清除的水溶性無毒化合物。這些可生物降解的遞送制劑通常通過注射以微粒或毫米直徑的圓柱形植入物的形式引入,在幾個月的過程中緩慢降解并釋放包埋的藥物。通常用于可生物降解遞送制劑的聚合物通常由 PLG、PLGA、PLA 或聚丙交酯制成。目前,有22 種 FDA 批準的長效藥物產品使用可生物降解的給藥制劑,其中 18 種使用預制制劑,4 種使用在體內原位形成的制劑。幾乎所有可生物降解的預成型藥物遞送制劑都使用 PLG 和聚丙交酯作為其主要賦形劑來控制藥物釋放速率。這些產品中約有一半是肌肉注射,其余的則通過皮下或其他部位進行局部作用,例如注入眼睛、關節或鼻竇。大多數制劑的藥物釋放時間為 1 個月,少數制劑可達到長達 6 個月的緩釋。
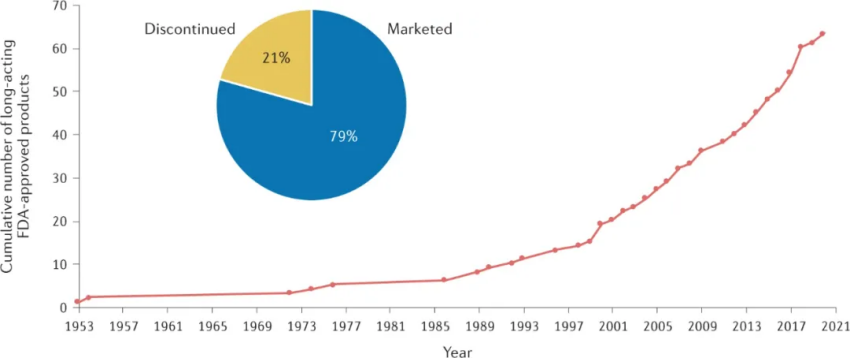
與預先形成的制劑相比,原位形成的基于生物降解的制劑通常能夠更容易地施用和/或更簡單地制造。使用注射器將原位形成的制劑以液體形式注射,以在給藥部位形成(半)固體貯庫。所得的可生物降解基質在聚合物分子量下降和聚合物在體內最終侵蝕后,會在數周或數月內緩慢釋放藥物。與預制制劑相比,原位形成的制劑更容易制造,因為它們通常涉及液體溶液或懸浮液,無需形成(通常是干燥)顆粒或制造植入物。然而,原位制劑的缺點是有機溶劑與活性藥物成分和聚合物賦形劑一起注射到體內;因此,需要考慮安全暴露限值,及其增加的毒性和副作用。此外,由于有機溶劑快速釋放到組織中,注射會引起灼燒感。與具有生物吸收優勢的生物可降解遞送制劑相比,不可降解植入物(每次給藥一個或幾個宏觀裝置)能夠實現更長時期的受控藥物釋放,長達數年。然而,這些裝置要么終生留在體內,要么需要在使用后通過小型外科手術移除。藥物釋放植入物可以通過注射或插入(例如,皮下、眼睛中)、手術放置(例如,動脈內)或其他程序(例如,子宮內或陰道放置)來施用。植入物可以是簡單或復雜的宏觀裝置,與可注射的、可生物降解的制劑相比,由于載藥量高,藥物釋放時間更長。不可降解植入物的基質設計可能類似于生物可降解制劑,其中藥物均勻分散在聚合物基質內并通過擴散釋放。這種基質設計易于制造,但通常無法實現穩定的零級釋放動力學,因此可能導致植入后突然釋放。各種不可降解的生物相容性聚合物已用于制造植入物,包括有機硅、聚乙烯醇 (PVA)、EVA和聚甲基丙烯酸甲酯 (PMMA)。FDA 已批準 19 種使用不可降解植入物遞送制劑的藥物,其中 11 種為棒狀植入物,8 種為 IUD、陰道環或支架。除三種產品外,所有產品的藥物有效期至少為 1 年,一半產品的有效期至少為 3 年,一種產品的藥物有效期長達 6 年。基于水凝膠的制劑包含在水溶液中形成交聯網絡的親水性聚合物。水凝膠含有很大一部分水,可以輸送親水性小分子、大分子藥物和細胞。基于水凝膠的制劑通常由可生物降解的聚合物制成,或者是從體內自然清除而不會降解的聚合物。與可生物降解的配方相比,水凝膠具有親水性并具有出色的吸水能力。水凝膠遞送制劑特別適用于不穩定的藥物,例如蛋白質和肽,它們在暴露于有機溶劑、熱、干燥和與它們摻入聚合物制劑相關的加工條件時容易變性。藥物可以通過擴散、網絡降解、溶脹、機械變形和/或聚合物-藥物相互作用的變化(例如共價共軛、靜電相互作用和疏水締合)逐漸從水凝膠中釋放出來。藥物釋放特性可以通過改變凝膠的化學成分或交聯的程度和類型來調整。與由疏水性聚合物組成的制劑相比,水凝膠的親水性和高含水量通常會導致相對快速的藥物釋放。這些親水特性通常使將疏水藥物包封在水凝膠中具有挑戰性。天然水凝膠形成材料,包括蛋白質(例如,纖維蛋白、膠原蛋白和明膠)、肽和多糖(例如,殼聚糖、藻酸鹽、透明質酸和葡聚糖),具有生物相容性、可生物降解性和廣泛可得性。而合成聚合物通常具有明確的結構和可調節的功能。迄今為止,只有一種使用基于水凝膠的長效遞送制劑的產品 Dextenza(Ocular Therapeux)獲得了 FDA 的批準。該產品于 2018 年獲得批準,由基于 PEG 的水凝膠制成,該水凝膠含有醋酸三賴氨酸和用于可視化的熒光素、緩沖鹽和水。這種基于水凝膠的系統被植入管內(進入眼點)并釋放地塞米松 1 個月,以治療眼科手術后的眼部炎癥和疼痛。僅一種基于水凝膠的產品已獲批準這一事實表明,由于水凝膠制劑的高含水量和孔隙率,該技術用于實現長效給藥具有一定的挑戰。大多數長效給藥產品都是為全身給藥而設計的;然而,上述 FDA 批準的產品中有 30% 用于局部給藥,通過最大限度地提高作用部位的藥物濃度和最大限度地減少全身脫靶效應來提高藥物療效和安全性。隨著人們對長效藥物制劑價值和需求的認識不斷提高,必要材料和給藥制劑設計的進步,自 1953 年推出第一個長效給藥制劑以來,控釋給藥在醫療實踐中穩步增長。經 FDA 批準的 63 種長效藥物產品中的大多數今天仍在市場上銷售,只有 21% 已停產。幾乎所有的長效藥物釋放產品都是基于不可降解、預先形成的可生物降解和基于溶解的藥物釋放機制,每個類別的產品貢獻大致相同。只有 6% 的產品基于原位形成的可生物降解聚合物的藥物釋放,只有一種 FDA 批準的長效藥物使用水凝膠介導的釋放。許多長效藥物產品 (39%) 實現 1 個月的釋放,而其他產品的藥物釋放時間為 1 至 3 個月(23%)、3 至 6 個月(14%)、6 至 12 個月(7%) 和 1 年以上 (17%)。鑒于繼續進入市場的產品數量以及來自公開披露和商業數據庫的信息,長效給藥產品在患者護理中繼續發揮重要作用似乎很明顯,而且還有更多產品正在開發中。這些制劑的技術挑戰仍然是確定劑量大小和釋放持續時間,這與藥物效力和注射量限制有關。第二個相當大的障礙是蛋白質和其他生物制劑在微膠囊化和緩釋過程中的物理化學穩定性管理。長效注射劑的機會繼續增長,人們對全身給藥和局部給藥(如眼部和關節給藥)持續感興趣,最近對支持免疫療法的生物制劑和藥物給藥制劑的給藥也產生了興趣。Li,W., Tang, J., Lee, D. et al. Clinical translation of long-acting drug deliveryformulations. Nat Rev Mater (2022).https://doi.org/10.1038/s41578-021-00405-w