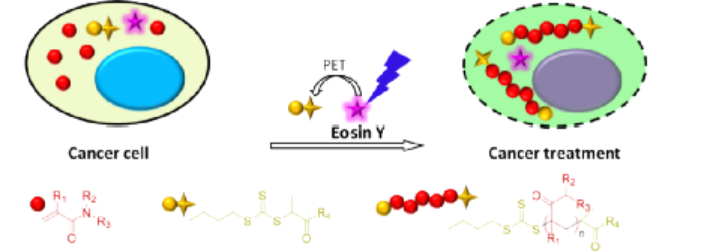
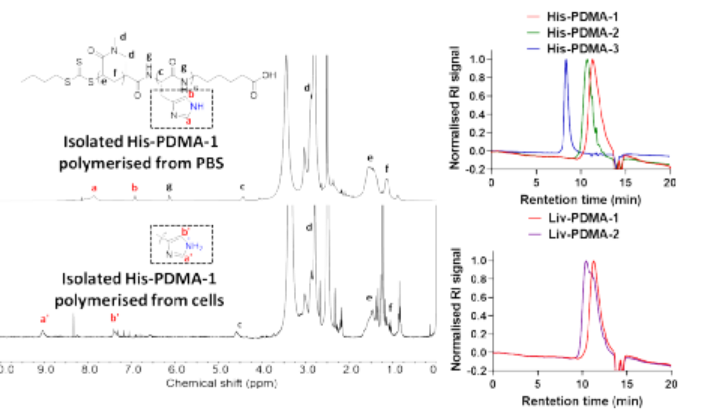
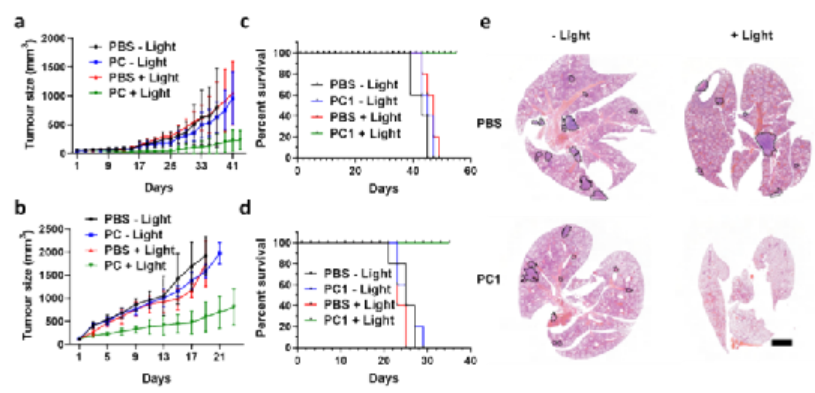
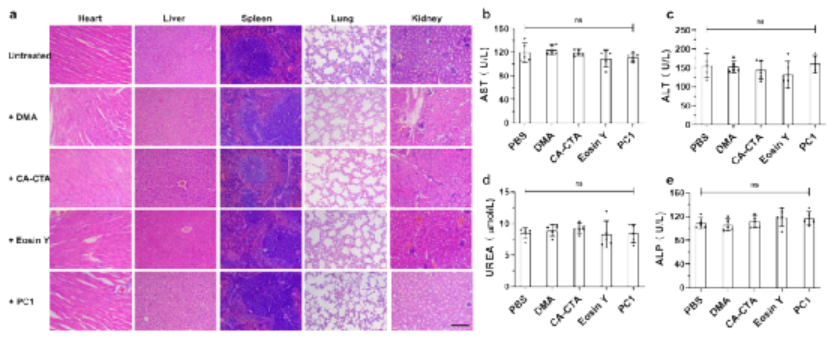
細(xì)胞內(nèi)化學(xué)環(huán)境具有高度復(fù)雜性并且細(xì)胞對外部刺激極為敏感,因此利用化學(xué)手段在活細(xì)胞內(nèi)實現(xiàn)非天然分子結(jié)構(gòu)轉(zhuǎn)化,特別是人工大分子合成一直以來都較為困難,但科研人員對這一領(lǐng)域的探索卻從未停止。可以試想如果將人工大分子引入細(xì)胞內(nèi),他們是否會與天然大分子發(fā)生相互作用,是否會影響細(xì)胞行為,是否會改變細(xì)胞原有的功能,是否能殺死腫瘤細(xì)胞實現(xiàn)腫瘤治療?更進一步,人工大分子是否能替代某些天然分子恢復(fù)受損細(xì)胞的功能,是否能按人類的意愿使細(xì)胞獲得新的功能?但由于相關(guān)技術(shù)所限,對這些問題的探索目前僅僅處于起步階段。基于以上背景,中科院深圳先進技術(shù)研究院的耿晉團隊在前期工作中探索了在活細(xì)胞內(nèi)構(gòu)建人工大分子聚合物的可能性,發(fā)現(xiàn)細(xì)胞內(nèi)聚合能顯著改變細(xì)胞周期、細(xì)胞骨架結(jié)構(gòu)、以及細(xì)胞運動能力等性質(zhì),并在Nature Chemistry(2019, 11, 578)上報道了此研究成果。在此研究的基礎(chǔ)上,作者團隊進一步突破創(chuàng)新,開發(fā)了一種全新的基于光控細(xì)胞內(nèi)聚合的腫瘤精準(zhǔn)治療新方法,以“Controlled Intracellular Polymerisation for Cancer Treatment”為題發(fā)表在《JACS au》。圖1. 基于細(xì)胞內(nèi)聚合的精準(zhǔn)腫瘤治療示意圖作者利用光控PET-RAFT聚合替代自由基聚合的方法,實現(xiàn)了分子量可預(yù)測、可調(diào)控的聚合物合成方法學(xué)開發(fā),同時使所獲得聚合物的分子量分布大幅降低,有效提高了聚合物的規(guī)整度,并且有效提高了細(xì)胞內(nèi)聚合體系在時間、空間上的可控性和可重復(fù)性,大幅減少單體及引發(fā)劑的用量,降低聚合反應(yīng)物體系本身對細(xì)胞產(chǎn)生的毒性。同時我們對細(xì)胞內(nèi)聚合體系的應(yīng)用潛力進行了進一步探索,以腫瘤治療為目的對聚合單體庫進行了更大范圍的篩選,并成功發(fā)展了一種基于細(xì)胞內(nèi)聚合的精準(zhǔn)腫瘤治療體系(如圖1所示)。通過對細(xì)胞毒性的篩查研究,我們發(fā)現(xiàn)了一類本身具有較低毒性的丙烯酰胺聚合單體能夠在聚合后顯著提高其細(xì)胞毒性,高效引起腫瘤細(xì)胞的凋亡和壞死,并利用這一性質(zhì)開發(fā)了一種全新精準(zhǔn)腫瘤治療方法。圖2. 細(xì)胞內(nèi)提取聚合物的分析表征首先作者對細(xì)胞內(nèi)聚合條件進行了系統(tǒng)的優(yōu)化,使一系列細(xì)胞耐受度高的水溶性單體成功在細(xì)胞內(nèi)轉(zhuǎn)化為結(jié)構(gòu)可控、分散度低的大分子聚合物。為了進一步確定細(xì)胞內(nèi)合成聚合物的組成及結(jié)構(gòu),我們采用了組氨酸標(biāo)簽提取技術(shù)對細(xì)胞內(nèi)原位合成的聚合物進行了高效提取,并通過核磁共振以及凝膠滲透色譜等表征手段對聚合物分子結(jié)構(gòu)進行了詳細(xì)表征(如圖2所示)。我們發(fā)現(xiàn),利用光控PET-RAFT獨特的聚合機理,我們可以在細(xì)胞內(nèi)實現(xiàn)具有較大分子量、分散度低、并且鏈端官能團結(jié)構(gòu)確定的聚合物分子的高效合成制備。更重要的是,利用這一方法學(xué),我們能夠通過調(diào)控RAFT鏈轉(zhuǎn)移劑與單體的比例實現(xiàn)聚合物分子量的調(diào)控,合成結(jié)構(gòu)可調(diào)的均聚物及共聚物,并且可以通過二次聚合的方式實現(xiàn)聚合物的細(xì)胞內(nèi)原位拓鏈反應(yīng)。以上成果都為活細(xì)胞的人工修飾研究提供了有效的理論和實踐支持。圖3. 細(xì)胞內(nèi)聚合(a)促進腫瘤細(xì)胞凋亡壞死(b-d)抑制腫瘤細(xì)胞增殖(e-f)抑制腫瘤細(xì)胞遷移在研究中我們發(fā)現(xiàn),N,N-二甲基丙烯酰胺(DMA)這一特殊的聚合單體能夠在細(xì)胞內(nèi)原位聚合后高效誘導(dǎo)細(xì)胞周期停滯、細(xì)胞凋亡以及壞死性凋亡并減少細(xì)胞增殖和遷移。基于這一獨特的性質(zhì),我們設(shè)計構(gòu)建了一種基于“低毒性聚合單體光控原位轉(zhuǎn)化為高毒性聚合物大分子藥物”的全新腫瘤精準(zhǔn)治療前藥策略,并對其腫瘤治療機制進行了系統(tǒng)研究。如圖3所示,細(xì)胞內(nèi)原位聚合能夠通過影響線粒體功能以及調(diào)控凋亡及壞死因子PARP、p53、BCL-2、BAX等途徑誘導(dǎo)腫瘤細(xì)胞凋亡和壞死。同時我們發(fā)現(xiàn)細(xì)胞內(nèi)聚合能夠通過阻礙細(xì)胞內(nèi)DNA合成,抑制細(xì)胞周期,進而影響腫瘤細(xì)胞增殖,同時我們發(fā)現(xiàn)關(guān)鍵細(xì)胞周期調(diào)節(jié)因子cyclin B1和cyclin E1的表達都受到了顯著抑制,進一步證明了細(xì)胞內(nèi)聚合對細(xì)胞周期的抑制作用。進一步我們探究了細(xì)胞內(nèi)聚合對腫瘤細(xì)胞遷移的影響,我們發(fā)現(xiàn)聚合單體在細(xì)胞內(nèi)轉(zhuǎn)化為聚合物后能夠大幅增加細(xì)胞粘度,并且顯著抑制了關(guān)鍵腫瘤細(xì)胞遷移蛋白標(biāo)記物E-cadherin、Vimentin以及Snail的表達,進而有效抑制了腫瘤細(xì)胞的遷移。圖4. 細(xì)胞內(nèi)聚合在動物模型上抑制腫瘤發(fā)展及轉(zhuǎn)移進一步作者在動物模型上探索了這一光控腫瘤治療前藥體系的腫瘤治療效果。研究中我們采用了人宮頸癌(HeLa)、人乳腺癌(MDA-MB-231)以及小鼠乳腺癌(4T1)三種腫瘤模型對細(xì)胞內(nèi)聚合前藥體系的療效進行了系統(tǒng)研究,通過對腫瘤體積增長以及動物存活周期的監(jiān)測我們發(fā)現(xiàn),細(xì)胞內(nèi)聚合在動物模型上能夠?qū)崿F(xiàn)與細(xì)胞模型上一致的腫瘤治療效果,并且通過對腫瘤組織的切片染色分析,我們發(fā)現(xiàn)細(xì)胞內(nèi)聚合對腫瘤發(fā)展抑制作用的機理也與我們前期細(xì)胞實驗研究結(jié)果相一致。更重要的是,我們利用4T1腫瘤小鼠作為腫瘤轉(zhuǎn)移模型,發(fā)現(xiàn)細(xì)胞內(nèi)聚合對腫瘤轉(zhuǎn)移有高效抑制作用,而腫瘤轉(zhuǎn)移是目前臨床上腫瘤治療失敗的最主要原因之一,因此可以預(yù)測,基于細(xì)胞內(nèi)聚合的腫瘤治療策略將有望顯著改善目前基于化療的腫瘤治療效果。圖5. 基于細(xì)胞內(nèi)聚合腫瘤治療體系的安全性驗證最后我們對細(xì)胞內(nèi)聚合前藥體系的生物安全性進行了驗證,研究發(fā)現(xiàn)實驗動物的體重、血液學(xué)參數(shù)以及主要器官的組織學(xué)特征都沒有受到細(xì)胞內(nèi)聚合或任意組分給藥的影響,充分驗證了該體系的生物安全性。基于以上研究成果,我們相信本工作所開發(fā)的基于細(xì)胞內(nèi)聚合的精準(zhǔn)腫瘤治療方法將開啟聚合物治療癌癥治療的全新篇章。