核醫學和分子成像學會在其網站上將分子成像定義為一種醫學成像,它提供了在分子和細胞水平上發生的身體內部情況的詳細圖片。這種準確但陳舊的定義掩蓋了研究人員和臨床醫生在過去 20年中在將分子成像原理應用于多個領域(從基礎科學和轉化科學到最先進的患者診斷和治療)方面取得的巨大進步。從根本上說,分子成像允許對在解剖成像水平上不可見的生化過程和目標定位模式進行可視化。
盡管可以在組織內利用或誘導內源性圖像對比度,但大部分分子成像需要使用顯像劑,通常是靜脈注射,它與目標環境相互作用以揭示生物通路。由于分子成像的一個特點是對所研究的細胞、環境或過程沒有擾動,因此成像劑通常用作示蹤劑,對它們旨在測量的實體沒有影響。示蹤劑可以是參與代謝途徑的分子或分子類似物,或者它們可以被靶向用作特定酶、受體、抗原或轉運蛋白的底物或與特定酶、受體、抗原或轉運蛋白結合。在許多情況下,示蹤劑將被放射性標記,即使用放射性核素,盡管如下所述,情況并非總是如此。分子成像所需的第二個組件是適當的硬件——可以檢測示蹤劑并將檢測轉化為空間信息的傳感器或掃描儀。優化的分子成像方法應具有用于在感興趣的過程中幾乎唯一存在的路徑或目標的高親和力示蹤劑,以及具有高靈敏度和高空間、對比度和時間分辨率的掃描儀。
于此,約翰斯霍布金斯大學Martin G. Pomper和Steven P. Rowe在CA: A Cancer Journal for Clinicians(IF=508.7)上重點關注突出腫瘤學中分子成像的選定、常見的成像方式和示例。

具體來說,作者詳細介紹了光學和近紅外 (NIR) 成像、磁共振成像 (MRI) 和核醫學技術,包括單光子發射計算機斷層掃描 (SPECT) 和正電子發射斷層掃描 (PET)。還提供了利用分子成像的轉化科學和癌癥臨床護理的具體示例,特別關注使用這些方法來指導和改善患者管理。最后,作者還描述了該領域面臨的挑戰以及克服這些挑戰的潛在好處。
成像方式
光學成像主要是一種臨床前工具。NIR 在術中成像方面具有多種優勢,包括在血液和其他組織中的低吸收、低散射以及在沒有儀器幫助的情況下對人眼不可見。NIR 引導的手術為更好地區分病變組織和正常組織、降低切緣陽性率和最小化麻醉時間提供了機會。由于這些原因,NIR 已被廣泛探索用于指導癌癥手術。
表面增強拉曼散射 (SERS) 是另一種具有高靈敏度和特異性的光學成像,用于描繪手術邊緣。盡管光學技術在很大程度上仍處于臨床前領域,但其他分子成像方式的示蹤劑開發的進步可能有助于推動 NIR 探針轉化為人類臨床實踐。
還有其他的成像模式及其優缺點可以參考下圖:
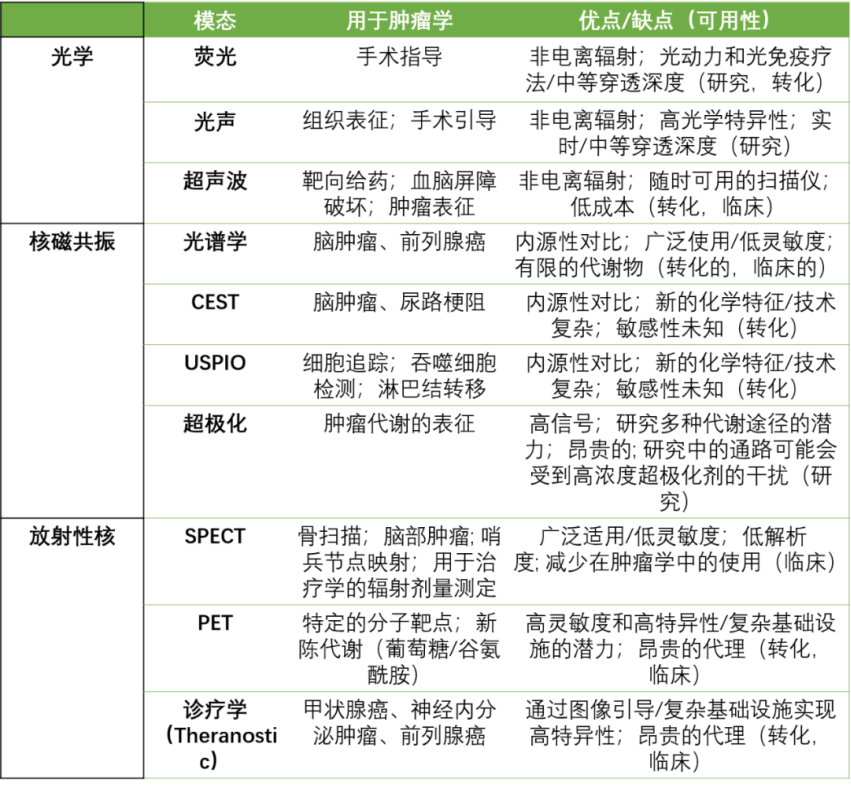
圖|腫瘤學中分子成像的選擇方式和相對優缺點
分子成像應用實例
用于手術指導的近紅外成像
將光學成像技術應用于人體的主要限制是光學探頭的探測器可實現的穿透深度有限。然而,在術中成像的背景下,這種限制幾乎沒有實際意義,其中暴露了正在研究的組織。因此,光學成像技術已被廣泛研究用于外科手術指導。NIR探針已被建議用于改善臨床工作流程,并在速度、患者結果和成本方面相對于傳統的非引導手術方法具有優勢。
NIR試劑首次應用于術中指導是使用吲哚菁綠(ICG),這是一種經美國FDA批準的染料。在一項初步研究中,研究人員發現,吲哚菁綠的肝膽排泄可以清楚地描繪淺表結直腸肝轉移和原發性肝細胞癌。腫瘤由周圍的熒光邊緣劃定,在正常肝臟中幾乎沒有背景吸收。
自第一項研究以來,可用的 NIR 探針的數量迅速擴大到包括特定的腫瘤靶向小分子、肽、抗體和適體。盡管是臨床前研究,但該研究是使用癌癥中蛋白質表達改變模式來驅動癌癥傳播細微部位的特定成像的一個很好的例子。
NIR 手術引導正在各種器官系統中進行。然而,迄今為止,它在大腦中的應用最為廣泛。侵襲性神經膠質瘤的最大切除在生存方面具有優勢,但盡量減少對周圍大腦的影響以避免神經功能缺損也很重要。盡管仍有大量研究要做,以將特定的、以腫瘤為靶點的 NIR 手術指導作為手術的一部分。常規臨床工作,有希望的臨床前結果表明,應廣泛開展這一研究。例如,目前正在招募患者(NCT04574401),用于熒光識別陽性原發性腫瘤邊緣和 PCa 男性患病淋巴結的 1 期研究。在未來幾年,隨著用于新型癌癥相關靶點近紅外成像的新化合物的開發,我們可能會看到針對類似適應癥的幾項額外臨床試驗。
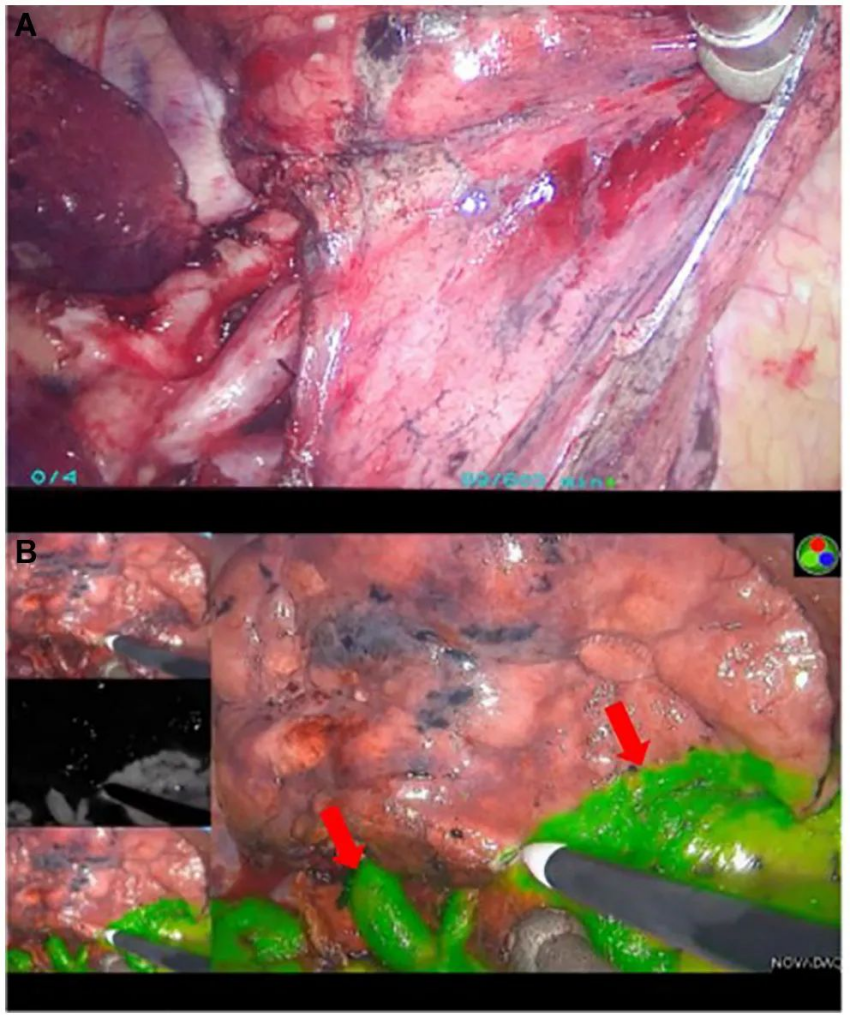
圖|在肺段切除術中使用吲哚菁綠進行手術指導
磁共振波譜(MRS)
磁共振波譜顯示的最常見代謝物是 N-乙酰天冬氨酸 (NAA)、膽堿 (Cho)、肌酸/磷酸肌酸 (Cr) 和乳酸。這些化合物在腦中的正常相對濃度以及不同類型腦腫瘤中這些濃度的擾動是眾所周知的。在正常情況下,NAA(一種推定的神經元標志物)包含光譜中的最高峰,而 Cr 和 Cho 的濃度較低。與正常腦相比,腫瘤通常表現出異常降低的 NAA/Cr 和升高的 Cho/Cr 比率,表明正常神經組織內部損失,但細胞更新率更高;然而,腫瘤分級之間的內在異質性可能使得難以從 MRS 數據中得出腫瘤侵襲性。
盡管如此,MRS方法在腦腫瘤評估中的巧妙應用導致了對重要腫瘤特征的無創測定。未來的發展可能會增加MRS 的相關性。將超高場 7-Tesla 掃描儀引入臨床、光譜編輯,以及新技術的出現像 MR 指紋識別可能會克服一些限制,例如低靈敏度。
化學交換飽和轉移 MRI 腦腫瘤成像
在一項關鍵的臨床前研究中,研究人員給小鼠接種了人類膠質瘤細胞系,然后使用葡萄糖作為動態造影劑來觀察腫瘤。通過使用可以檢測葡萄糖中可水交換的羥基質子(葡萄糖CEST)的頻率偏移,血腦屏障區域在圖像上變得明顯。這種稱為動態葡萄糖增強 (DGE) MRI 的方法具有顯著的吸引力,因為注入的造影劑也是一種內源性代謝物,并且不使用具有潛在毒性的釓金屬螯合物。
鑒于有希望的臨床前結果,DGE MRI 已在人類受試者中進行了探索。在對 4 名健康志愿者和 3 名患有神經膠質瘤的患者進行的初步研究中,DGE GlucCEST 在腫瘤內表現出空間可變的增強。有趣的是,增強都隨時間而變化,并且與基于釓的增強區域并不嚴格一致。這些發現表明,DGE MRI 可能提供額外的信息,包括血腦屏障的相對通透性和腫瘤不同部位固有的糖酵解代謝程度。鑒于控制葡萄糖和釓造影劑攝取的明顯空間和時間復雜過程,很可能需要來自人工智能的見解才能從這些模式中獲得詳細的預后信息。
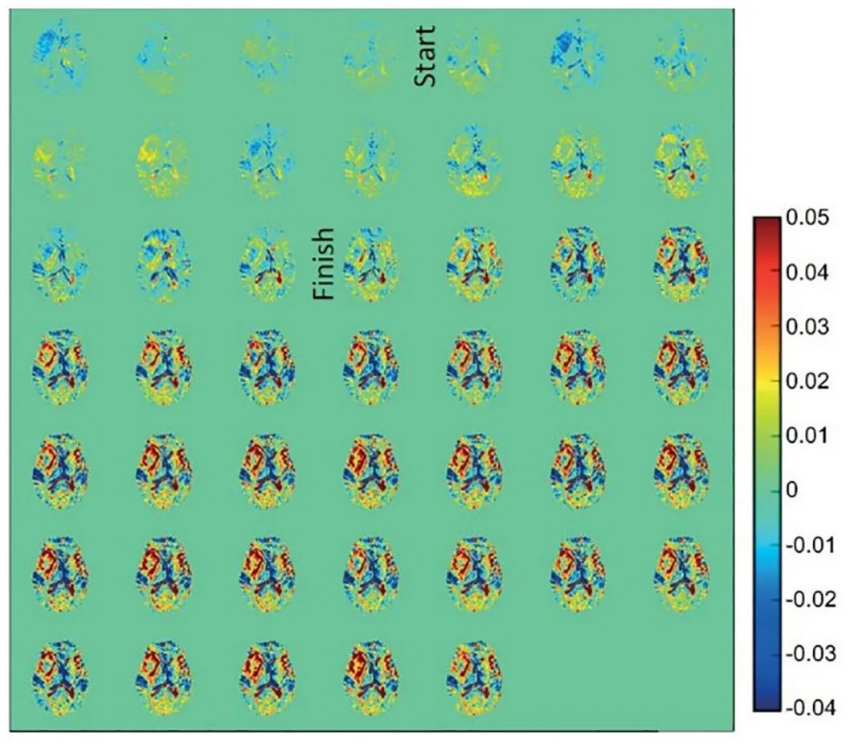
圖|這些是 5.3 秒時間分辨率的軸向動態葡萄糖增強差異圖像。注意以右側島葉區域為中心并延伸到右側額葉和顳葉的差異和異質增強。盡管異常右側和正常左側之間的對比度比其他一些分子成像方式可能遇到的要小,但令人印象深刻的是,腫瘤可視化可以通過外源性應用葡萄糖來實現。
2-脫氧-2-[18F]氟代-D-葡萄糖的癌癥成像
2-deoxy-2-[18F]fluoro-D-glucose(18F-FDG) 在臨床上的廣泛應用對腫瘤成像具有如此巨大的意義,以至于整本教科書都圍繞這一主題編寫。18F-FDG 定位于大多數類型的惡性腫瘤,因為它具有類似葡萄糖的結構,這導致在進行糖酵解代謝的細胞中通過 GLUT1 轉運蛋白攝取。18F-FDG的優勢在于其缺乏特異性——其攝取機制的普遍性使其廣泛用于多種惡性腫瘤的分期、再分期和治療監測。盡管新的放射性示蹤劑越來越多地用于特定類型的癌癥,而早期臨床開發中的其他藥物可能會挑戰 18F-FDG 作為主要的通用癌癥成像放射性藥物的作用,但一些進展可能會在幾年內保持18F-FDG 的高度相關性來。
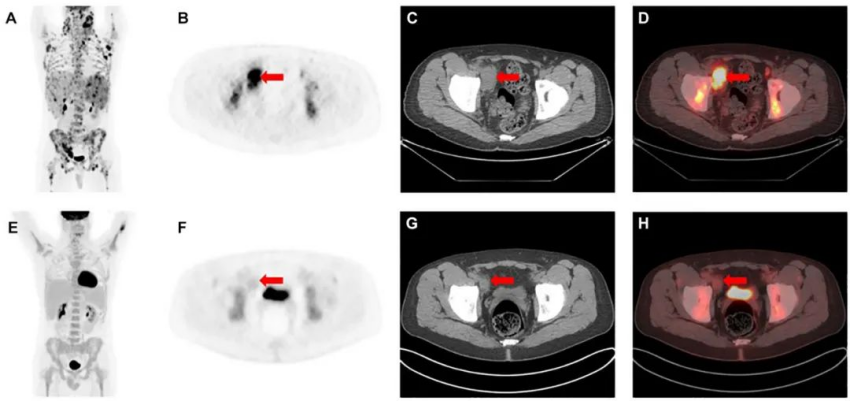
圖|一名 24 歲男性Epstein-Barr 病毒相關淋巴瘤患者在全身治療前后
基于生長抑素受體的成像和治療
由神經內分泌細胞組成的腫瘤通常會在其表面表達大量的生長抑素受體 (SSTR),尤其是 SSTR 亞型2。這提供了一種通過應用高親和力 SSTR 配體進行成像和治療的方法。多年來,SPECT 放射性示蹤劑111In-pentetreotide (OctreoScan) 一直用于這種情況下,通常用于成像,盡管使用高劑量時,治療是可能的。然而,目前神經內分泌腫瘤的分子成像和治療范例是基于 PET 放射性示蹤劑 68Ga-DOTATATE(或幾種密切相關的藥物之一)及其治療類似物 177Lu-DOTATATE。
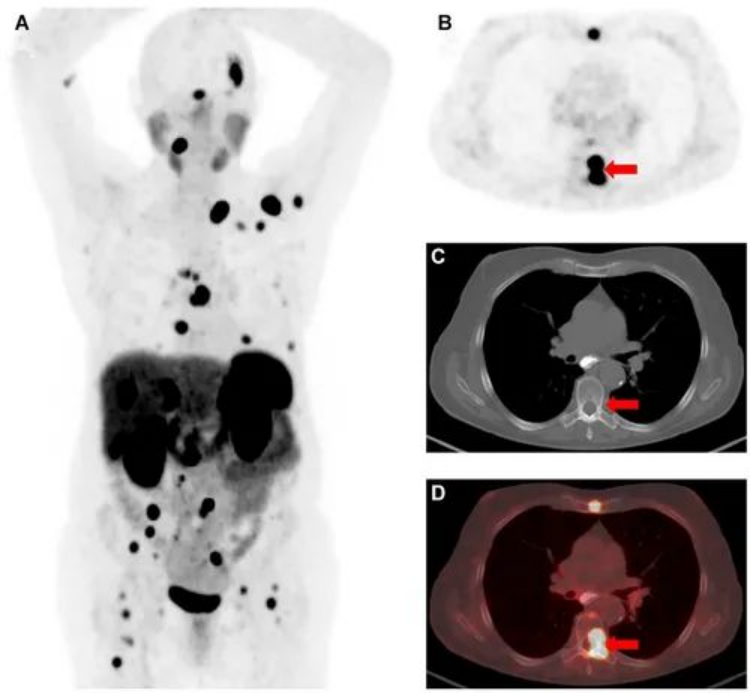
圖|一名患有轉移性小腸神經內分泌腫瘤的 74 歲女性的PET/CT成像,注射68Ga-DOTATATE
基于成纖維細胞活化蛋白的成像
成纖維細胞激活蛋白 (FAP) 是各種癌癥成像和治療的快速新興靶點。FAP 是分子成像應用的絕佳靶點,因為它有限的正常組織分布以及在癌癥相關成纖維細胞上的高表達。目前,已經出現了一些很有前景的潛在應用。如,一種68 Ga 標記的 FAP 抑制劑(68Ga-FAPI) 改變了 19 名患者中的 10 名 (53%)的分期。此外,鑒于18 F 標記化合物的固有優勢,研究人員已開始用放射性氟標記基于 FAPI 的放射性示蹤劑。
感染成像
最后,作者還介紹了感染成像。由于使用化學療法、免疫療法、干細胞移植和其他治療方式,許多癌癥患者的免疫功能低下。因此,它們容易受到許多生物體的感染,包括典型的社區獲得性病原體和非典型病毒、細菌和真菌。癌癥患者也經常被成像,這意味著即使是亞臨床感染也可能暴露出來。
大多數病原體相對于人類宿主所擁有的完全不同的代謝途徑表明細菌特異性分子成像可能是可能的。已經研究了幾種利用獨特病原體代謝的放射性示蹤劑,并取得了不同程度的成功。這應該仍然是一個活躍的調查領域,因為識別病原體的重要性,否則這些病原體可能難以通過侵入性采樣獲得,以及適當的抗生素治療對避免發病率和死亡率的影響。例如,有研究證明,腸桿菌屬感染可以用2-deoxy-2-[18F]fluoro-D-山梨糖醇特異性成像,這是一種哺乳動物細胞不使用的放射性標記糖衍生物。將放射性示蹤劑用于細菌特異性代謝途徑可能與對宿主炎癥細胞特異性高于 18F-FDG 的藥物的進一步研究相吻合。
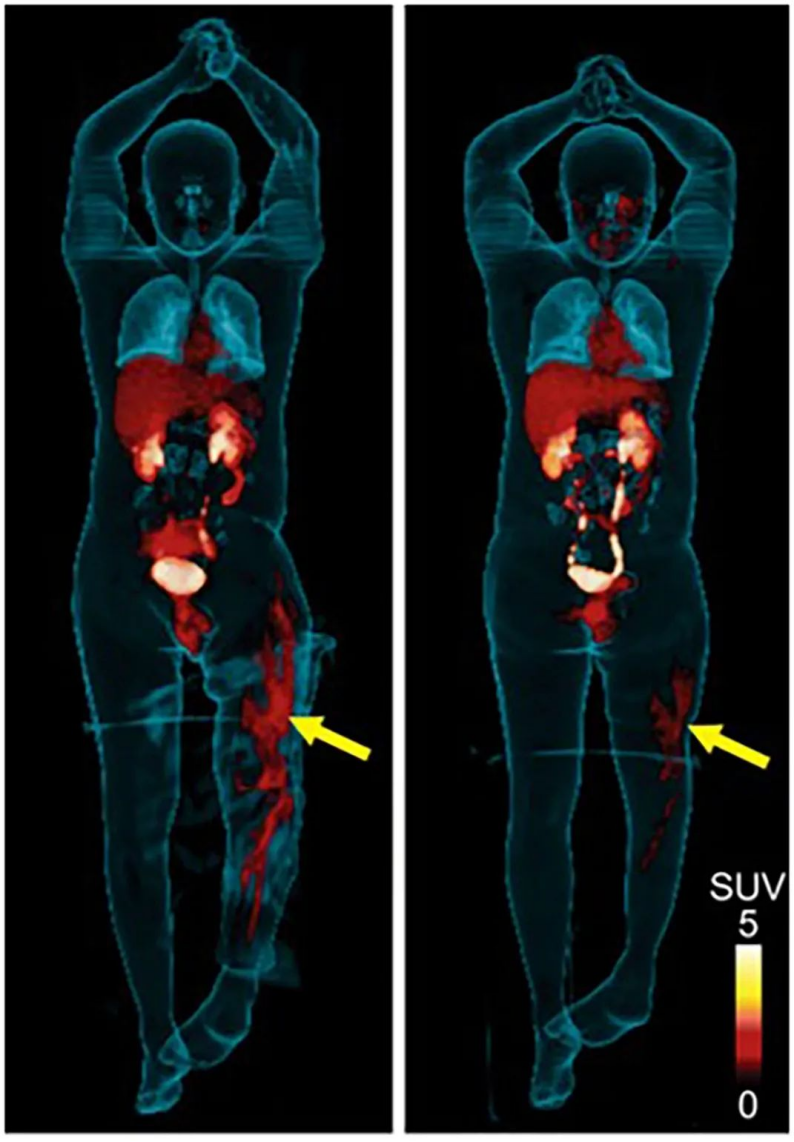
圖|使用病原體特異性正電子發射斷層掃描對患者的腸桿菌感染進行成像
挑戰、潛力和未來方向
憑借廣泛的模式和眾多可用的探針和技術,分子成像不是一個技術受限的領域。臨床前發現的步伐遠遠領先于新發現被臨床轉化的速度。其中一些與臨床前工作的內在優勢、BLI 等簡便技術的可用性以及可以確定有意義的腫瘤學結果(例如,總生存期)的速度有關。然而,還有一個壓倒一切的監管環境限制了新分子顯像劑的有效轉化。
無論美國的監管環境如何,新的分子成像方法將繼續在世界范圍內被采用,作為改進癌癥診斷和治療的手段。具體而言,治療診斷學已為未來幾年的快速擴張做好了準備。如上所述,核醫學醫師有責任帶頭確保患者能夠獲得新的放射性藥物療法,并且這些療法可以在核醫學科室安全有效地實施。
越來越多地使用治療診斷劑來管理癌癥將與人工智能在幾個相關應用中的使用相吻合。在這種情況下,我們通常會提到弱人工智能,即基于神經網絡的人工智能算法,可以從現有數據中學習,并在接觸到新數據時做出相關和準確的判斷。
簡而言之,人工智能和分子成像的融合有望從根本上改變我們在疾病診斷中的成像方法。這兩個領域將以協同方式相互影響。當前的分子顯像劑將繼續使用,生成可用于開發 AI 算法的大型數據集。從分子成像中獲得的重要生物信息在推動人工智能產生有意義的臨床結果預測的能力方面將特別高產。反過來,人工智能將推動新的分子成像放射性示蹤劑的開發,將有助于從分子成像研究中提取重要信息,這些信息對于人類視覺檢測來說過于微妙,并將為轉診臨床醫生和患者提供強大的預后信息。
參考文獻:
Rowe,SP, Pomper, MG. Molecular imaging in oncology: Current impact and futuredirections. CA Cancer J Clin. 2021.
https://doi.org/10.3322/caac.21713











