微生物組在人類健康中發揮著許多功能性作用,隨后引起了人們對使用活細菌治療疾病的興趣。因為微生物可以被設計成能夠感知和響應環境的智能活體藥物,它們可以在胃腸道、口腔、皮膚、肺和腫瘤中定殖,并在局部提供治療。然而,來自活細菌的宿主毒性已被證明會限制耐受劑量和療效,在某些情況下會導致臨床試驗終止。此外,與傳統藥物載體不同,細菌在癌組織中持續增殖、轉移和傳遞治療有效載荷的獨特能力需要對體內細菌藥代動力學進行強有力的時間控制。一種規避活細菌療法的免疫原性和毒性的方法是產生免疫原性細菌表面抗原的基因敲除,例如脂多糖 (LPS)。但正如細菌癌癥治療的臨床試驗所見,這種策略會導致永久的菌株衰減和定植減少。表面調制已廣泛應用于藥物載體的隱身,因此,另一種策略是用藻酸鹽、殼聚糖、聚多巴胺、脂質和納米顆粒等分子合成微生物表面涂層。這些一次性的、靜態的細菌修飾不允許原位調節,并且可能導致不受控制的生長、脫靶組織毒性或受損的細胞功能,從而導致功效降低。因此,在不影響安全性的情況下增強細菌遞送是癌癥活微生物療法臨床轉化的核心挑戰。鑒于此,哥倫比亞大學Tal Danino、Kam W. Leong等人提出了一種可調節的微生物表面工程策略,使用合成基因回路來動態控制細菌與其周圍環境的相互作用。成果表在Nature Biotechnology上。
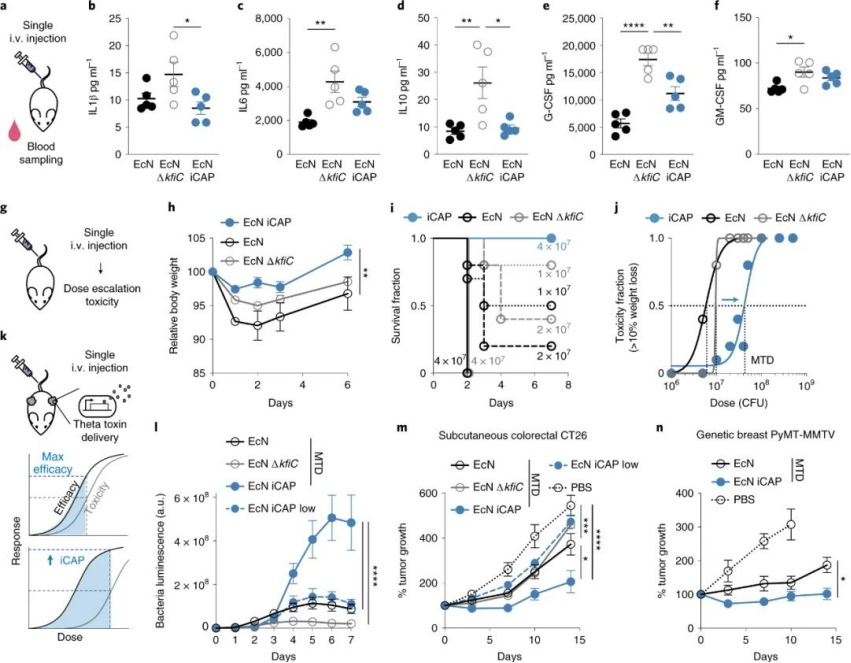
研究人員專注于細菌表面莢膜多糖 (CAP),這是一種天然的細胞外生物聚合物,可包裹細胞外膜并保護微生物免受各種環境條件的影響。在人體中,CAP 通過保護微生物免受各種免疫因子(如補體調理素和吞噬細胞)的影響,促進細菌的存活和定植。受其保護細菌的天然能力的啟發,研究人員應用合成生物學方法對CAP生物合成進行基因工程改造,以增強體內微生物的傳遞。具體來說,研究人員構建了一個可編程的 CAP 表達系統,該系統通過外部誘導劑調節細菌表面,從而調節細菌與抗菌劑、噬菌體、酸度和宿主免疫的相互作用。簡單點來講就是:有了 CAP,這些細菌可以暫時逃避免疫攻擊;如果沒有 CAP,它們就會失去封裝保護,可以在體內清除。為此,研究人員設計了一種新的CAP系統,他們稱之為誘導型 CAP 或 iCAP。他們通過給iCAP 系統提供一個外部信號(一種稱為 IPTG 的小分子)來控制 iCAP 系統,該信號允許對大腸桿菌Nissle 1917表面進行可編程和動態的改變。由于 iCAP 以定向方式改變細菌與免疫系統的相互作用(例如血液清除和吞噬作用),研究小組發現,他們可以通過調整給予 iCAP 大腸桿菌的 IPTG 量來控制細菌在人體血液中存活的時間。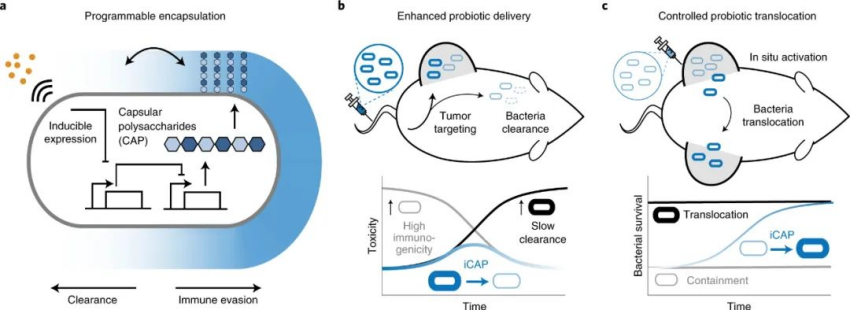
圖|用于控制細菌封裝和體內遞送曲線的可編程 CAP 系統
該團隊使用小鼠腫瘤模型證明,通過 iCAP,他們可以將細菌的最大耐受劑量提高10倍。他們封裝了大腸桿菌菌株,使其能夠逃避免疫系統并到達腫瘤。因為他們沒有在體內給予 IPTG,所以大腸桿菌 iCAP 會隨著時間的推移失去封裝,并且更容易在身體的其他部位被消除,從而最大限度地降低毒性。圖|瞬時 CAP 激活可改善體內系統性細菌遞送和功效
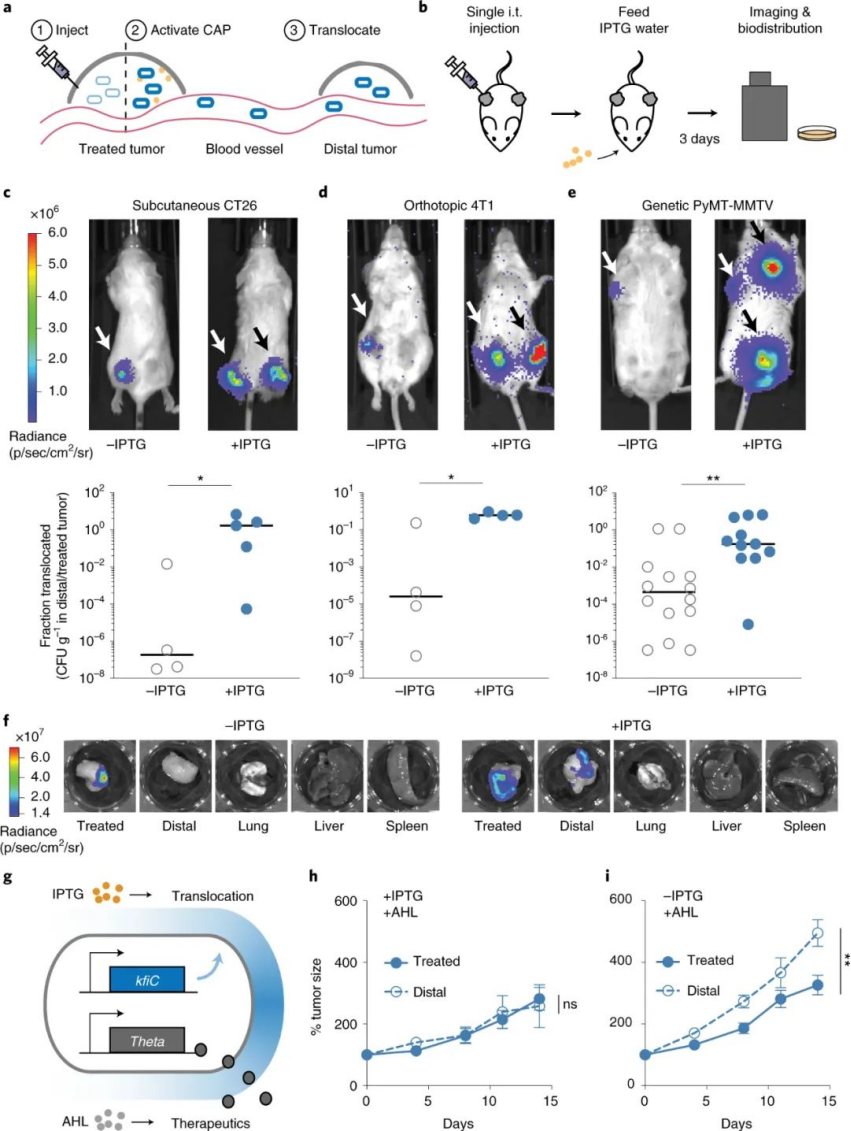
為了測試功效,研究人員隨后設計了大腸桿菌 iCAP 以產生抗腫瘤毒素,并且能夠比沒有 iCAP 系統的對照組更能縮小結直腸癌和乳腺癌小鼠模型中的腫瘤生長。該團隊還展示了體內可控的細菌遷移。過去的研究表明,在腫瘤生長時,低水平的細菌會從腫瘤中滲出。在這項新研究中,該團隊使用 iCAP 來證明它們可以控制細菌從腫瘤中滲漏,以及它們轉移到其他腫瘤。他們將大腸桿菌iCAP 注射到一個腫瘤中,給小鼠喂食含有 IPTG 的水,在腫瘤內激活 iCAP,然后看到大腸桿菌iCAP滲出并遷移到未注射的腫瘤中。圖|CAP的原位激活使細菌易位和藥物輸送到遠端腫瘤本文已經展示了一種合成生物學方法,用于在體內治療遞送的背景下動態和可調地調節細菌表面。利用 CAP 系統的自然進化與多種環境交互,作者展示了工程細菌與宿主免疫、噬菌體、抗菌劑和酸度的相互作用。此外,鑒于人類對內毒素的敏感性是小鼠的 250 倍,希望該結果對細菌療法的臨床轉化產生影響。但仍需要進一步調查這種方法對人類患者的安全性。除了在細菌癌癥治療中的明確應用外,可編程 CAP 系統的實用性還可以擴展到其他臨床環境。例如,通過胃環境的過程中保護口服益生菌并促進腸道定植。Harimoto, T., Hahn, J.,Chen, YY. et al. A programmable encapsulation system improves delivery oftherapeutic bacteria in mice. Nat Biotechnol (2022).https://doi.org/10.1038/s41587-022-01244-y